Analitika gyakorlat 12 vfolyam Krnyezeti analitikai vizsglatok Fogarasi





- Slides: 7

Analitika gyakorlat 12. évfolyam Környezeti analitikai vizsgálatok Fogarasi József 2009 TÁMOP 2. 2. 3 -07/1 -2 F-2008 -0011

A VÍZ VASTARTALMÁNAK MEGHATÁROZÁSA

A vas jelentősége és előfordulása a vízben A vas a szervezet számára elengedhetetlenül fontos elem. Pl. fontos szerepet játszik az oxigén és szén-dioxid szállítást végző hemoglobin működésében. Az átlagos felnőtt ember szervezete 2, 5– 5 gramm vasat tartalmaz. A vaskészlet 70%-a a hemoglobinban található, a többi a májban, a lépben és a csontvelőben. A vas a talajban és a kőzetekben általánosan előfordul, ezért az ivóvízben található vas természetes úton is odakerülhetett. A talaj, illetve a feszíni vizekben mégis kevés van, mert a vízben élő növények hamar felveszik. Nagyobb mennyiségű vas általában ipari szennyeződésre utal.

A talajvíz literenként akár 1 mg vasat is tartalmazhat. A felszíni vizek vastartalma általában 0, 001 és 10 mg/liter között mozog. A vízben oldott vasat általában nem tekintik veszélyesnek. Az elfogadhatónak tekintett vaskoncentráció javasolt mértéke 0, 15 és 2, 0 mg/liter között van. 2 mg Fe/liter fölött: Kellemetlen ízt ad a víznek. A víz színe megváltozik és barna foltokat hagy. A vízcsövek korrodálódnak, a csapok sokkal hamarabb meghibásodnak.

Vízminta összes vastartalmának meghatározása A Fe 2+-ionok színe halványzöld A Fe 3+-ionok színe halványsárga-okkersárga A vízben alig van, mert a levegő oxigénje feloxidálja. Ha az összes vasat akarjuk mérni, akkor gondoskodni kell arról, hogy minden vasion azonos állapotú legyen. Ezért 1. lépésként az esetleges vas(II)ionokat feloxidáljuk vas(III)ionokká: 2 Fe 2+ + H 2 O 2 + 2 H+ = 2 Fe 3+ + 2 H 2 O A vas(III)ionok jellemző reakciójukkal kimutatható: Fe 3+ 3 SCN– = Fe(SCN)3 A vörös színű komplex színintenzitása arányos a koncentrációjával.

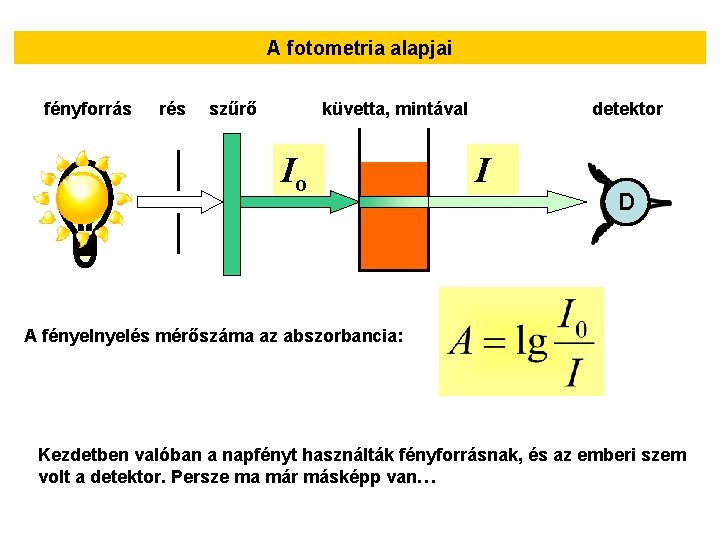
A fotometria alapjai fényforrás rés szűrő küvetta, mintával Io detektor I D A fényelés mérőszáma az abszorbancia: Kezdetben valóban a napfényt használták fényforrásnak, és az emberi szem volt a detektor. Persze ma már másképp van…

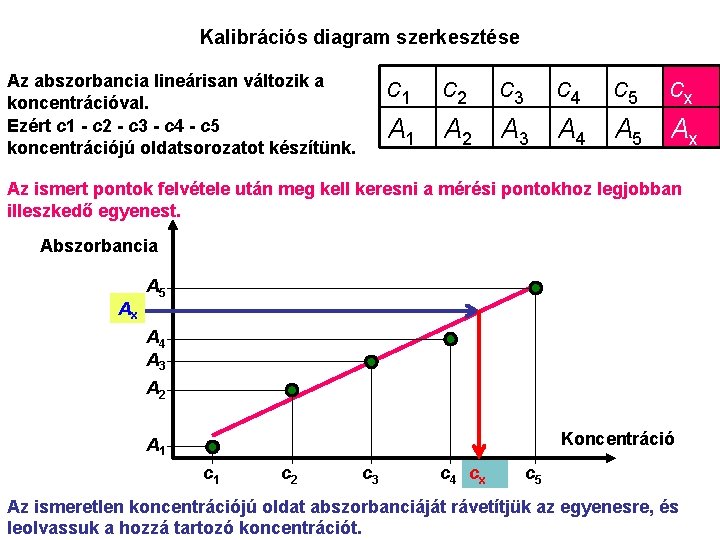
Kalibrációs diagram szerkesztése Az abszorbancia lineárisan változik a koncentrációval. Ezért c 1 - c 2 - c 3 - c 4 - c 5 koncentrációjú oldatsorozatot készítünk. c 1 c 2 c 3 c 4 c 5 cx A 1 A 2 A 3 A 4 A 5 Ax Az ismert pontok felvétele után meg kell keresni a mérési pontokhoz legjobban illeszkedő egyenest. Abszorbancia Ax A 5 A 4 A 3 A 2 Koncentráció A 1 c 2 c 3 c 4 cx c 5 Az ismeretlen koncentrációjú oldat abszorbanciáját rávetítjük az egyenesre, és leolvassuk a hozzá tartozó koncentrációt.