A TITN S VEGYLETEI GYAKORISG S ELFORDULS A


















![A VAS, KOBALT ÉS NIKKEL Co-komplexek: a [Co(H 2 O)6]2+ stabilis, a [Co(H 2 A VAS, KOBALT ÉS NIKKEL Co-komplexek: a [Co(H 2 O)6]2+ stabilis, a [Co(H 2](https://slidetodoc.com/presentation_image/18e07c3e9cc2a34e7efaf9b0123c7894/image-24.jpg)




![PLATINAFÉMEK Komplexeik: az első N 2 komplex: [Ru(NH 3)5 N 2]2+, [Ru(NH 3)5(N 2)(NH PLATINAFÉMEK Komplexeik: az első N 2 komplex: [Ru(NH 3)5 N 2]2+, [Ru(NH 3)5(N 2)(NH](https://slidetodoc.com/presentation_image/18e07c3e9cc2a34e7efaf9b0123c7894/image-30.jpg)

![A RÉZ, EZÜST ÉS ARANY FELHASZNÁLÁS nemesfémek: ékszer [24 karát (100%), Au+Ag(Cu)] elektrotechnika: réz-huzal, A RÉZ, EZÜST ÉS ARANY FELHASZNÁLÁS nemesfémek: ékszer [24 karát (100%), Au+Ag(Cu)] elektrotechnika: réz-huzal,](https://slidetodoc.com/presentation_image/18e07c3e9cc2a34e7efaf9b0123c7894/image-32.jpg)






![A CINK VEGYÜLETEI Oxidja: amfoter: [Zn(OH)4]2 - ← OH- + Zn. O + H+ A CINK VEGYÜLETEI Oxidja: amfoter: [Zn(OH)4]2 - ← OH- + Zn. O + H+](https://slidetodoc.com/presentation_image/18e07c3e9cc2a34e7efaf9b0123c7894/image-39.jpg)

- Slides: 40

A TITÁN ÉS VEGYÜLETEI GYAKORISÁG ÉS ELŐFORDULÁS A 9. leggyakoribb elem, önálló oxidos feldúsulásai ismertek. Ti. O 2 – rutil, Fe. Ti. O 3 – ilmenit ELŐÁLLÍTÁS Nehézségek: oxigénhez való affinitás, reakcióképesség a N, H, és C-nel Kroll eljárás: klór-metallurgia (900 °C) Ti. O 2 + 2 Cl 2 → Ti. Cl 4 + 2 CO Fe. Ti. O 3 + 6 C + 7 Cl 2 → 2 Ti. Cl 4 + 2 Fe. Cl 3 + 6 CO A Ti. Cl 4 és Fe. Cl 3 frakcionált desztillációval szétválasztható, majd Ar atmoszférában Mg-mal redukálható: Ti. Cl 4 + 2 Mg → Ti + 2 Mg. Cl 2 (1000 -1150 °C) FELHASZNÁLÁS szerkezeti anyag (Ti, Ti-Al ötvözet: korrózióálló, kis sűrűségű (repülőgépipar, rakéta és űrtechnika, vegyipari berendezések)

A TITÁN ÉS VEGYÜLETEI FIZIKAI ÉS KÉMIAI TULAJDONSÁGOK - magas op, nagy keménység, ezüstös szín, közepes vezetőképesség; - mechanikai tulajdonságok függenek a szennyeződésektől (H, O, N, C); - oxidációs állapot: +4, +3, +2 ε (Ti. O 2+/Ti 3+)=+0, 10 V; ε(Ti 3+/Ti 2+)=-0, 37 V; ε(Ti 2+/Ti)=-1, 63 V - rendkívül kevéssé reaktív szobahőmérsékleten: felületi oxidréteg védi - szobahőmérsékleten csak a HF oldja: Ti + 6 HF = H 2[Ti. F 6] + 2 H 2 - forró tömény HCl H 2 fejlődés közben oldja (Ti 3+), forró HNO 3 -ban Ti. O 2∙(H 2 O)n képződik. - +4 oxidációs állapotban a Ti amfoter Ti. OSO 4←(cc. H 2 SO 4)←Ti. O 2∙(H 2 O)n →(cc. Na. OH)→Na 2 Ti. O 3∙(H 2 O)4 - magas hőmérsékleten a legtöbb nem fémes elemmel (pl. O, H, N) reagálnak. Oxidja: Ti. O 2 (rutil, anatáz, brookit), ionrácsos, N=6, oktaéderes, O-hidas) igen jó fedőképességű fehér festék (papír, műanyag és gumiipar) O-hidas láncpolimer;

A TITÁN ÉS VEGYÜLETEI Vegyes oxidjai: MTi. O 3 vagy M 2 Ti. O 4 a rácstípus függ a másik fémion méretétől Alacsony oxidációs állapotú oxidok: Ti. O 2 redukciója fém Ti-nal; számos nemsztöchiometrikus oxidfázis képződik: Tin. O(2 n-1) 4≤n≤ 9 Titán-bronzok: Nax. Ti. O 3 (x= 0, 2; 0, 25) kékes fekete színű, fémes megjelenésűek, inertek, jó vezetők Peroxidok: [Ti. O 2)(OH)(H 2 O)4]+ narancssárga színeződés; Szuboxidok: O 2 oldódása fém Ti-ban: fém-fém kötés HALOGENIDEK F- →I- mélyülő szín: erősen polarizáló (Ti. IV) és a halogén kölcsönhatása: töltésátmeneti (CT) sáv) Gáz halmazállapotban MX 4 tetraéderek, szilárd halmazállapotban polimer szerkezet, változó koordinációs szám, halogenid híd Erős Lewis savak, rendkívül könnyen hidrolizálnak (MOX 2), alkoxidokat, Ti(OR)4, képeznek (hőálló festékek, bevonatok)

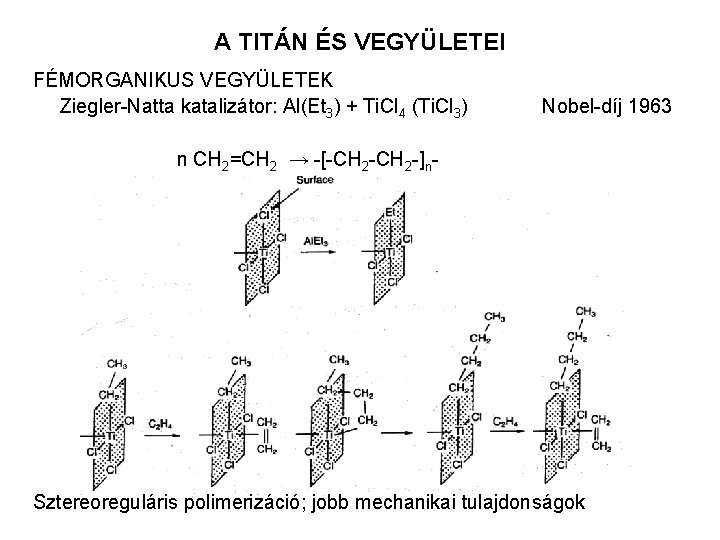
A TITÁN ÉS VEGYÜLETEI FÉMORGANIKUS VEGYÜLETEK Ziegler-Natta katalizátor: Al(Et 3) + Ti. Cl 4 (Ti. Cl 3) Nobel-díj 1963 n CH 2=CH 2 → -[-CH 2 -]n- Sztereoreguláris polimerizáció; jobb mechanikai tulajdonságok

A VANÁDIUM ÉS VEGYÜLETEI GYAKORISÁG ÉS ELŐFORDULÁS mint páratlan rendszámú elem, ritkább a szomszédainál (Harkins-Oddó szabály); gyakran más ércek kísérőjeként fordul elő Pb. Cl 2∙ 2 Pb 3(VO 4)2 – vanadinit, K 2(UO 2)2(VO 4)2∙ 3 H 2 O – karnotit, kőolajokban, élőlényekben (tuniciták, gombák) is feldúsulhat ELŐÁLLÍTÁS V-érc +Na 2 CO 3 +Na. Cl (800 °C) →Na. VO 3 (kioldás +H 2 SO 4)→V 2 O 5 vas jelenlétében Al-mal, vagy Fe. Si-mal redukálják → ferrovanádium VCl 5 redukciója H 2 -nel vagy Mg-mal; V 2 O 5 redukciója Ca-mal FELHASZNÁLÁS acélötvöző (V 4 C 3 képződése, a vas C tartalmával: kopás- és hőállóság)

A VANÁDIUM ÉS VEGYÜLETEI FIZIKAI ÉS KÉMIAI TULAJDONSÁGAIK magas op fém, kemény, bár tiszta állapotban elég puha (kevés szennyeződés is jelentősen növeli keménységét), rendkívül ellenálló, korrózióálló: felületi védő oxidréteg forró, tömény savak (H 2 SO 4, HNO 3, királyvíz, HF+HNO 3) oldják; alkáli olvadékok nem támadják meg; szobahőmérsékleten ellenálló, magas hőmérsékleten a nemfémekkel reagál: intersticiális, nem-sztöchiometrikus vegyületeket képez ionos vegyületeket képező hajlama az oxidációs szám növelésével csökken. redoxi sajátságai: ε(V(OH)4+/VO 2+)=1. 0 V, ε(VO 2+/V 3+)=+0, 34 V, ε(V 3+/V 2+)=-0, 26 V, ε(V 2+/V)=-1, 18 V pentaoxidja amfoter, vízben gyakorlatilag nem oldódik vizes oldatban oxokationokat, oxoanionokat képez; izo- és heteropilisavképző

A VANÁDIUM ÉS VEGYÜLETEI Oxidjai: V 2 O 5, VO 2 (amfoter), V 2 O 3, VO (bázikus) oxidok és számos különböző összetételű részben sztöchiometrikus oxid fázisok V 2 O 5 narancssárga vegyület, melegítésre reverzibilisen oxigént veszít → VO 2 → felhasználása katalizátor 2 NH 4 VO 3 + H 2 SO 4 → V 2 O 5 + (NH 4)2 SO 4 +H 2 O 2 NH 4 VO 3 → V 2 O 5 + 2 NH 3 + H 2 O (hő) (lúg)VO 43 -←V 2 O 5 → [VO 2(H 2 O)4]+ (sav) (cisz oxocsoportok) V 2 O 5 → [VO(O 2)(H 2 O)4]+ vörös színű (peroxo-vanadát) VO 2 sötétkék vegyület; V 2 O 5 enyhe redukciójával, pl. CO, SO 2 -dal (lúg) VO 44 -, [V 4 O 9]2 -←VO 2 →[VO(H 2 O)5]2+ (sav) (kék) Komplexei: tetragonális piramisos VO(IV) komplexek; hatos koordinációjú, nemoxo VO(IV) komplexek erős O-donor ligandumokkal

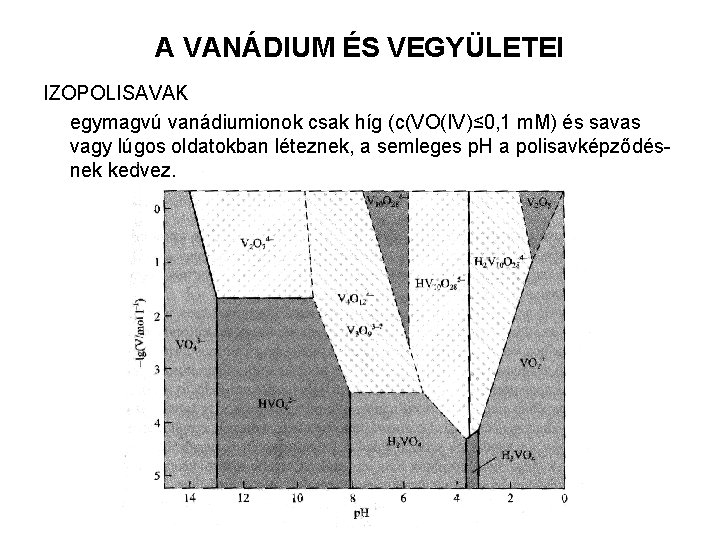
A VANÁDIUM ÉS VEGYÜLETEI IZOPOLISAVAK egymagvú vanádiumionok csak híg (c(VO(IV)≤ 0, 1 m. M) és savas vagy lúgos oldatokban léteznek, a semleges p. H a polisavképződésnek kedvez.

A KRÓM, MOLIBDÉN ÉS VOLFRÁM GYAKORISÁG ÉS ELŐFORDULÁS a Cr előfordulási gyakorisága hasonló a vanádium és a klór gyakoriságához, a Mo és a W gyakorisága 2 nagyságrenddel kisebb. ércei: Fe. Cr 2 O 4 – kromit; Mo. S 2 – molibdenit; Ca(Mo, W)O 4 – powellit; Ca. WO 4 – schelit, (Fe, Mn)WO 4 – wolframit ELŐÁLLÍTÁS ferrokróm ötvözőanyag előállítása (elektromos kemencében) Fe. Cr. O 4 + 4 C → Fe + Cr + 4 CO alacsony C. -tartalmú ferrokróm előállításához a reakciót Fe. Si-mal végzik. tiszta Cr előállítás Fe. Cr. O 4 + 8 Na. OH + 3, 5 O 2 → 4 Na 2 Cr. O 4 + Fe 2 O 3 + 4 H 2 O (1100 °C) Na 2 Cr. O 4 + 2 C → Cr 2 O 3 + Na 2 CO 3 + CO Cr 2 O 3 + 2 Al → 2 Cr + Al 2 O 3 Cr-bevonatok (galvanizálás): Cr 2 O 3 kénsavas oldásával nyert oldatok elektrolízise Mo előállítása Mo. S 2 (pörkölés) →Mo. O 3 (H 2, Al) → Mo + H 2 O W előállítás wolframit +Na. OH (ömlesztés) → wolframát (sav) →WO 3 (H 2) →W porkohászat (magas op. miatt nem olvasztható meg, sajtolással tömörítik)

A KRÓM, MOLIBDÉN ÉS VOLFRÁM FELHASZNÁLÁS Cr: sav-és korrózióálló acélok, korrózióvédő bevonatok; Mo: korrózióálló, nagy szilárdságú, keménységű acélok, izzószálak felfüggesztése (az üveg és a Mo hőtágulása hasonló), katalizátor; W: hőálló ötvözetek, WC rendkivül kemény és kopásálló (szerszámgépek feje, éle, tollakba golyó), izzólámpa gyártás FIZIKAI ÉS KÉMIAI TULAJDONSÁGOK Igen magas op (W: 3410 °C), tiszta állapotban viszonylag puhák, mechanikai tulajdonságaik a szennyezők hatására kedvezően változnak, Szobahőmérsékleten ellenállóak, magas hőmérsékleten reagálnak a nemfémes elemekkel (O, S, N, B, C, X). A F 2 -ral már szobahőmérsékleten A Cr reakcióképesebb a Mo és W-nál, Híg HCl-ban is oldódik, oxidálósavak passziválják (védő oxidréteg) A Cr magas (+6) oxidációs állapotában nem stabilis, oxidál, ez a tulajdonság a csoportban lefelé csökken. A Cr gyakori oxidációs állapota a +3 és +6 (esetleg a +2), a Mo és W estén a +5 és +6 (az alacsony oxidációs állapotai nem léteznek)

A KRÓM, MOLIBDÉN ÉS VOLFRÁM Oxidjaik: MO 3 oxidok: Cr. O 3 (vörös) vízben, Mo. O 3 (fehér) WO 3 (sárga) csak lúgokban oldódik Na 2 Cr 2 O 7 + H 2 SO 4 = Cr. O 3 +Na 2 SO 4 + H 2 O A Cr. O 3 erősen oxidáló, a többi nem; a Cr. O 3 láncpolimer, a többi rétegrács; MO 2 oxidok: nem stabilisak, diszproporcionálódnak; a Cr. O 2 ferromágneses 3 Mo. O 2 → Mo + 2 Mo. O 3 M 2 O 3 oxidok: Cr 2 O 3 zöld festék, amfoter (NH 4)2 Cr 2 O 7 → Cr 2 O 3 + N 2 + 4 H 2 O (vulkán) (lúg) [Cr(OH)4]- ←Cr 2 O 3→ [Cr(H 2 O)6]3+ (sav) Peroxo vegyületek:

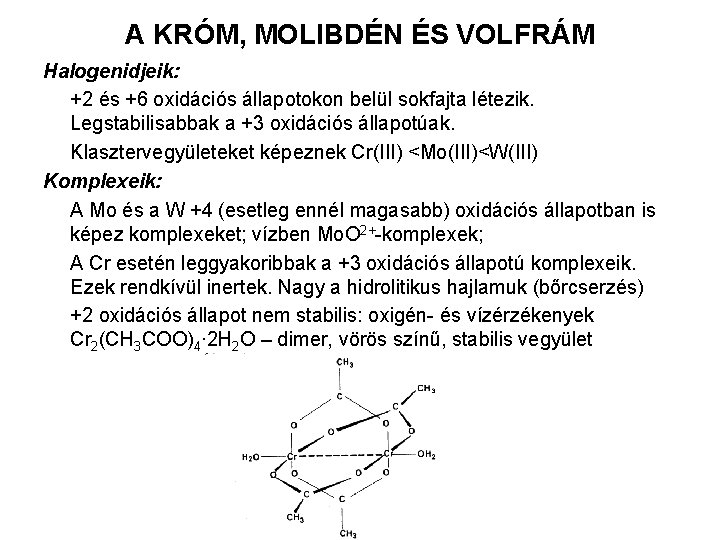
A KRÓM, MOLIBDÉN ÉS VOLFRÁM Halogenidjeik: +2 és +6 oxidációs állapotokon belül sokfajta létezik. Legstabilisabbak a +3 oxidációs állapotúak. Klasztervegyületeket képeznek Cr(III) <Mo(III)<W(III) Komplexeik: A Mo és a W +4 (esetleg ennél magasabb) oxidációs állapotban is képez komplexeket; vízben Mo. O 2+-komplexek; A Cr esetén leggyakoribbak a +3 oxidációs állapotú komplexeik. Ezek rendkívül inertek. Nagy a hidrolitikus hajlamuk (bőrcserzés) +2 oxidációs állapot nem stabilis: oxigén- és vízérzékenyek Cr 2(CH 3 COO)4∙ 2 H 2 O – dimer, vörös színű, stabilis vegyület

A MANGÁN KÉMIÁJA GYAKORISÁG ELŐFORDULÁS A Fe és a Ti után a 3. leggyakoribb átmenetifém. Legfontosabb érce a Mn. O 2 – piroluzit (barnakőpor) ELŐÁLLÍTÁS Ferromangán: ötvözési célokra Mn. O 2 + Fe 2 O 3 (koksz, elektromos kemencében) →Mn + 2 Fe + 5 CO Tiszta Mn előállítás: Mn. SO 4 vizes oldatának elektrolízise FELHASZNÁLÁS Acélötvöző (kéntelenítő, dezoxidáló hatású); egyéb ötvözetei: pl. manganin Cu+Mn+Ni ellenállása nem függ a hőmérséklettől) FIZIKAI ÉS KÉMIAI TULAJDONSÁGOK Kemény, törékeny fém, nehezen megmunkálható; Oxidációs állapot +2 és +7 között. Minél nagyobb annál kisebb az oxidációs állapotuk stabilitása (+2 stabilis, +7 erélyes oxidálószer) Elég reakcióképes (félig telített alhéj), felületét oxidréteg védi, enélkül vízből H 2 -t fejleszt, ásványi savak oldják, melegítve könnyen reagál a nemfémekkel.

A MANGÁN KÉMIÁJA Oxidjai: Mn 2 O 7: rendkívül bomlékony, robbanásszerű hevességgel bomlik, Előállítás: HMn. O 4 →Mn 2 O 7 + H 2 O (cc. H 2 SO 4) valódi savanhidrid, Mn. O 4 - oxoaniont képez; erélyes oxidálószer Ba(Mn. O 4)2 + H 2 SO 4 = Ba. SO 4 + 2 HMn. O 4 Oxidációs képessége függ az oldat p. H-jától (analitikai kémia) KMn. O 4 előállítása: ipari: Mn. O 2 →Mn. O 42 - (KOH olvadék, O 2 vagy KNO 3) →Mn. O 4(elekttrolitikus oxidáció) laboratóriumi: Mn 2+ + Pb. O 2(Na. Bi. O 3) → Mn. O 4 lúgos közegban lassan, savas közegben gyorsabban bomlik (fény katalizálja a bomlást, sötét üvegben tároljuk): 4 Mn. O 4 - + 4 H+ → 4 Mn. O 2 + 2 H 2 O + 3 O 2 Mn. O 4 - (ibolya színű (CT sáv) diszproporcionálódik: 3 Mn. O 4 - + 4 H+ = 2 Mn. O 42 - + Mn. O 2 + 2 H 2 O

A MANGÁN KÉMIÁJA Mn. O 2 Mn. VII és Mn. II szinproporcionálódása: 2 Mn. O 4 - + 3 Mn 2+ + 2 H 2 O = 5 Mn. O 2 + 4 H+ Mn. O 2 gyakorlati jelentősége: szárazelemgyártás, tégla- és, üveggyártás Leclanché elem (C/Mn. O 2 anód, Zn katód, NH 4 Cl elektrolit) Mn. O, Mn 2 O 3, Mn 3 O 4 Halogenidjeik: Mn. X 2 ionrácsosak, vízben jól oldódnak [Mn(H 2 O)6]2+ akvakomplex Komplexeik: Halogenokomplexeik stabilitási sora: Mn. II<Mn. IV A Mn. II komplexek általában stabilisak, a Mn. III komplexeiben instabilizálható pl. Mn. III acetát BIOSZERVETLEN KÉMIÁJA A fotoszintézisben vesz részt: a víz oxidációja O 2 -né egy Mn tartalmú klaszter révén történik.

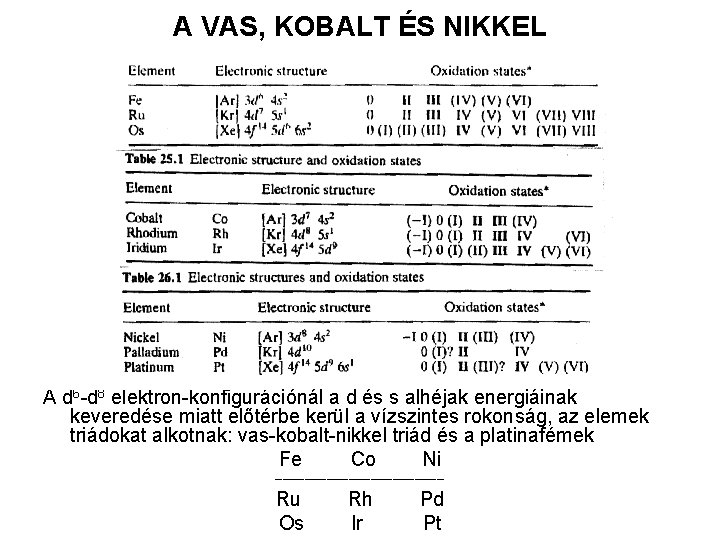
A VAS, KOBALT ÉS NIKKEL A d 6 -d 8 elektron-konfigurációnál a d és s alhéjak energiáinak keveredése miatt előtérbe kerül a vízszintes rokonság, az elemek triádokat alkotnak: vas-kobalt-nikkel triád és a platinafémek Fe Co Ni ____________ Ru Os Rh Ir Pd Pt

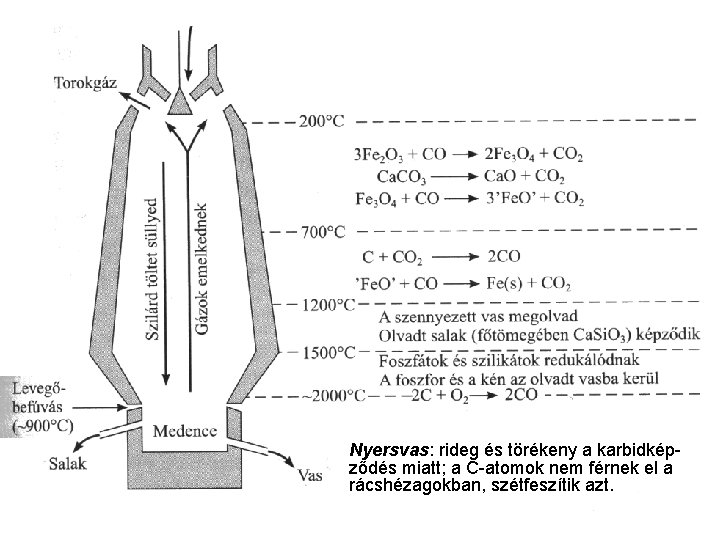
A VAS, KOBALT ÉS NIKKEL GYAKORISÁG ÉS ELŐFORDULÁS a vas a földkéreg 4. leggyakoribb eleme (O, Si, Al, Fe…) 6, 2% a kobalt és a nikkel jóval ritkább oxidos és szulfidos ércei is vannak Fe 2 O 3 -hematit (vörös vasérc), Fe 3 O 4 –magnetit (mágnes vasérc), Fe 2 O 3 ∙n. H 2 O, Fe. O(OH) limonit (barna vasérc), Fe. CO 3 sziderit, Fe. S 2 (pirit); Co. As. S-kobaltit, (Fe, Ni)O(OH)(H 2 O)n-Fe-Ni-limonit ELŐÁLLÍTÁS oxidok redukciója szénnel nyersvasgyártási alapanyagok: vasérc, koksz, levegő, salakképző (Ca. CO 3/Si. O 2) anyagok

Nyersvas: rideg és törékeny a karbidképződés miatt; a C-atomok nem férnek el a rácshézagokban, szétfeszítik azt.

A VAS, KOBALT ÉS NIKKEL ACÉLGYÁRTÁS a C-tartalmat 1, 7 % alá csökkentik és a S, Si és P tartalmat oxidálószerrel kiégetik a nyersvasból; Bessemer- és Thomas-eljárás (levegő átfúvatás, alkalmas konverter bélésanyag), Siemens-Martin eljárás (vasoxid, vagy ócskavas az oxidálószer); BOC (basic oxygen process)-eljárás: levegő helyett oxigén átfúvatás, N 2 oldódás megakadályozása, pontos beállítás; Acél hőkezelése: a vas különböző allotróp módosulatai közötti átalakítás, és így az acél megmunkálhatóságának és mechanikiai tulajdonságainak javítása Co ELŐÁLLÍTÁSA: érc pörkölése: nyers oxid –Fe, Cu, Ni, Pb kíséárőktől való megszabadítás (oldás kicsapás) –Co(OH)3 leválasztás – Co 3 O 4 kihevítés – C, H 2 -vel való redukció Ni ELŐÁLLÍTÁSA: hasonló a Co-hoz → Ni. O – redukció C-nel, tisztítás: elektrolízissel, Ni(CO)4 hőbontása

A VAS, KOBALT ÉS NIKKEL FELHASZNÁLÁS Fe: a legfontosabb szerkezeti anyag (évi 700 millió tonnát állítanak elő) Co: acélötvöző (hőálló ötvözetek), permanans mágnesek (Al. Co. Ni); Ni: ötvözetek: Ni/Cu-konstantán, Ni/Cu/Zn-alpakka, hidrogénező katalizátor (Raney. Ni) FIZIKAI ÉS KÉMIAI TULAJDONSÁGOK magas op. , a tiszta fémek puhák, szennyezések javítják a megmunkálhatóságot (ötvözetek); ferromágnesesek (magas Curie hőmérséklet: Fe-768 °C, Co>1100 °C, Ni-375 °C) Oxidációs állapotok: Fe: +2, +3, (+6); Co: +2, +3; Ni: +2, +3; (a +4 és +5 is ismert de gyakorlati jelentősége nincs, <+2 fémorganikus vegyületekben) Magasabb hőmérsékleten reagálnak a nem-fémekkel (O, X, S, B, C, Si, P), a finom eloszlású Fe és Ni pirofóros (levegőn meggyullad); A Fe, Ni könnyen, a Co nehezebben oldódik ásványi savakban, a forró HNO 3 passziválja a fémeket; a Fe nedves levegőn rozsdásodik, a Co, Ni ellenáll a korróziónak;

A VAS, KOBALT ÉS NIKKEL Oxidjaik: Fe. O Fe 3 O 4 Fe 2 O 3 Fe. O(OH) [Fe. O 4]2 Co. O Co 3 O 4 Co. O(OH) Ni. O (Ni 2 O 3) Ni. O(OH) A +2 és +3 oxidációs állapotú oxidok bázikus karakterűek, savakban M(aq)2+ és M(aq)3+ formában oldódnak, lúgos közegben rosszul oldódó M(OH)2, M(OH)3 és MO(OH) hidroxidokká alakíthatók; A +3 oxidációs állapot stabilitása a Fe>Co>Ni sorrendben csökken; A Fe(OH)2 (halvány zöldes), a Co(OH)2 (rózsaszín) levegőn spontán oxidálódik, a Ni(OH)2 stabilis; 2 Fe. O(OH) + 3 Cl 2 +10 OH- = 2[Fe. O 4]2 - + 6 Cl- + 4 H 2 O (bíborszínű) A [Fe. O 4]2 - igen erélyes oxidálószer; Cr. O 42 ->Mn. O 4 ->Fe. O 42 ->>(Co. O 42 -) spontán bomlik: 2[Fe. O 4]2 - + 5 H 2 O → 2 Fe 3+ + 1, 5 O 2 +10 OHVegyes fémoxidok: MIIFe. IIIO 4 (ferritek) – ferrimágnesesek) Co. O (olivazöld), kobaltüveg: Co. O+Si. O 2+K 2 CO 3 (kék) Ni. O (zöld), Ni. O(OH) Ni-Fe lúgos akkumulátor (elektrolit KOH) (tölt) Fe + 2 Ni. O(OH) + 2 H 2 O ↔Fe(OH)2 + Ni(OH)2 (kisül)

A VAS, KOBALT ÉS NIKKEL Halogenidjeik: Jellemzőek az MX 2 és MX 3; az MX 2 mindhárom fémmel és mindhárom halogénnel képződik; MX 2: M + 2 HX = MX 2∙n. H 2 O + H 2 (hidrátizomerek), a vízmentes sók színesek: Fe(II)-sók sárgászöld, Co(II)-sók kék, Ni(II) sók sárga színűek; [MX 4]2 - tetraéderes halogeno komplexeket képez(het)nek; MX 3: 2 Fe + 3 Cl 2 = (2 Fe. Cl 3) Fe 2 Cl 6 könnyen szublimál, gőzfázisban dimer, vizes oldatból Fe. Cl 3∙ 6 H 2 O kristályosítható, hevítéssel nem vízteleníthető (hidrolizál); savas hidrolíziséből adódóan „maró” hatású (felületkezelés, tisztítás); Fe. I 3 nem létezik: 2 Fe 3+ + 2 I- = 2 Fe 2+ + I 2; Fe. F 3 stabilis→[Fe. F 6]3 - szintelen komplex; MX 4: nem stabilis, komplex halogenidjeik (pl. Cs 2[Co. F 6], K 2[Ni. F 6]) vízben O 2 fejlődés közben bomlanak. Szulfidjaik: Fe + S→Fe. S híg sósavban oldódik→H 2 S; Co. S, Ni. S híg sósavban nem oldható (β-módosulat), de savas közegből le sem választható (α-módosulat), Fe. S 2 (pirit és markazit), Co. S 2, Ni. S 2, Co 3 S 4, Ni 3 S 4

A VAS, KOBALT ÉS NIKKEL Komplexeik: Fe-komplexek: +2 és +3 kationos akvakomplexek (N=6) vizes oldatban ε(Fe 3+/Fe 2+)=+0, 77 V, ε(Co 3+/Co 2+)=+1, 84 V; a Co 3+ és Ni 3+ akva komplex nem létezik; [Fe(H 2 O)6]2+ (zöld) kevéssé, a [Fe(H 2 O)6]3+ (halvány ibolya) erősen hidrolizál: Ks[Fe(H 2 O)6]3+~2 és [(H 2 O)4 Fe(OH)2 Fe(H 2 O)4]4+ sárga színű ionok, (Fe←O töltésátviteli sáv); A szoftabb ligandumok (aromás-N, S) a Fe(II), míg a hardabbak (F, O) a Fe(III) vegyértékállapotot stabilizálják, ε(Fe(edta)-/Fe(edta)2 -)=0, 12 V, ε([Fe(CN)6]3+/Fe(CN)6]4 -=+0, 36 V, ε([Fe(phen)3]3+/[Fe(phen)3]2+=+1, 12 V [Fe(SCN)x]x-3(vörös) +F- → [Fe. Fy]y-3 (színtelen) Analitikai reagensek: K 4[Fe(CN)6] sárgavérlúgsó, K 3[Fe(CN)6] vörösvérlúgsó Fe. III + [Fe. II(CN)6]4 - → berlini kék Fe. II + [Fe. III(CN)6]3 - → Turnbull kék CN- hidas vegyes oxidációs állapotú vas-ciano komplexek
![A VAS KOBALT ÉS NIKKEL Cokomplexek a CoH 2 O62 stabilis a CoH 2 A VAS, KOBALT ÉS NIKKEL Co-komplexek: a [Co(H 2 O)6]2+ stabilis, a [Co(H 2](https://slidetodoc.com/presentation_image/18e07c3e9cc2a34e7efaf9b0123c7894/image-24.jpg)
A VAS, KOBALT ÉS NIKKEL Co-komplexek: a [Co(H 2 O)6]2+ stabilis, a [Co(H 2 O)6]3+ oxidálja a vizet; a Co(III)- komplexek stabilisak és inertek a Co(II) komplexek könnyen oxidálhatók Co(III) komplexekké. [Co. II(NH 3)6]2+ → (levegő) [Co. III(NH 3)6]3+ A Co. II oktaéderes (N=6) de pl. halogenidekkel tetraéderes (N=4): [Co(H 2 O)6]2+ + 4 Cl- ↔ [Co. Cl 4]2 - + 6 H 2 O rózsaszínű kék Co. III peroxo komplexek: [Co. II(CN)5]3 - + O 2 ↔ [(CN)5 COIII-O-O-Co. III(CN)5]6 A Co. III komplexek rendkívül inertek Ni-komplexek: oktaéderesek (N=6) és síknégyzetesek lehetnek (N=4) [Ni(NH 3)6]2+← NH 3 + [Ni(H 2 O)6]2+ +CN- →[Ni(CN)4]2 mélykék sárga Ni. III makrociklusokkal, peptidekkel stabilizálható Alacsony oxidációs állapotok: karbonilokban, cianidokban, fémorganikus vegyületekben stabilizálható;

A VAS BIOSZERVETLEN KÉMIÁJA A vas mind a növény- mind az állatvilág számára nélkülözhetetlen elem. Biológiai jelentősége alapvetően redoxi sajátságához rendelgető, azaz, +2 és +3 oxidációs állapotban is létezik, és így: 1. 2. 3. 4. 5. Mint oxigénhordozó viselkedhet sok élőlény vérében (hemoglobin), illetve tárolja azt az izmokban (mioglobin); Elektrontranszfer fehérjék alkotója melyek az elektron szállítását végzik élőlényekben, a baktériumoktól az emberig; Az oxigén részvételével lejátszódó oxidáz, oxigenáz, peroxidáz folyamatokat katalizál; A nitrogenáz enzim alkotója (N 2 fixálás); A vas szállítása és tárolása révén biztosítva van a szervezet vas háztartása;

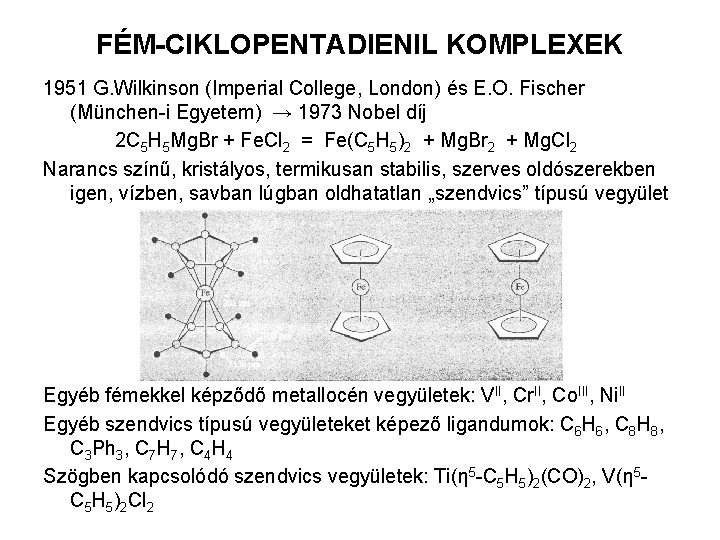
FÉM-CIKLOPENTADIENIL KOMPLEXEK 1951 G. Wilkinson (Imperial College, London) és E. O. Fischer (München-i Egyetem) → 1973 Nobel díj 2 C 5 H 5 Mg. Br + Fe. Cl 2 = Fe(C 5 H 5)2 + Mg. Br 2 + Mg. Cl 2 Narancs színű, kristályos, termikusan stabilis, szerves oldószerekben igen, vízben, savban lúgban oldhatatlan „szendvics” típusú vegyület Egyéb fémekkel képződő metallocén vegyületek: VII, Cr. II, Co. III, Ni. II Egyéb szendvics típusú vegyületeket képező ligandumok: C 6 H 6, C 8 H 8, C 3 Ph 3, C 7 H 7, C 4 H 4 Szögben kapcsolódó szendvics vegyületek: Ti(η 5 -C 5 H 5)2(CO)2, V(η 5 C 5 H 5)2 Cl 2

PLATINAFÉMEK Ru – d 7 s 1 Rh – d 8 s 1 Pd – d 10 s 0 Os – d 6 s 2 Ir – d 7 s 2 Pt – d 9 s 1 Az atompályák szabálytalan feltöltődése is mutatja, hogy a 4 d – 5 s, illetve az 5 d – 6 s pályák energiája igen közeli → vegyületeikben számos nagy pozitív oxidációs állapot is megvalósul (ellentét a Fe-Co-Ni triáddal) GYAKORISÁG, ELŐFORDULÁS Igen ritka elemek ≤ 10 -7%-ban fordulnak elő; Mégis a Pt több ezer év óta ismert, a többi csak 100 -150 éve; Elemi állapotban, vagy a Ni, Cu, Ag szulfidos, arzenides ércei kísérőjeként fordulnak elő. ELŐÁLLÍTÁS Nyers réz/nikkel (anód) kénsavas közegben elektrolízissel végzett tisztítása során az anódiszapba kerülnek a nemesebb fémek; Az anódiszap nyers fémkeverék elválasztása komplexeik eltérő sajátságai alapján ioncserés és folyadék-extrakciós módszerekkel lehetséges; Vizes kloridokból Zn-poros cementálással, kloro-komplexek hőbontásával, vagy H 2 -nel való redukcióval;

PLATINAFÉMEK FELHASZNÁLÁS Katalizátorok (Al 2 O 3 hordozón vagy lemezek formájában) pl. gépkocsikban; Ötvözőanyagok: Ru, Os, Pt keményítése, Pt/Ir: gyújtógyertyák; Laboratóriumi tégelyek (Pt, Ir), műfogsorok rögzítése (Pd), elektródák (Pt) FIZIKAI ÉS KÉMIAI TULAJDONSÁGOK Nagy sűrűségű, platinára emlékeztető nagy op. fémek; Oxidációs állapotok Ru: 0 – 2 3 4 5 6 7 8; Os: 0 - 2 3 4 5 6 7 8 Rh: 0 1 2 3 4 5 6 Ir: 0 1 2 3 4 5 6 Pd: 0 - 2 - 4 5 6 Pt: 0 - 2 - 4 5 6 +5 -nél nagyobb oxidációs számok csak a fluoro-komplexekben fordulnak elő, kivétel a Ru és az Os Reakcióképességük kicsiny, csak magasabb hőmérsékleten reagálnak a nemfémekkel, pl a halogénekkel vagy az oxigénnel; csak nagyon reaktív oxidáló savelegyek vagy lúg (Ru, Os) oldja. Az Os finom eloszlásban szobahőmérsékleten is reagál az oxigénnel: Os. O 4

PLATINAFÉMEK Oxidjaik: nagy oxidációs állapotban molekularácsos, illékony, savképző oxidok 4 Ru. VIIIO 4 + 4 OH- → 4 Ru. VIIO 4 - + 2 H 2 O + O 2 (perrutenát) 4 Ru. VIIO 4 - + 4 OH- → 4 Ru. VIO 42 - + 2 H 2 O + O 2 (rutenát) erélyes oxidálószerek közbenső oxidációs állapotaik amfoterek: H 2[Pt. Cl 6] ← HCl + Pt. O 2 + Na. OH → [Pt(OH)6]2 Kis oxidációs állapotban bázisképzőek: pl. Rh 2 O 3 Pd. O: bomlékony, 900 °C-on elemeire bomlik. Halogenidjeik: +8 oxidációs állapot még F-dal sem stabilizálható +7 csak az Os. F 7 -ban ismert (instabilis), kis t, F 2 atmoszféra +6, +5: a Pd kivételével minden fémmel képződnek +4: MX 4 (minden fémmel és halogeniddel +3, +2: MX 3, MX 2 valamennyi elemnél képződhetnek
![PLATINAFÉMEK Komplexeik az első N 2 komplex RuNH 35 N 22 RuNH 35N 2NH PLATINAFÉMEK Komplexeik: az első N 2 komplex: [Ru(NH 3)5 N 2]2+, [Ru(NH 3)5(N 2)(NH](https://slidetodoc.com/presentation_image/18e07c3e9cc2a34e7efaf9b0123c7894/image-30.jpg)
PLATINAFÉMEK Komplexeik: az első N 2 komplex: [Ru(NH 3)5 N 2]2+, [Ru(NH 3)5(N 2)(NH 3)5 Ru]4+ Vaska-komplex: transz-[Ir. ICl(CO)(PPh 3)2] O 2 -hordozó komplex Wilkinson katalizátor: Rh. ICl(PPh 3)3 szelektív homogén hidrogénezés ciszplatin: cisz-[Pt. II(NH 3)2 Cl 2] rákellenes szer

A RÉZ, EZÜST ÉS ARANY GYAKORISÁG ÉS ELŐFORDULÁS Viszonylag ritkák, de az emberiség által régen felhasznált fémek (jól dúsulnak, könnyen kinyerhetők); Elemi állapotban is előfordulnak (Au), kvarc vagy pirit ásványokban, de a Cu és Ag esetén az ércek fontosabbak; A tengervíz Au tartalma 4 μg/l (100. 000 t Au/Földközi tenger); Cu. Fe. S 2 – kalkopirit, Cu. CO 3∙Cu(OH)2 – malachit, Ag 2 S – argentit ELŐÁLLÍTÁS Cu: szulfidos ércek pörkölése + Si. O 2 (Fe 2(Si. O 3)3 -ba viszi a vasat) 2 Cu. Fe. S 2 →Cu 2 S + Fe 2 O 3 + 3 SO 2 (pörkölés, O 2 1400 -1500 °C) 2 Cu 2 S + 3 O 2 → 2 Cu 2 O + 2 SO 2 (részleges oxidálás) 2 Cu 2 O + Cu 2 S → 6 Cu + SO 2 Ag: Pb-, Zn-, Cu-gyártás melléktermékeként vagy ciánlúgozással 4 Ag + 8 Na. OH + O 2 + 2 H 2 O → 4 Na[Ag(CN)2] + 4 Na. OH majd Zn-kel cementálás Au: fizikai tulajdonságai alapján különítik el a meddőtől (aranymosás, amalgámozás) illetve ciánlúgozással
![A RÉZ EZÜST ÉS ARANY FELHASZNÁLÁS nemesfémek ékszer 24 karát 100 AuAgCu elektrotechnika rézhuzal A RÉZ, EZÜST ÉS ARANY FELHASZNÁLÁS nemesfémek: ékszer [24 karát (100%), Au+Ag(Cu)] elektrotechnika: réz-huzal,](https://slidetodoc.com/presentation_image/18e07c3e9cc2a34e7efaf9b0123c7894/image-32.jpg)
A RÉZ, EZÜST ÉS ARANY FELHASZNÁLÁS nemesfémek: ékszer [24 karát (100%), Au+Ag(Cu)] elektrotechnika: réz-huzal, ezüst-biztosíték, arany-kontaktus ötvözetek: sárgaréz (Cu+Zn), bronz (Cu+Sn), érmék (Cu+Ni+Ag, esetleg, Zn/Mn), konstantán (Cu+Ni+Mn), alpakka(Cu+Ni+Zn) FIZIKAI ÉS KÉMIAI TULAJDONSÁGOK nagy sűrűségű, puha, jól megmunkálható fémek, vékony huzalok, lemezek, fóliák nyerhetők (1 cm 3 Au→ 18 m 2 230 atom vastagság) legjobb hő és elektromos vezetőképességűek; jellemző színűek, kolloidjaik részecskemérettől függő színűek; oxidációs állapotjaik: Cu: 1 2 3; Ag: 1 2; Au 1 3; kis reakcióképességűek, levegővel, vízzel szemben ellenállóak, de Cu + (H 2 O, CO 2, O 2) → Cu 2(OH)2 CO 3 (zöld), patina Ag + (H 2 S, O 2) → Ag 2 S (fekete) Csak oxidáló savakban oldódnak: Cu, Ag: cc. H 2 SO 4, HNO 3 (válsztóvíz), Au csak királyvízben (1 HNO 3+3 HCl)

A RÉZ, EZÜST ÉS ARANY Oxidjaik: Lezárt d héj, szoft karakter: oxigénhez való affinitásuk kicsi Cu: Cu 2 O (vörös), Cu. O (fekete) Cu 2 O: magasabb hőmérsékleten stabilis forma, lúgos közegben Cu. II vegyületek redukciójával nyerhető; Cu. O: réz(II) vegyületek hevítésével nyerhető; bázikus oxid: [Cu(OH)4]- +sok OH- ←Cu. O→[Cu(H 2 O)6]2+ Ag: Ag 2 O (sötétbarna), Ag. O = Ag. IIIO 2 (fekete), Ag 2 O 3 Ag+ + OH- →Ag(OH)→Ag 2 O (az Ag(OH) szilárd halmazállapotban nem létezik; Ag 2 O 160 °C-on bomlik; Ag 2 O + K 2 S 2 O 8 →Ag. IIIO 2 Au: Au 2 O 3 (barna) [Au. Cl 4]- +OH- →Au 2 O 3∙n. H 2 O →Au 2 O 3→Au (hevítés) Szulfidjaik: fekete, vízben rosszul oldódó, stabilis vegyületek: pl Cu. S, Ag 2 S, Au 2 S

A RÉZ, EZÜST ÉS ARANY Halogenidjeik: Cu. Cl 2 (sárgásbarna), Cu. Cl 2 2 H 2 O (kék) (zöld)[Cu. Cl 4]2 - (cc. HCl) ← Cu. Cl 2 2 H 2 O → (víz)[Cu(H 2 O)6]2+ (kék) Cu-, Ag- és Au-halogenidek: kovalens rétegrácsos vízben rosszul oldódó vegyületek; L(Ag. F>>Ag. Cl>Ag. Br>Ag. I) növekvő kovalencia Fényképezés: expozíció: Ag. Br (hn) → Ag + ‘Br’ (gócképződés) előhívás: enyhe kémiai redukció (hidrkinon, S-vegyületek), ott ahol már van góc további redukció: Ag. Br → Ag + ‘Br’ fixálás: a fölös Ag. Br kioldása tioszulfáttal: Ag. Br + 2 S 2 O 32 - → [Ag(S 2 O 3)2]3 - + Brpozitív kép: a negatív film megvilágítása fényérzékeny fotopapírra „exponálás”.

A RÉZ, EZÜST ÉS ARANY Komplexeik: Réz(II) komplexek 4(6) tetragonális bipiramisos koordináció, nagy termodinamikai stabilitás (K 5, K 6 kicsi); labilis komplexek; általában kék színűek; Réz(I) komplexek 4 tetraéderes koordináció diszproporcionálódás: 2 Cu(I) → Cu + Cu(II) E=+0, 37 V; K= 106 szoft ligandumok a Cu(I)-et, kelátképző liganumok a Cu(II)-t stabilizálják 2 Cu. Cl + 2 en = [Cu(en)2]2+ + Cu + 2 Cl[Cu(NH 3)4]2+ + Cu = 2[Cu(NH 3)2]+ Réz(III) komplexek Cu. Cl + 3 KCl + F 2 → K 3[Cu. F 6] nagyon könnyen redukálódik; egyes szerves ligandumok, pl. peptidek stabilizálják a Cu(III)-at;

A RÉZ, EZÜST ÉS ARANY Ezüst(I) komplexek Komplexei 2 koordinációjú, lineáris vegyületek; nincs keláteffektus Arany(I, III) komplexek Au(III) akvaion nem stabilis, erősen oxidáló, Az Au [Au. Cl 4]- síknégyzetes, diamágneses komplex formában oldható királyvízben Au(SR)n: folyékony arany (aranyozáshoz használják) Au(I) diszproporcionálódás: 3 Au(I) = Au(III) + 2 Au K = 1010 vizes közegben az Au(I) csak erősen szoft ligandumokkal (CN, S, P, As donor) stabilizálható;

A RÉZ BIOSZERVETLEN KÉMIÁJA Az emberi szervezetben a 3. legnagyobb mennyiségben előforduló fém: Fe (4 g), Zn (2 g) Cu (100 mg) Ugyanazokat a funkciókat képes ellátni a szervezetben, mint a vas: Elektrontranszfer folyamatok közvetítése, oxidáz és oxigenáz folyamatok katalízise, alacsonyabb rendű állati szervezetekben az O 2 szállítása; Hiánya többek között vérszegénységet idézhet elő (fém anyagcsere folyamatok közötti szoros kapcsolatok); fölöslege súlyos agyi károsodásokat, elbutulást okozhat. A Cu fölösleg eltávolítása kelátterápiával (szelektív komplexképző ligandummal) történhet.

A CINK KÉMIÁJA GYAKORISÁG ÉS ELŐFORDULÁS Zn. S - galenit, (Zn, Fe)S, karbonátok, szilikátok ELŐÁLLÍTÁS Zn. S + O 2 → Zn. O → (C, 1100 o. C) Zn (kidesztillálható) FELHASZNÁLÁS Korrózióvédő bevonat (olvadékba mártás, elektrolízis, ráfúvatás, Znpor ráégetés, Zn-tartalmú festék); ötvözetek (sárgaréz), szárazelem FIZIKAI ÉS KÉMIAI TULAJDONSÁGOK Viszonylag puha, alacsony op, fp, ← csak a külső s 2 elektronok vesznek részt a fémrács kialakításában; gyenge vezetőképesség; Mérsékelt reakcióképesség, amfoter sajátság;
![A CINK VEGYÜLETEI Oxidja amfoter ZnOH42 OH Zn O H A CINK VEGYÜLETEI Oxidja: amfoter: [Zn(OH)4]2 - ← OH- + Zn. O + H+](https://slidetodoc.com/presentation_image/18e07c3e9cc2a34e7efaf9b0123c7894/image-39.jpg)
A CINK VEGYÜLETEI Oxidja: amfoter: [Zn(OH)4]2 - ← OH- + Zn. O + H+ → [Zn(H 2 O)6]2+ Zn. O fehér vegyület, melegítésre megsárgul → Zn 1+x. O oxigént veszít; fehér festék, vulkanizálási és üveggyártási adalék; Halogenidje: kristályvízmentesen rétegrácsos kovalens vegyület; oldáskor teljesen disszociál → [Zn(H 2 O)6]2+ Szulfidja: Zn. S, fehér festék; Komplexei: oktaéderes, vagy tetraéderes, szintelen diamágneses (d 10) komplexeket képez;

A CINK BIOSZERVETLEN KÉMIÁJA Az emberi, állati és növényi szervezetek számára is létfontosságú elem. A hidrolitikus folyamatokat katalizáló metalloenzimek fő alkotója. Például: Szénsav anhidráz: CO 2 + OH- = HCO 3 A vérsejtekben fordul elő, a légzésben játszik szerepet, a CO 2 egyensúly és a sav-bázis egyensúly fenntartásában; Karboxipeptidáz: a fehérjék C-terminális végtől való hidrolitikus lebontását végző enzim; Alkalikus foszfatáz: az energia felszabadulási folyamatban szerepel; Dehidrogenázok és aldolázok: a cukrok metabolizmusában van szerepük. Alkohol dehidrogenáz: az alkoholok metabolizmusában játszik szerepet, de nem mint redox partner, hanem mint az aktív centrum kialakítója
















