Zwizki krzemoorganiczne struktura i nazewnictwo zwizkw krzemoorganicznych metody










- Slides: 14

Związki krzemoorganiczne Ø struktura i nazewnictwo związków krzemoorganicznych, Ø metody otrzymywania związków krzemoorganicznych, Ø właściwości związków krzemoorganicznych

Struktura i nazewnictwo związków krzemoorganicznych v Związki krzemoorganiczne – związki organiczne, których cząsteczki zawierają wiązania chemiczne miedzy atomami węgla i krzemu. v Atom krzemu w większości związkach tworzy cztery wiązania powstające przez nakładanie się 4 -ch zhybrydyzowanych orbitali sp 3 z tym, że nie tworzy wiązań wielokrotnych z atomem węgla, ani z drugim atomem krzemu. v Ważniejsze typy związków krzemoorganicznych: Ø silany: Rn. Si. H 4 -n, Arn. Si. H 4 -n ü metasilan - CH 3 Si. H 3, ü tetrafenylosilan - (C 6 H 5)4 Si

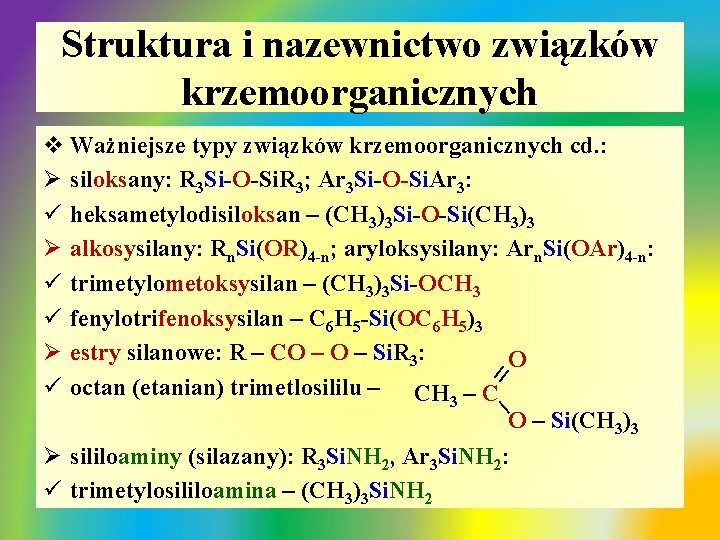
Struktura i nazewnictwo związków krzemoorganicznych v Ważniejsze typy związków krzemoorganicznych cd. : Ø fluorowcosilany: Rn. Si. X 4 -n, Arn. Si. X 4 -n ( X: F, Cl, Br) ü trimetlochlorosilan – (CH 3)3 Si. Cl, ü difenylodichlorosilan – (C 6 H 5)2 Si. Cl 2 Ø silanole: R 3 Si. OH, Ar 3 Si. OH: ü trimetylosilanol – (CH 3)3 Si. OH Ø silanodiole: R 2 Si(OH)2, Ar 2 Si(OH)2: ü dimetylosilanodiol – (CH 3)2 Si(OH)2 Ø silanotriole: RSi(OH)3, Ar. Si(OH)3: ü metylosilanotriol – CH 3 Si(OH)3

Struktura i nazewnictwo związków krzemoorganicznych v Ważniejsze typy związków krzemoorganicznych cd. : Ø siloksany: R 3 Si-O-Si. R 3; Ar 3 Si-O-Si. Ar 3: ü heksametylodisiloksan – (CH 3)3 Si-O-Si(CH 3)3 Ø alkosysilany: Rn. Si(OR)4 -n; aryloksysilany: Arn. Si(OAr)4 -n: ü trimetylometoksysilan – (CH 3)3 Si-OCH 3 ü fenylotrifenoksysilan – C 6 H 5 -Si(OC 6 H 5)3 Ø estry silanowe: R – CO – Si. R 3: II O ü octan (etanian) trimetlosililu – CH 3 – C I O – Si(CH 3)3 Ø sililoaminy (silazany): R 3 Si. NH 2, Ar 3 Si. NH 2: ü trimetylosililoamina – (CH 3)3 Si. NH 2

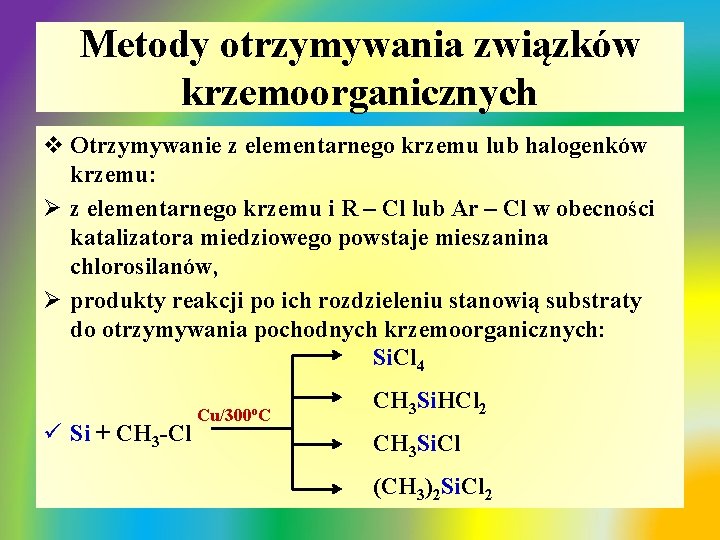
Metody otrzymywania związków krzemoorganicznych v Otrzymywanie z elementarnego krzemu lub halogenków krzemu: Ø z elementarnego krzemu i R – Cl lub Ar – Cl w obecności katalizatora miedziowego powstaje mieszanina chlorosilanów, Ø produkty reakcji po ich rozdzieleniu stanowią substraty do otrzymywania pochodnych krzemoorganicznych: Si. Cl 4 ü Si + CH 3 -Cl Cu/300 o. C CH 3 Si. HCl 2 CH 3 Si. Cl (CH 3)2 Si. Cl 2

Metody otrzymywania związków krzemoorganicznych v Reakcja tetrachlorku krzemu lub chlorosilanu ze związkami metaloorganicznymi (szczególnie magnezoorganicznymi / odczynniki Grignarda): Ø substytucja nukleofilowa – czynnikiem nukleofilowym jest grupa alkilowa lub arylowa związku metaloorganicznego, która atakuje atom krzemu: δ- δ+ ü R 3 Si – Cl + CH 3 – Mg. Cl R 3 Si. CH 3 + Mg. Cl 2 ü Si. Cl 4 + 4 C 6 H 5 Li (C 6 H 5)4 Si + 4 Li. Cl ü (CH 3)3 Si. Cl + C 6 H 5 -CH 2 Mg. Cl (CH 3)3 Si-CH 2 -C 6 H 5 + + Mg. Cl 2

Metody otrzymywania związków krzemoorganicznych v Reakcja alkoksylanów ze związkami metaloorganicznymi (reakcja przebiega podobnie jak w przypadku chlorosilanów): Ø Si(O-CH 2 -CH 3)4 + 4 CH 3 -CH 2 Li (CH 3 -CH 2)4 Si + 4 CH 3 -CH 2 -OLi v Hydroliza chlorosilanów produktami są odpowiednie silanole: Ø (CH 3)3 Si. Cl + H 2 O (CH 3)3 Si. OH + HCl v Hydroliza alkoksylanów, produktami są odpowiednie silanodiole: Ø (CH 3)2 Si(OCH 3)2 + H 2 O (CH 3)2 Si(OH)2 + 2 CH 3 -OH

Właściwości związków krzemoorganicznych v. Właściwości fizyczne związków krzemoorganicznych Ø właściwości są podobne do właściwości ich analogów węglowych, szczególnie w zakresie temperatur topnienia i wrzenia Ø Związki krzemoorganiczne Ø Analogi węglowe ü (CH 3)3 Si-C 6 H 5 / Tw = 172 o. C ü (CH 3)3 C-C 6 H 5 / Tw = 169 o. C ü (C 6 H 5)4 Si / Tw = 237 o. C ü (C 6 H 5)4 C / Tw = 285 o. C Ø szereg związków krzemoorganicznych wykazuje czynność optyczną, w których centrum chiralności stanowi atom krzemu (występowanie diastereoizomerów wskazuje na hybrydyzację sp 3 atomu krzemu).

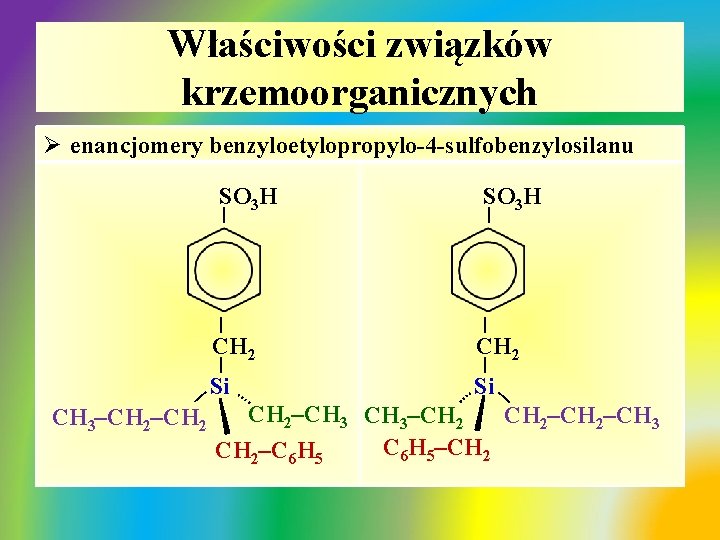
Właściwości związków krzemoorganicznych Ø enancjomery benzyloetylopropylo-4 -sulfobenzylosilanu SO 3 H | | CH 2 | | . … CH 3–CH 2 . … Si | | Si CH 2–CH 3–CH 2–CH 3 C 6 H 5–CH 2–C 6 H 5

Właściwości związków krzemoorganicznych v Związki krzemoorganiczne wykazują większą reaktywność chemiczną niż analogi węglowe: Ø wiązania Si – H, Si – Cl ulegają łatwiej rozerwaniu niż wiązania C – H, C – Cl pod wpływem czynników nukleofilowych lub elektrofilowych: Ø zerwanie wiązania Si – H ü (CH 3)3 Si-H + Br – Br (CH 3)3 Si-Br + HBr Ø rozerwanie wiązania Si – C pod wpływem fluorowca δ- …. . δ+ Al. I 4 w obecności halogenku metalu: I 2 + Al. I 3 ↔ I δ+ δCH 3– Si(CH 3)3 ü δ- …. . δ+ (CH 3)3 Si. I + CH 3 I + Al. I 3 I IAl. I 3

Właściwości związków krzemoorganicznych Ø zerwanie wiązania Si – Cl, wiązanie ulega rozerwaniu pod wpływem wody (hydroliza), która zachodzi już pod wpływem wilgotnego powietrza w przypadku fluorowcosilanów o małej masie cząsteczkowej, produktami hydrolizy są odpowiednie silanole, silanodiole: ü (CH 3)3 Si – Cl + H 2 O (CH 3)3 Si – OH + HCl ü (CH 3)2 Si Cl 2 + 2 H 2 O (CH 3)2 Si (OH)2 + 2 HCl v Kondensacja silanoli w obecności kwasów lub zasad, produktem kondensacji są siloksany: H+ Ø 2 (CH 3)3 Si – OH (CH 3)3 Si – O – Si(CH 3)3 + H 2 O

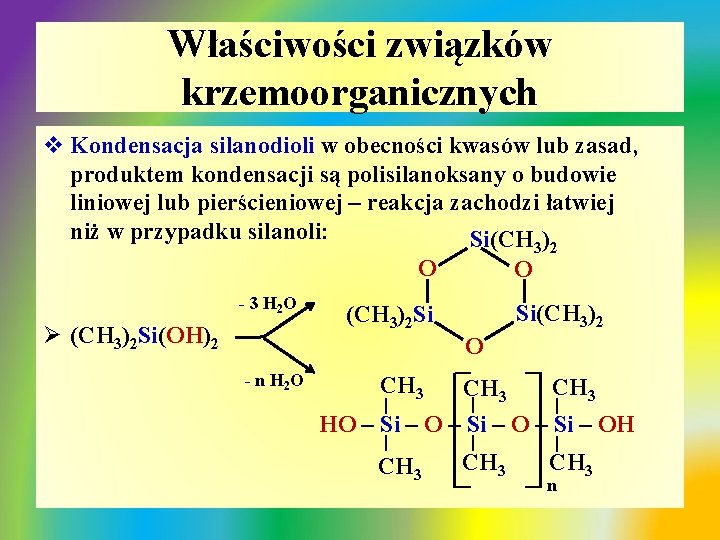
Właściwości związków krzemoorganicznych v Kondensacja silanodioli w obecności kwasów lub zasad, produktem kondensacji są polisilanoksany o budowie liniowej lub pierścieniowej – reakcja zachodzi łatwiej niż w przypadku silanoli: Si(CH 3)2 O O - 3 H 2 O Ø (CH 3)2 Si(OH)2 Si(CH 3)2 Si CH 3 | | | HO – Si – OH | | CH 3 | - n H 2 O | O n

Właściwości związków krzemoorganicznych v Polimery silikonowe – silikony są produktami kondensacji silanoli o większej masie cząsteczkowej: Ø do produkcji liniowych silikonów stosuje się dimetylodichlorosian, ü poddany hydrolizie przechodzi w dimetylosilanodiol, ü produktem polikondensacji są liniowe polikondensaty liniowe, ü polimery liniowe są cieczami o lepkości zależnej od długości cząsteczki, wykazują znaczną odporność na podwyższone temperatury, nie zestalają się w temperaturach obniżonych, ü stosowane są jako smary i ciecze hydrauliczne

Właściwości związków krzemoorganicznych Ø polimery silikonowe usieciowane otrzymuje się z metylosilanotriolu, w trakcie kondensacji łańcuchy liniowe łączone są wiązaniami poprzecznymi Si – O, Ø polimery silikonowe usieciowane (kauczuki metylosilikonowe) można otrzymać z polimerów liniowych (metylowe polisiloksany) przez ich ogrzewanie z nadtlenkami, powstają poprzeczne wiązania typu: ü - Si – C – Si – ü kauczuki metylosilikonowe są bardziej odporne termicznie i zachowują większą elastyczność w niskich temperaturach niż kauczuki naturalne.