Zoutreacties Ionbinding l Ionbinding in ionrooster l l

Zoutreacties
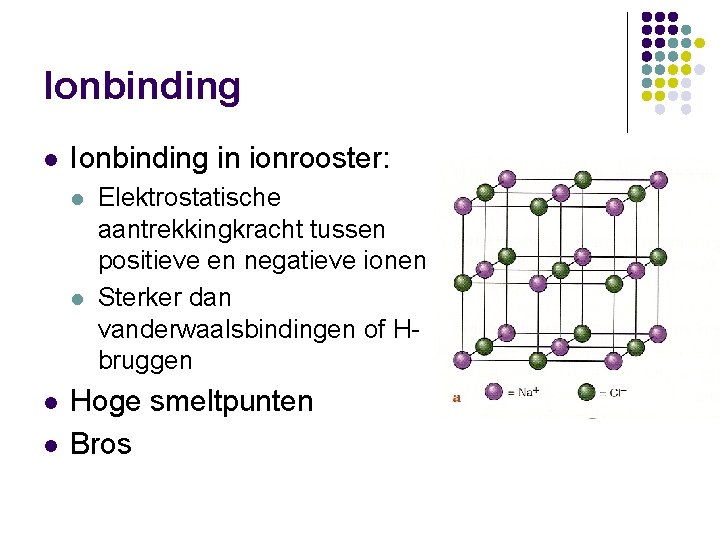
Ionbinding l Ionbinding in ionrooster: l l Elektrostatische aantrekkingkracht tussen positieve en negatieve ionen Sterker dan vanderwaalsbindingen of Hbruggen Hoge smeltpunten Bros
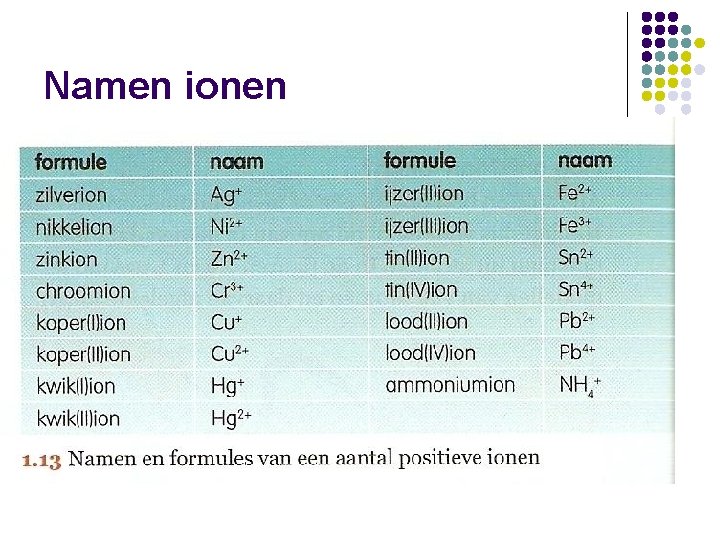
Namen ionen
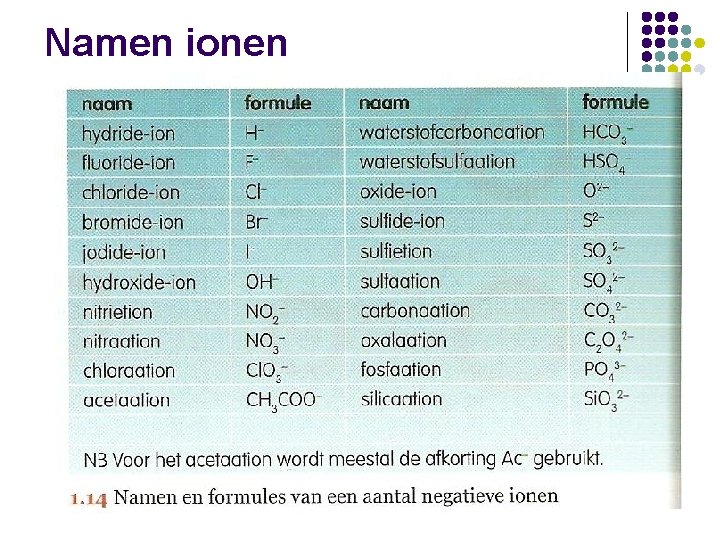
Namen ionen


Zouten in water l Oplossen van zouten in water l Watermolecuul omringen de ionen met een watermantel: HYDRATATIE (aq) l http: //www. youtube. com/watch? v=HCRm 5 HX 1 hc&NR=1
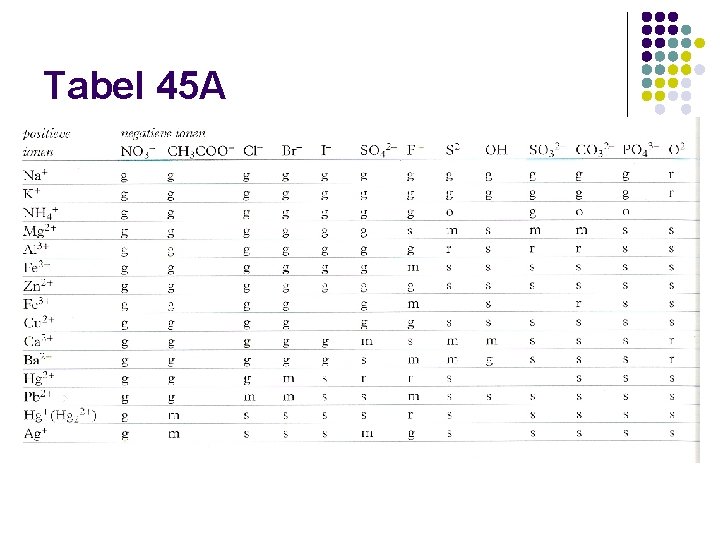
Tabel 45 A

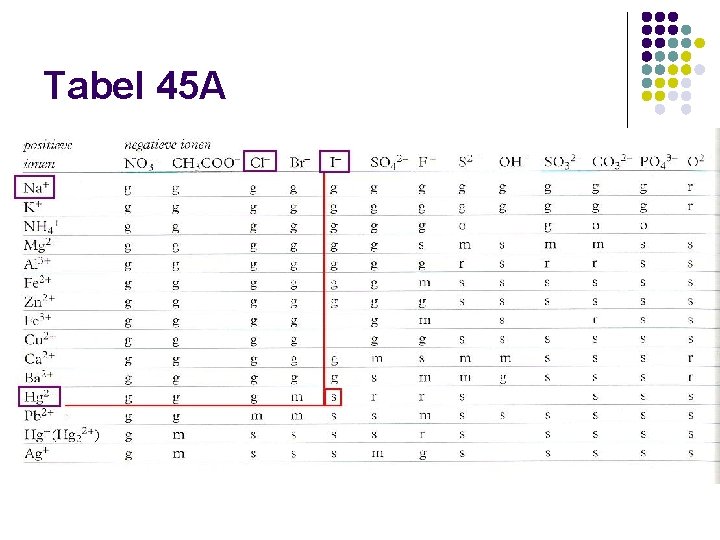
g, s, r of m l g: het zout lost goed op in water l s: het zout lost slecht op in water l m: het zout lost matig op in water l r: het zout reageert met water

Goed oplosbaar: ijzer(III)sulfaat: combinatie van Fe 3+ en SO 42 -: goed oplosbaar in water

Oplosvergelijking l ijzer(III)sulfaat heeft als verhoudingsformule Fe 2(SO 4)3 l Let op: géén + H 2 O in de reactievergelijking Fe 2(SO 4)3 (s) 2 Fe 3+(aq) + 3 SO 42 -(aq) l (aq) : gehydrateerd
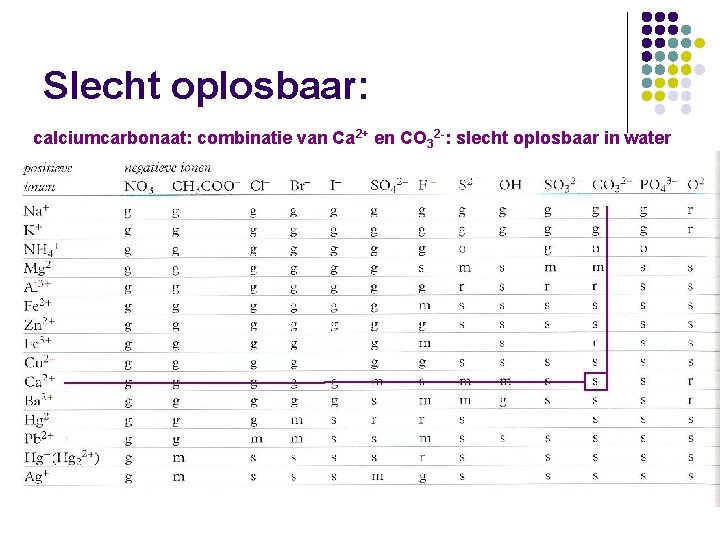
Slecht oplosbaar: calciumcarbonaat: combinatie van Ca 2+ en CO 32 -: slecht oplosbaar in water
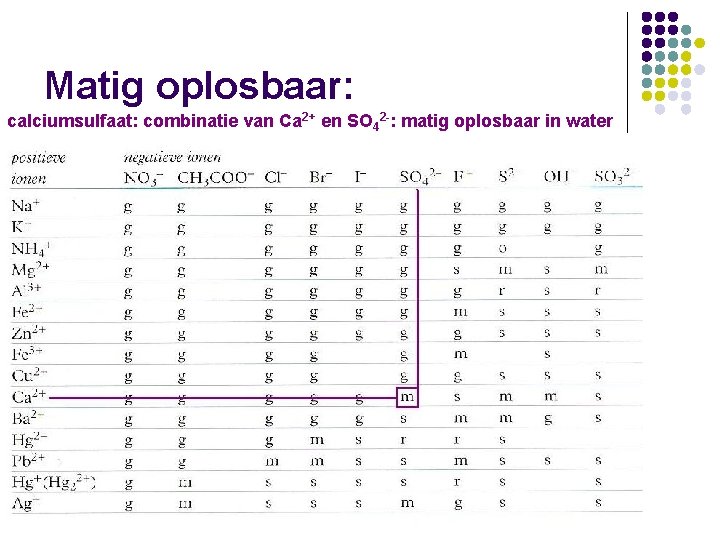
Matig oplosbaar: calciumsulfaat: combinatie van Ca 2+ en SO 42 -: matig oplosbaar in water

Oplosvergelijking l calciumsulfaat heeft als verhoudingsformule Ca. SO 4 l Let op: géén + H 2 O in de reactievergelijking Ca. SO 4 (s) Ca 2+(aq) + SO 42 -(aq) l (aq) : gehydrateerd
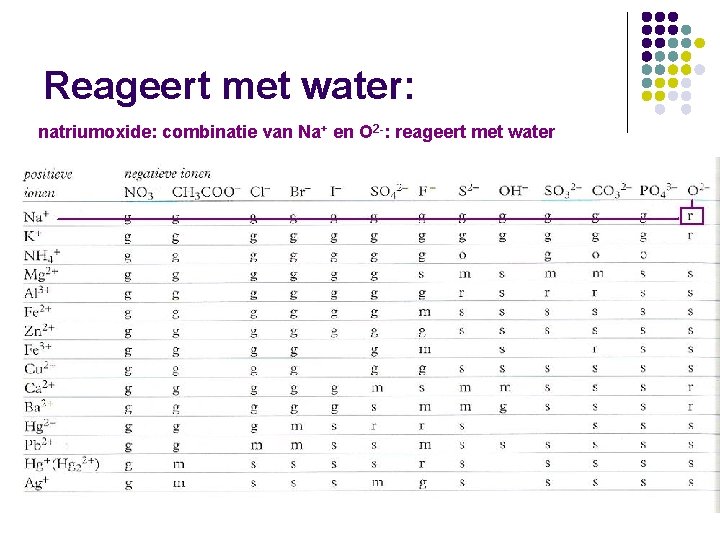
Reageert met water: natriumoxide: combinatie van Na+ en O 2 -: reageert met water

Reactievergelijking l natriumoxide heeft als verhoudingsformule Na 2 O l Let op: hier wel H 2 O in de reactievergelijking Na 2 O (s) + H 2 O (l) 2 Na+(aq) + 2 OH-(aq) l (aq) : de ionen die ontstaan zijn gehydrateerd en opgelost in water l Alleen de reacties van Ba. O, Ca. O, K 2 O en Na 2 O moet je kennen

Indampvergelijkingen l Wanneer een oplossing van een zout wordt ingedampt ontstaat weer vast zout. 2 Na+ (aq) + SO 42 - (aq) Na 2 SO 4 (s) 3 K+ (aq) + PO 43 - (aq) K 3 PO 4 (s)

Neerslagreacties http: //www. youtube. com/watch? v=8 Rm. Vwz 2 f. NGc&feature=related l 1. Oplossingen van Na. Cl en Ag. NO 3 worden bij elkaar gevoegd. Er ontstaat een wit neerslag 2. Oplossingen van Na. I en Ag. NO 3 worden bij elkaar gevoegd. Er ontstaat een gelig neerslag
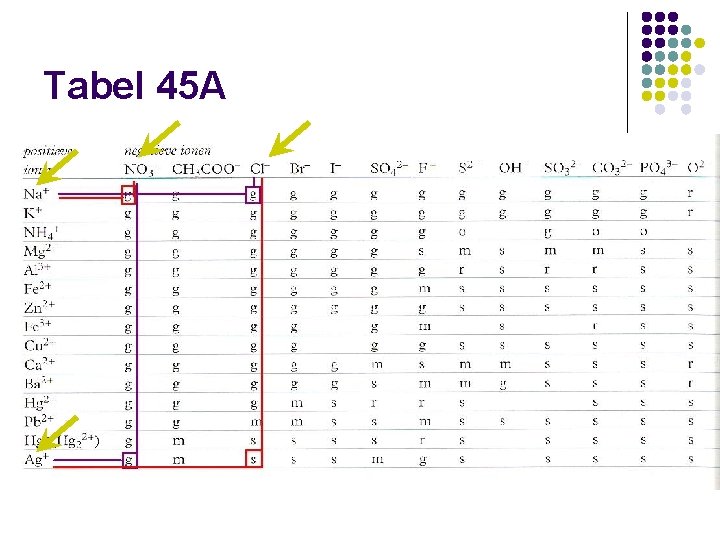
Tabel 45 A

Neerslagreactie vergelijking: l l l Ag+ en Cl- : de combinatie is slecht oplosbaar Dat betekent dat ze niet bij elkaar in één oplossing zullen voorkomen Ze zullen met elkaar reageren en een neerslag vormen: neerslagreactie De vergelijking van de reactie wordt ook ionenvergelijking genoemd Ag+(aq) + Cl-(aq) Ag. Cl (s)

Neerslagreacties http: //www. youtube. com/watch? v=p. Fovl. Kp. P Cb. I l l Oplossingen van Na. I en Hg. Cl 2 worden bij elkaar gevoegd. Er ontstaat een rood neerslag
Tabel 45 A

Neerslagreactie vergelijking: l Hg 2+ en Cl- : de combinatie is slecht oplosbaar: neerslagreactie l Ionenvergelijking: Hg 2+(aq) + 2 l-(aq) Hgl 2 (s)

Neerslagreacties http: //www. youtube. com/watch? v=36 Nft 7 s. B 5 fs l l Oplossingen van Pb(NO 3)2 en KI worden bij elkaar gevoegd. Er ontstaat een geel neerslag
- Slides: 23