Zouten en water Tutor voor de vierde klassen














- Slides: 17

Zouten en water Tutor voor de vierde klassen Hyperlinks zijn groen gekleurd en geven extra informatie 28 -11 -2020 1

Kenmerken van zouten Bij de indeling van de stoffen in overzichtelijke groepen, zijn de zouten gekenmerkt door een theoretische en een praktische benadering. . * Theoretische benadering: Zouten bestaan altijd uit zowel metaal als niet-metaal ionen. * Praktische benadering: Zouten geleiden de elektrische stroom alleen in de vloeibare fase 28 -11 -2020 Copyright Bogerman 2

De opbouw van een vast zout ü ü ü De opbouw in de vaste fase heeft een regelmatige structuur Hierin wisselen positieve en negatieve ionen elkaar af Deze regelmatige structuur noemen we een ionrooster 28 -11 -2020 “ 3 D-model open structuur” 3

Wat zijn ionen ? Ionen zijn geladen deeltjes. Enkelvoudige positieve ionen ontstaan doordat metaalatomen een of meer elektronen afstaan Enkelvoudige negatieve ionen ontstaan doordat niet-metaalatomen een of meer elektronen afstaan 28 -11 -2020 4

Naast enkelvoudige ionen kennen we ook zogenaamde samengestelde of complexe ionen. Een samengesteld ion heeft altijd minstens twee symbolen in zijn formule. Voorbeelden: Enkelvoudig : Ag + Samengesteld : NH 4 28 -11 -2020 + Cr 3+ OH – 2– O 2– S 2 O 3 N 3– PO 4 3– 5

Naamgeving positieve ionen Enkelvoudige positieve ionen krijgen de naam van het metaal. + 3+ Voorbeeld: zilverion (Ag ), of chroomion (Cr ). Samengestelde positieve ionen krijgen de uitgang “~ium”. Voorbeeld : ammoniumion (NH 4+) Losse ionen krijgen na een eventuele uitgang altijd nog het extra achtervoegsel ‘-ion’. 28 -11 -2020 6

Naamgeving negatieve ionen Enkelvoudige negatieve ionen krijgen de uitgang: “~ide” Voorbeeld: oxide-ion (O 2– )en fosfide-ion (P 3 - ). Samengestelde negatieve ionen krijgen de uitgang: “~iet” of “~aat”. 33 Voorbeeld: fosfietion (PO 3 ) en fosfaation (PO 4 ) (-iet heeft altijd één zuurstofatoom minder dan -aat) Uitzondering is het hydroxide-ion (OH–). Dit is een samengesteld negatief-ion, met de uitgang -ide. 28 -11 -2020 7

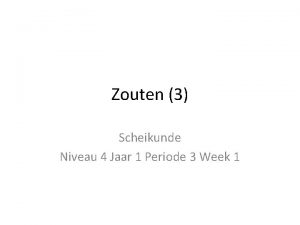
Opstellen zoutformules Nm– Nm 2– Nm 3– Me+ Me. Nm Me 2 Nm Me 3 Nm Me 2+ Me. Nm 2 Me. Nm Me 3 Nm 2 Me 3+ Me. Nm 3 Me 2 Nm 3 Me. Nm De verhouding tussen de positieve en negatieve ionen is steeds zo gekozen, dat de totale pluslading gelijk is aan de totale minlading ! Zoutformules noemen we dan ook verhoudingsformules! 28 -11 -2020 8

Oplossen van een zout in water (1) Ø Ø Bij het oplossen van een zout in water, worden de bindingen tussen de ionen verbroken De ionen komen volledig los van elkaar tussen de watermolekulen te zitten De ionen worden op een speciale manier door de watermolekulen omringd Deze omringing leidt tot een nieuwe binding, die we de hydratatiebinding noemen 28 -11 -2020 9

Oplossen van een zout in water (2) Watermolekulen zijn sterk polair. De waterstofkant is enigszins positief geladen en de zuurstofkant enigszins negatief. Daardoor zijn watermolekulen instaat een ionrooster af te breken. Ze voeren als het ware een aanval uit op de buitenkant van een zoutkristal. Daarbij omringen ze een ion en weken het los uit het ionrooster. Het ion wordt gehydrateerd. 28 -11 -2020 10

Oplossen van een zout in water (3) Het gehydrateerde ion laat los uit het zoutkristal en gaat de oplossing in. Dit proces herhaald zich net zolang totdat hele zoutkristal in oplossing is gegaan. Bij het positieve ion is goed te zien dat een ion aan zes kanten, door watermolekulen wordt omringd. Bij het negatieve ion gebeurt dat in de praktijk ook. 28 -11 -2020 11

Oplossen van een zout in water (4) In de vergelijking voor het oplossen van een zout in water, komt het verbreken van de ionbinding en de hydratatie duidelijk tot uiting: Na. Cl (s) Na+ (aq) + Clˉ (aq) ü De ionen staan achter de pijl apart vermeld (de ionbinding is verbroken) ü Achter de ionen staat (aq) (dit geeft de hydratatie van de ionen weer) 28 -11 -2020 meer info 12

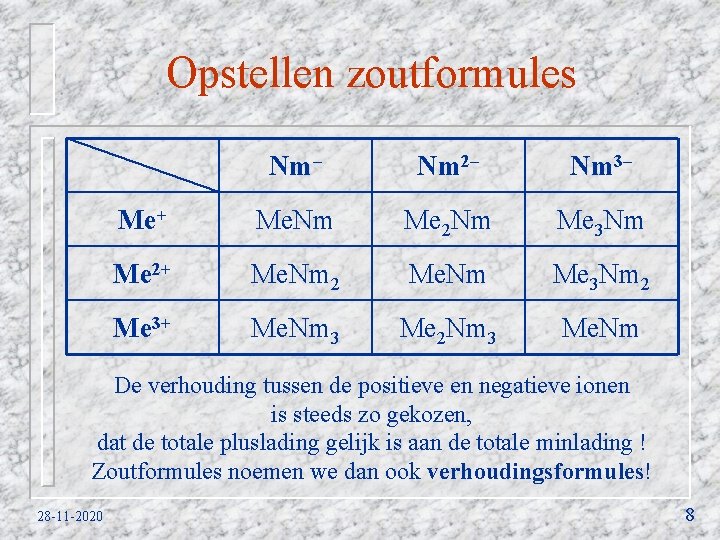
Wanneer is een molekuul polair? Een molekuul is polair wanneer de lading niet evenredig over het molekuul verdeeld. In zo’n geval is de ene kant van het molekuul merkbaar positief geladen en de andere kant negatief. De meeste polaire molekulen bevatten atomen die sterk elektronegatief zijn. Voorbeelden van sterk elektronegatieve atomen zijn fluor, zuurstof en stikstof. Deze atomen trekken extra negatieve lading naar zich toe. Ga verder 28 -11 -2020 10 a

Ontstaan polaire molekulen. Sterk elektronegatieve atomen (bijvoorbeeld zuurstof) trekken elektronen sterker naar zich toe dan andere atomen (bijvoorbeeld waterstof). Daardoor verschuiven de bindende elektronenparen naar zulke atomen toe. (zie figuur 1) Daardoor worden deze atomen enigszins negatief geladen, terwijl het naast liggende atoom enigszins positief geladen worden. Bij water gebeurt dit twee keer, waardoor een ongelijke ladingsverdeling over het molekuul ontstaat. (zie figuur 2) 28 -11 -2020 Figuur 1 δ– δ– δ– δ+ δ+ δ+ Figuur 2 10 b

Het gebruik van pijlen en andere oplosmiddelen Ø Niet elk zout is even goed oplosbaar. Het verschil in oplosbaarheid is enigszins weer te geven door het gebruik van verschillende pijlen in de oplosvergelijking. Ø De oplosbaarheid van zouten is erg afhankelijk van het gebruikte oplosmiddel. Wat is precies de invloed van het gebruikte oplosmiddel? 28 -11 -2020 12 a

Gebruik van de pijlen Oplosbaarheid van het zout symbool Soort pijl Goed Matig Slecht g m s Bedenk wel dat je het hier over het oplossen hebt. Een g geeft dus aan dat het zout goed oplost, niet dat het goed reageert! Bij slecht oplosbare zouten komt er niks achter de pijl te staan! (een kruis door de pijl mag ook) 28 -11 -2020 12 b

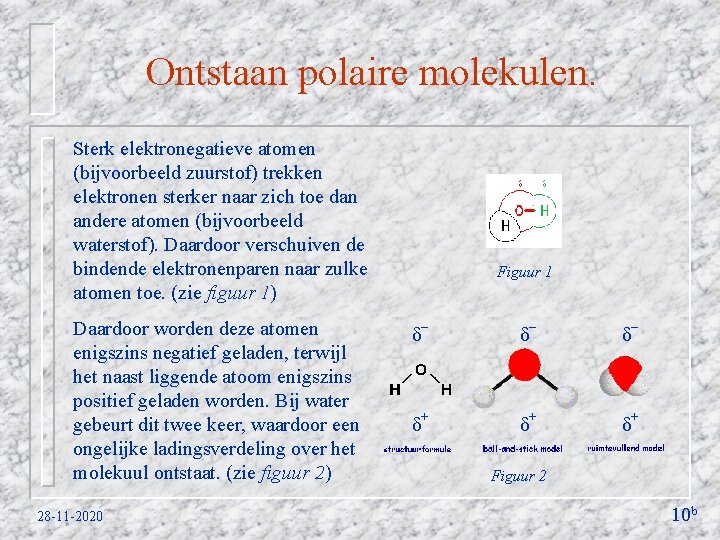
De invloed van het gebruikte oplosmiddel op de geleiding van de elektrische stroom in de oplossing Voor het verbreken van de ionbinding heb je een sterk polair oplosmiddel nodig. Oplosmiddel Relatieve geleiding Water voldoet aan die eis, ethanol (licht polair) en hexaan (apolair) voldoen niet aan die eis. Hexaan 0 Ethanol 5 Water > 150 Hiernaast staat een tabel die de geleiding van de elektrische stroom in verschillende oplosmiddelen, waar zout aan is toegevoegd, weergeeft. Hoe meer zout er oplost hoe beter de geleiding is! 28 -11 -2020 12 c
 Oplosvergelijkingen
Oplosvergelijkingen Water and water and water water
Water and water and water water Plaveiselepitheel urine
Plaveiselepitheel urine Oplosbaarheid in water tabel
Oplosbaarheid in water tabel Zoutformules opstellen
Zoutformules opstellen Verhoudingsformule calciumcarbonaat
Verhoudingsformule calciumcarbonaat Altyd vierde afrikaans summary
Altyd vierde afrikaans summary Fortpflanzung der fische klasse 5
Fortpflanzung der fische klasse 5 Vad är lyrik
Vad är lyrik Klassen dojo
Klassen dojo Johannes klassen
Johannes klassen E klassen
E klassen Generizität java
Generizität java Sekundarschule ägelsee
Sekundarschule ägelsee Gymnasium mosbacher berg
Gymnasium mosbacher berg Indeling dieren
Indeling dieren Nms feldkirchen
Nms feldkirchen Lavagetto pediatra
Lavagetto pediatra