ZMNY SKUPENSTV Michaela Tvrd Albta Midrlov OBSAH Co

ZMĚNY SKUPENSTVÍ Michaela Tvrdá Alžběta Midrlová

OBSAH Co je to skupenství? Pevná látka Amorfní látky Krystalické látky Kapalina Jevy na rozhraní pevného tělesa a kapaliny l Plynné látky l Ideální plyn l Plazma l l l l Tání Proces tání Tuhnutí Sublimace Desublimace Vypařování Kondenzace Fázový diagram

CO JE TO SKUPENSTVÍ? Skupenství neboli stav látek je kokrétní forma látky, charakterizovaná především uspořádáním částic v látce a projevují se typickými vlastnostmi. l Nejčastěji rozlišuje tři skupenství pevné, kapalné a plynné, která jsou běžná v našem okolí. l Existuje ještě čtvrté skupenství, které označujeme jako plazma. l

PEVNÁ LÁTKA l l l Je to skupenství, při kterém jsou částice látky uspořádané v krystalových mřížkách. Pohybují se kmitáním okolo rovnovážné polohy. Kinetická energie neuspořádaného pohybu částic je menší než jejich potenciální energie. Nemění tvar, objem a jsou nestlačitelné. Podle uspořádání částic rozlišujeme látky amorfní a krystalické.

AMORFNÍ LÁTKY=BEZTVARÉ Mají pravidelně uspořádané částice jen na krátké vzdálenosti = krátkodosahové uspořádání. l Př. asfalt, vosk, kaučuk, bavlna, bílkoviny. l

KRYSTALICKÉ LÁTKY Monokrystaly - mají pravidelnou krystalovou strukturu, ve které jsou pravidelně uspořádané částice → dalekodosahové uspořádaní. l Polykrystaly - skládají se z velkého počtu drobných krystalků = zrna, ty mají uvnitř pravidelné uspořádní, ale jejich poloha není pravidelná. l Dvojčata - srostlé monokrystaly oddělené tzv. dvojčatnou rovinou. l

KAPALINA Kapaliny mají stálý objem, ale už ne tvar. Tvoří přechod mezi úplně uspořádanými pevnými látkami a neuspořádanými plyny. l Uspořádání kapalin je krátkodosahové, podobné amorfním látkám. l Její molekuly kmitají kolem jedné rovnovážné polohy, ale mohou z ní uniknout a zaujmout polohu jinou. l Volný povrch kapaliny se chová jako pružná blána, udrží tělesa s větší hustotou než voda. l l

JEVY NA ROZHRANÍ PEVNÉHO TĚLESA A KAPALINY l Některé kapaliny mohou smáčet stěny nádoby, jiné ne. l Smáčení závisí na stykovém úhlu: θ=(0; 90°)…smáčení nádoby, př. voda θ=90°…povrch kapaliny je nezakřivený θ=(90; 180°)…nesmáčení nádoby, př. vosk

PLYNNÉ LÁTKY l l l Je to skupenství, při kterém jsou částice relativně daleko od sebe, pohybují se v celém objemu a nepůsobí na sebe přitažlivou silou. Kinetická energie částic je mnohem větší než jejich potenciální energie. Částice jsou jednoatomé nebo dvouatomové. Mění tvar, objem. Jsou stlačitelné a rozpínavé.

IDEÁLNÍ PLYN Používá se ke zjednodušenému zkoumání vlastností a chování plynů při mechanických a termodynamických dějích. l Musí splňovat 3 podmínky: ¡ Zanedbáváme rozměry molekul. ¡ Molekuly na sebe navzájem nepůsobí silami: Epč=0 → ∆U=Ekč ¡ Vzájemné srážky molekul navzájem a se stěnami nádoby jsou dokonale pružné. l

PLAZMA Navenek se plazma jeví jako nenabitá tekutina (kapalina či plyn). l V plazmatu se nachází volné nosiče náboje, což je zcela odlišuje od plynů. l Plazma je vodivé a silně reaguje na elektrická a magnetická pole. l Př. plamen svíčky. l
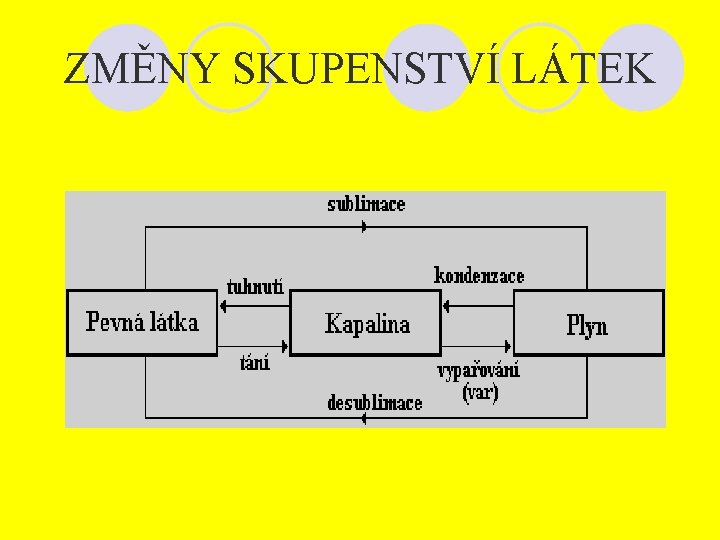
ZMĚNY SKUPENSTVÍ LÁTEK

TÁNÍ Tání je přeměna látky pevné na kapalnou. l K tomu, aby pevná látka začala tát, je potřeba zahřát ji na teplotu tání. Aby látka zahřátá na teplotu tání roztála, je třeba ji dodat skupenské teplo tání. l Skupenské teplo tání je celkové teplo, které pevná látka při přechodu na kapalinu přijme během tání. Lt=lt. m [Lt]=J l

PROCES TÁNÍ l Částice v pevné látce kmitají okolo rovnovážných poloh v pravidelné krystalové mřížce. Dodáváním tepla (energie) se zvýší výchylka kmitavého pohybu, částice si začnou vyměňovat svá místa – tím se naruší vazby. Vnitřní energie se postupně zvyšuje, během dodání skupenského tepla se nezvyšuje ani teplota, ani energie.

Krystalická látka Amorfní látka

TUHNUTÍ Přeměna kapalné látky na pevnou. Látce odebíráme energii → skupenské teplo tuhnutí, které je stejné jako skupenské teplo tání. l Vytvoří se tzv. zárodky krystalu, pokud se vytvoří jeden zárodek vznikne monokrystal, pokud více zárodků vzniká polykrystal. l Tvorbu krystalků můžeme urychlit různými nečistotami (prach, apod. ). l Některé kapaliny mohou existovat v kapalném stavu i pod bodem tání=přechlazené kapaliny. l l

SUBLIMACE Přeměna pevné látky na plynnou. l Látce musíme dodat energii → skupenské teplo sublimace: Ls, [Ls]=J l Měrné skupenské teplo k porovnání: ls, [ls]=J. kg-1 l Dobře sublimují látky voňavé, páchnoucí. l V uzavřené nádobě může dojít k rovnovážnému. stavu pevné látky a plynu →mají stejnou teplotu. l ls= Ls/m l

DESUBLIMACE Opačný proces sublimace → přeměna plynné látky na pevnou. l Látce odebíráme energii → skupenské teplo desublimace = skupenské teplo sublimace. l Měrné skupenské teplo desublimace = měrné skupenské teplo sublimace. l Např. jinovatka, hasící přístroj. l

VYPAŘOVÁNÍ l l l Přeměna kapalné látky na plynnou. Látce dodáváme teplo → skupenské teplo vypařování: Lv, [Lv]=J Měrné skupenské teplo: lv, [lv]=J. kg-1 Dochází k němu při jakékoliv teplotě. Rychlost vypařování závisí na: o Teplotě o Velikosti povrchu o Vlastnostech kapaliny o Pohybu plynu nad kapalinou o Tlaku par plynu nad kapalinou. Objem se vždy zvětšuje, za stálého tlaku se teplota nemění.

KONDENZACE Opačný proces vypařování → přeměna plynné látky na kapalnou l Látce odebíráme teplo → skupenské teplo kondenzace = skupenské teplo vypařování l Měrné skupenské teplo kondenzace = měrné skupenské teplo vypařování l Např. déšť, rosa l

FÁZOVÝ DIAGRAM I III IV A K t s p pevná látka kapalina přehřátá pára plyn trojný bod kritický bod křivka tání křivka sublimace křivka syté páry

ZDROJE www. wikipedie. org l www. fyzika. jreichl. com l sešit IV. B l
- Slides: 22