Zklady prodnch vd sticov sloen ltek Thompsonv Rutherfordv

















![Látkové množství �Fyzikální veličina, značí se „n“ [mol] �Vyjadřuje počet částic v látce (atomy, Látkové množství �Fyzikální veličina, značí se „n“ [mol] �Vyjadřuje počet částic v látce (atomy,](https://slidetodoc.com/presentation_image_h2/5916cf06621f805fa8c24951afd05529/image-26.jpg)
![Molární hmotnost �Fyzikální veličina udávající hmotnost jednoho molu �Mm- molární hmotnost [g*mol-1] �m – Molární hmotnost �Fyzikální veličina udávající hmotnost jednoho molu �Mm- molární hmotnost [g*mol-1] �m –](https://slidetodoc.com/presentation_image_h2/5916cf06621f805fa8c24951afd05529/image-27.jpg)












- Slides: 39

Základy přírodních věd Částicové složení látek

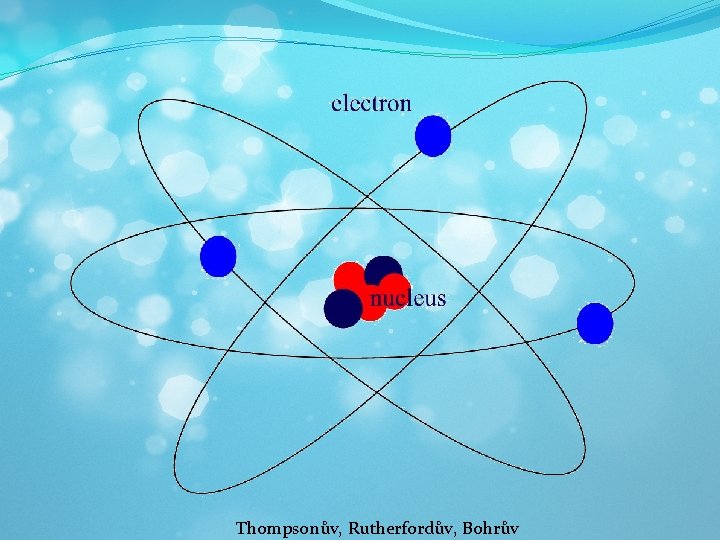
Thompsonův, Rutherfordův, Bohrův

�Veškerá hmota se se skládá z částic �Základní stavební jednotkou je atom �Částice se v látce neustále neuspořádaně pohybují �Brownův pohyb

Základní pojmy �Atom (atomos – nedělitelný) �Základní stavební částice látek �Elektricky neutrální �Jádro (protony, neutrony), obal (elektrony) �Molekula �je částice složená ze dvou a více atomů (př. voda) �Ionty � elektricky nabité částice atomární velikosti

Základní pojmy �Kationt �kladně nabitý iont, více protonů než elektronů �Aniont �záporně nabitý iont, více elektronů než protonů �Prvek - atom nebo látka složená ze stejného druhu atomů �(Au, Fe, …) �Sloučenina - látka složená ze stejného druhu molekul �(H 2 O, HCl, …) �Směs - látka složená z různých atomů a molekul (vzduch)

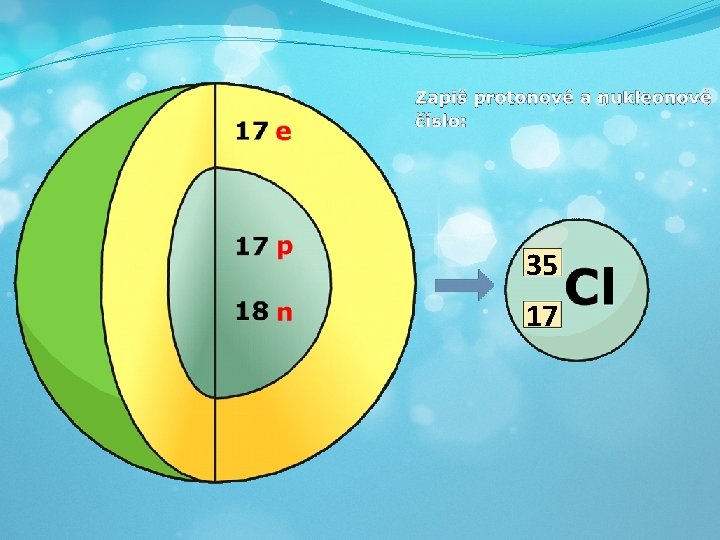
Značení atomu �Protonové číslo �Počet protonů v jádře (= počet elektronů) �Nukleonové číslo �Počet částic v jádře atomu (protony + neutrony)

Izotopy �Atomy stejného prvku s rozdílným počtem neutronů �Rozdílné nukleonové číslo

35 17

2 2 4 2 2

2 Na – dva atomy sodíku H 2 O – jedna molekula vody 5 O 2 5 molekul kyslíku 8 Fe 8 atomů železa Určete počet atomů: C 6 2 Au 2 H 2 SO 4 6 2 14

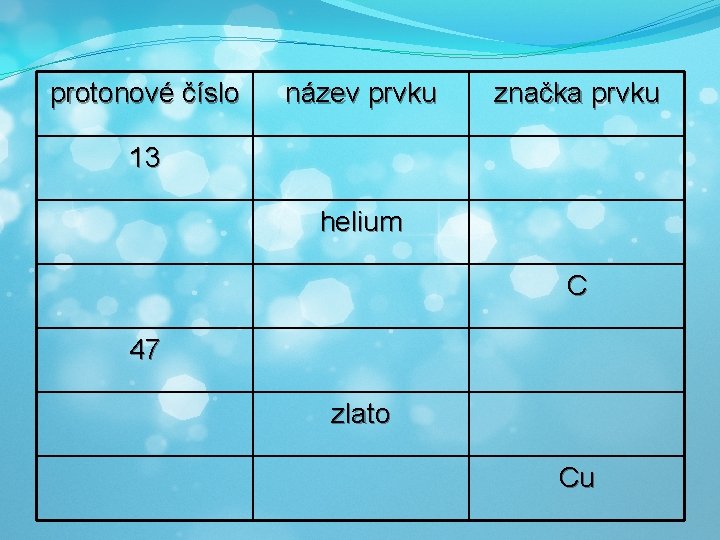
protonové číslo název prvku značka prvku 13 helium C 47 zlato Cu

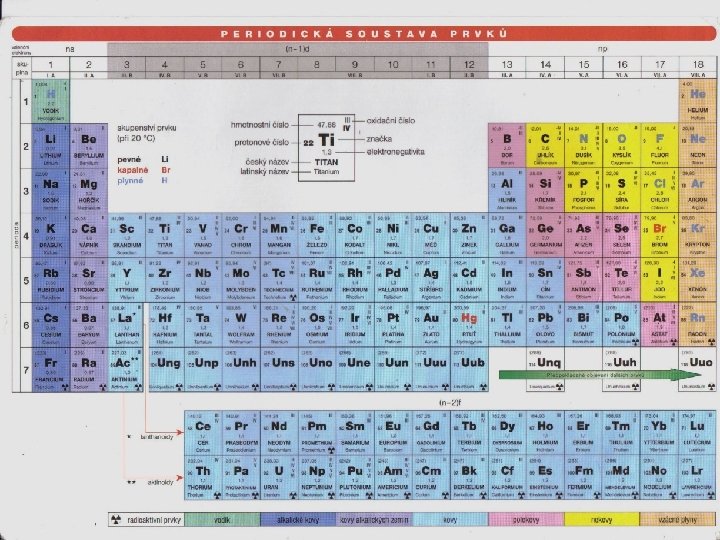
Periodická tabulka � 118 prvků, 94 přirozeně �Řádky (periody) – prvky vzestupně seřazeny podle protonového čísla �Sloupce (skupiny prvků) – prvky se stejným počtem valenčních elektronů (podobné chem. Vlastnosti) �Periodický zákon 1869 (Dmitrij Ivanovič Mendělejev) �"Vlastnosti prvků jsou periodickou funkcí jejich atomových hmotností. Vlastnosti chemických prvků se pravidelně opakují. "

Periodická tabulka • Skupiny 1 -2 a 13 – 18 • Hlavní skupiny, nepřechodné (základní) s- a p-prvky • Skupiny 3 -12 • Vedlejší skupiny, přechodné, vedlejší d-prvky • Vyčleněny lanthanoidy a aktinoidy • Vnitřně přechodné f-prvky �Alkalické kovy �Kovy alkalických zemin �Lanthanoidy �Aktinoidy �Chalkogeny �Halogeny �Vzácné plyny


Valenční elektron/y �V nejvyšších energetických vrstvách (orbitalech) �Podílí se na vzniku chemických vazeb �Elektronové slupky, podslupky (hladiny, podhladiny) typ orbitalu s, p, d, f �Výstavbový princip - orbitaly s nižší energií se zaplňují dříve - 1 s, 2 p, 3 s, 3 p, 4 s, 3 d, 4 p, 5 s, 4 d, 5 p, 6 s, …

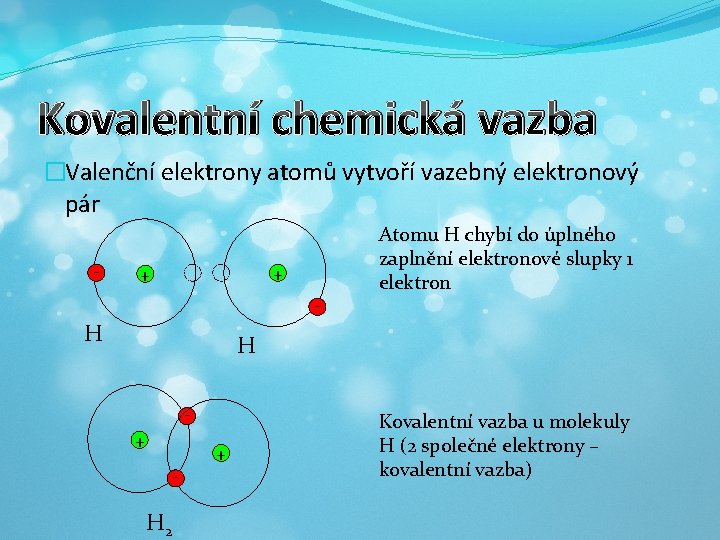
Kovalentní chemická vazba �Valenční elektrony atomů vytvoří vazebný elektronový pár - + + - H Atomu H chybí do úplného zaplnění elektronové slupky 1 elektron H + + - H 2 Kovalentní vazba u molekuly H (2 společné elektrony – kovalentní vazba)

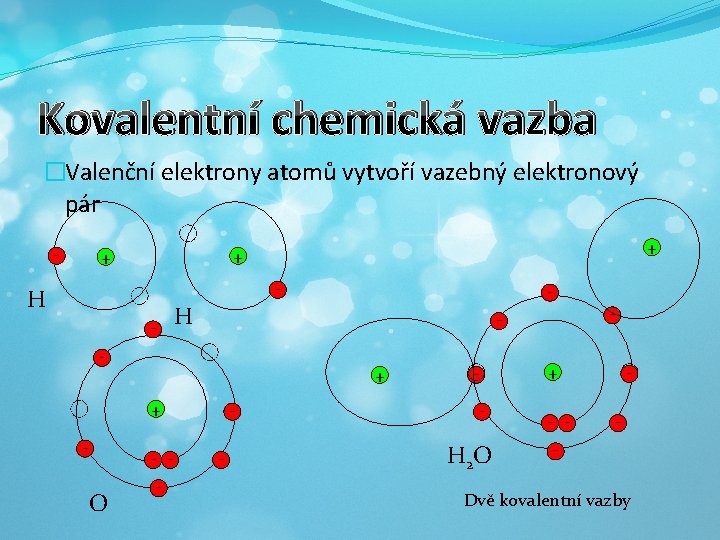
Kovalentní chemická vazba �Valenční elektrony atomů vytvoří vazebný elektronový pár - + + + - H + + - - O - - - - H 2 O - + - - Dvě kovalentní vazby

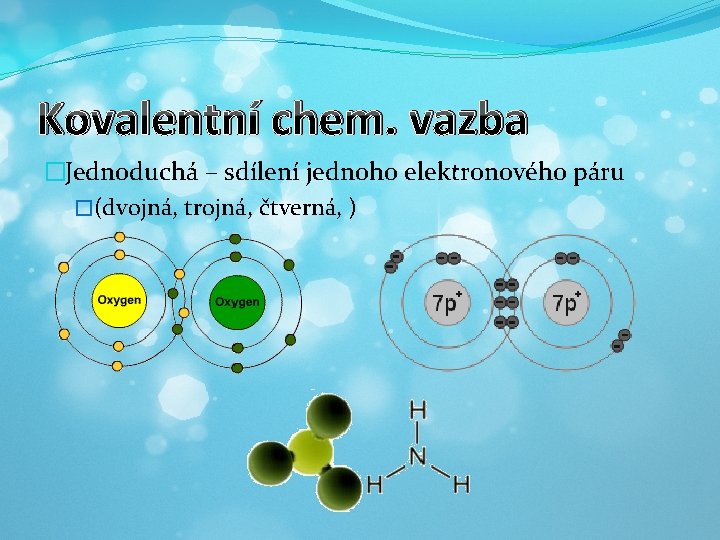
Kovalentní chem. vazba �Jednoduchá – sdílení jednoho elektronového páru �(dvojná, trojná, čtverná, )


Kovalentní chemická vazba �Elektronegativita – schopnost atomu přitáhnout vazebný elektron/y �Dělení podle polarity: �Nepolární � Rozdíl elektronegativit menší než 0, 4 �Polární � Rozdíl elektronegativit 0, 4 až 1, 7 �Iontová (extrémně polární) � Rozdíl elektronegativit 1, 7 a více

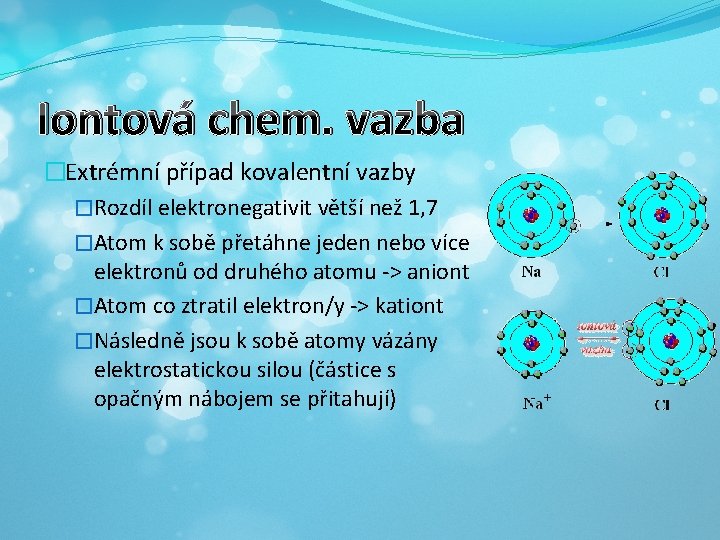
Iontová chem. vazba �Extrémní případ kovalentní vazby �Rozdíl elektronegativit větší než 1, 7 �Atom k sobě přetáhne jeden nebo více elektronů od druhého atomu -> aniont �Atom co ztratil elektron/y -> kationt �Následně jsou k sobě atomy vázány elektrostatickou silou (částice s opačným nábojem se přitahují)

Kovová vazba �Mezi atomy kovů �Všechny atomy sdílí své valenční elektrony navzájem �-> Elektronový plyn

Slabé vazebné interakce �Vodíkové můstky �Van der Waalsovy síly

Relativní atomová hmotnost �(poměrná atomová hmotnost) �Bezrozměrná veličina, značí se Ar �Nalezneme v periodické tabulce �U přirozeně se vyskytujících prvků je dána poměrným zastoupením izotopů prvku �Určena klidovou hmotnostní a atomovou hmotnostní konstantou

�Relativní hmotnost atomu Ar �Ar je bezrozměrné číslo udávající, kolikrát je hmotnost atomu větší než hmotnost 1/12 atomu nuklidu 12 C. �Relativní molekulová hmotnost Mr �Vypočteme ji jako součet relativních atomových hmotností prvků tvořících sloučeninu, které jsou vynásobeny příslušnými stechiometrickými koeficienty Př. : Jaká je relativní atomová hmotnost kyslíku O Jaká je relativní molekulová hmotnost vody
![Látkové množství Fyzikální veličina značí se n mol Vyjadřuje počet částic v látce atomy Látkové množství �Fyzikální veličina, značí se „n“ [mol] �Vyjadřuje počet částic v látce (atomy,](https://slidetodoc.com/presentation_image_h2/5916cf06621f805fa8c24951afd05529/image-26.jpg)
Látkové množství �Fyzikální veličina, značí se „n“ [mol] �Vyjadřuje počet částic v látce (atomy, ionty, molekuly, …) � 1 mol obsahuje stejný počet částic jako je obsaženo ve 12 g izotopu uhlíku 12 C - tento počet udává: �Avogadrova konstanta = 6, 022× 1023 mol− 1 (značí se NA) �(N – počet částic v látce) Př. : Na světě žije asi 6, 1 miliard lidí. Vyjádřete toto číslo jako látkové množství (v molech).
![Molární hmotnost Fyzikální veličina udávající hmotnost jednoho molu Mm molární hmotnost gmol1 m Molární hmotnost �Fyzikální veličina udávající hmotnost jednoho molu �Mm- molární hmotnost [g*mol-1] �m –](https://slidetodoc.com/presentation_image_h2/5916cf06621f805fa8c24951afd05529/image-27.jpg)
Molární hmotnost �Fyzikální veličina udávající hmotnost jednoho molu �Mm- molární hmotnost [g*mol-1] �m – hmotnost �n – látkové množství

Příklady �Určete molární hmotnost: � O 2 �Na. Cl (Chlorid sodný) �Ca. CO 3 (uhličitan vápenatý) �Kolik váží: � 1 mol O 2 � 2 moly kyseliny chlorovodíkové �Kolik atomů Fe je obsaženo ve 20 g železa? �Kolik molů obsahuje kyselina sírová o hmotnosti 49, 05 g �Jakou hmotnost mají 3 moly kyseliny dusičné (HNO 3)

Příklady �Určete hmotnost 30 milionů atomů kyslíku. �Smrtelná dávka KCN je asi 0, 08 mmol na 1 kg hmotnosti lidského těla. Jaká hmotnost KCN představuje smrtelné nebezpečí pro osobu vážící 70 kg? (Kyanid draselný) �V lidském těle je 65 % kyslíku, 18 % uhlíku, 10 % vodíku. Kterých atomů je v těle nejvíce?

Příklady �V kapce mořské vody je asi 50 miliard atomů zlata. Vážíli 30 kapek mořské vody 1 g, vypočítejte hmotnost zlata v 1 tuně mořské vody. �Kapka vody má hmotnost 0, 18 g. Na světě žije asi 6 miliard lidí. Kolik molekul vody z této kapky by připadlo každému člověku, kdybychom ji mezi ně rovným dílem rozdělili? �Máte k dispozici 2, 8 molu jodidu draselného. Jakou má toto látkové množství hmotnost? (KI)

Příklady �Jakému látkovému množství odpovídá 180 g hydroxidu sodného? �Jaké je látkové množství 2, 38. 1024 molekul amoniaku? �Jaká je hmotnost 0, 052 molu oxidu dusnatého (NO) ? �Pro uskutečnění reakce je třeba 0, 75 molu sodíku. Jaká je hmotnost sodíku?

Molární objem �Objem jednoho molu látky �závisí zejména u plynů na teplotě a tlaku. �pro plyny za normální teploty a tlaku � (tlak 101325 Pa, teplota 273, 15 K) � Mají objem 22, 4 l/mol (Normální molární objem Vm) �Příklady: �Jaký objem mají za normálních podmínek 3 moly dusíku? �Určete látkové množství 10 dm 3 ethenu ( C 2 H 2) za normálních podmínek.

Hustota �Fyzikální veličina �Značí se ρ (ró) �Základní jednotka: kg. m-3 �Jakou hustotu má? �Vzduch �Voda �Kolik váží železná krychle o straně a=10 cm? ρ(Fe) = 7, 86 g/cm 3 �Máme 20 g zlata, jaký poloměr bude mít koule z něj odlitá? ρ(Au) = 19, 3 g/cm 3

Směsi a roztoky �Směs – vznikne smícháním dvou a více látek �Roztok je homogenní směs jedné nebo více látek rozpuštěná v jiné látce – rozpouštědle �Roztoky se nazývají podle rozpouštědla �Např. vodný roztok chloridu sodného

Směsi a roztoky �Různorodá směs (heterogenní) �lze spatřit složky směsi očima či pod mikroskopem � 1. suspenze - Látka kapalná a pevná � 2. emulze - Látky kapalné (2 a více) � 3. pěna - Látka kapalná a plynná (více plynné látky ) � 4. aerosol - mlha nebo dým � mlha - látka kapalná a plynná - převaha kapalné látky � dým - látka plynná a pevná - převaha plynu

Směsi a roztoky �Stejnorodá směs (homogenní) , roztok �je složen z rozpouštědla (voda, ethanol, aj. ) a látky rozpustné �nelze spatřit složky roztoku očima ani pod mikroskopem � 1. podle skupenství � plynné - vzduch, zemní plyn, . . . � kapalné - ropa, benzín, . . . � pevné - slitiny kovů, ocel, sklo, . . . � 2. podle rozpouštědla � vodný (roztok) � acetonový (roztok) � lihový (roztok)

Hmotnostní zlomek �Hmotnostní zlomek udává poměrné hmotnostní zastoupení látky A v roztoku. m. A = hmotnost látky mr = hmotnost rozpouštědla �m. R = hmotnost roztoku �m. R = m. A + mr �Hmotnostní procento (hmot. % = WA. 100) �Získáme vynásobením hmotnostního zlomku 100

Objemový zlomek �Objemový zlomek udává poměr objemu rozpuštěné látky A k objemu roztoku VA = objem látky A VR- objem roztoku (celého) Objemové procento (obj. % = Wv(A). 100) Získáme vynásobením objemového zlomku 100

Příklady �Kolik gramů chloridu sodného je v 400 g 8%ního roztoku této soli? �Kolika procentní roztok vznikne rozpuštěním 40 gramů hydroxidu draselného(KOH) ve 160 gramech vody? �Kolik ml 100 % (absolutního) alkoholu potřebujeme na přípravu 2 l 40 % roztoku?