Zklady prodnch vd Chemie nzvoslov Nzvoslov anorganickch slouenin
















- Slides: 18

Základy přírodních věd Chemie - názvosloví

Názvosloví anorganických sloučenin �Názvosloví dvouprvkových sloučenin � Názvosloví oxidů � Názvosloví peroxidů � Názvosloví bezkyslíkatých kyselin � Názvosloví bezkyslíkatých solí � Názvosloví hydridů � Názvosloví interhalogenových sloučenin �Názvosloví víceprvkových sloučenin � Názvosloví hydroxidů � Názvoslový kyslíkatých kyselin � Názvosloví kyslíkatých solí � Názvosloví hydrogensolí � Názvosloví směsných a podvojných solí � Názvosloví komplexních sloučenin

Obecná pravidla �Součet oxidačních čísel ve sloučenině je nula �Pokud se jedná o elektroneutrální molekulu �U iontů je roven náboji �Fluor má vždy oxidační číslo -I �Vodík má běžně oč +I (vyjímka – vazba s elektronegativnějším prvkem –I) �Kyslík má zpravidla oč –II (výjimku tvoří peroxidy -I, ozonidy, …) �Halogeny, mají oxidační číslo –I (vyjímka vazba s O, N, elektropozitivnější halogen) �Kovy mají ve sloučeninách jen kladná oxidační čísla s výjimkou některých komplexních sloučenin

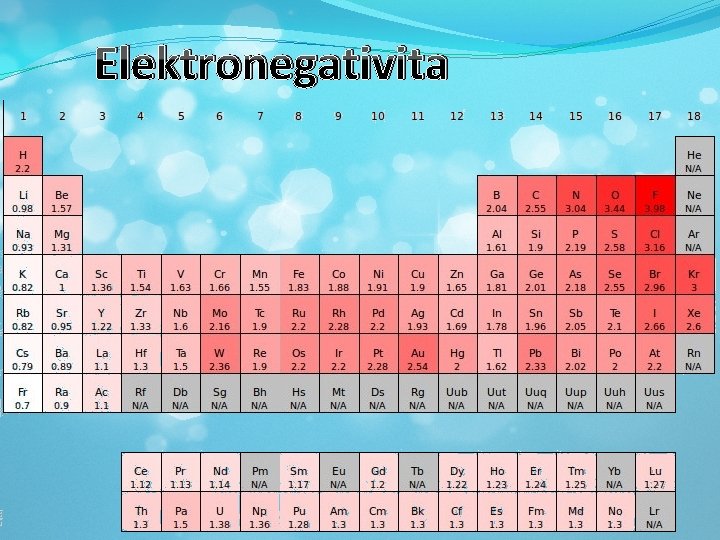
Obecná pravidla �Kovy I. A skupiny (alkalické kovy) mají oxidační číslo I (vyjímka alkalidy) �Kovy II. A skupiny (kovy alkalických zemin) mají oxidační číslo II �Kovy III. A skupiny mají oxidační číslo III �Maximální kladné oxidační číslo je rovno číslu A skupiny, ve které prvek leží �U dvouprvkových sloučenin má kladné oxidační číslo prvek s nižší elektronegativitou a záporné oxidační číslo prvek s vyšší elektronegativitou.

Elektronegativita

Obecně �Číslovkové předpony: 1 mono, 2 di, 3 tri, 4 tetra, 5 penta, 6 hexa, 7 hepta, 8 okta, 9 nona, 10 deka, 11 undeka, 12 dodeka Oxidační číslo kation, oxid kyselina anion, sůl I -ný -ná -nan II -natý -natá -natan III -itý -itá -itan IV -ičitý -ičitá -ičitan V -ičný, -ečný -ičná, -ečná -ičnan, -ečnan VI -ový -ová -an VII -istý -istá -istan VIII -ičelý -ičelá -ičelan

Názvosloví binárních slouřenin �Podstatné jméno –ID + přídavné jméno – přípona �Podstatné jméno př. Oxid, sulfid, hydroxid, nitrid, karbid, peroxid, hydrid, … �Př. : � Oxid siřičitý SO 2 � Sulfid železitý Fe 2 S 3 � Oxid olovičitý Pb. O 2 � Karbid hlinitý Al 4 C 3 Oxidační číslo Koncovka I ný II natý III itý IV ičitý V ičný/ečný VI ový VII istý VII ičelý

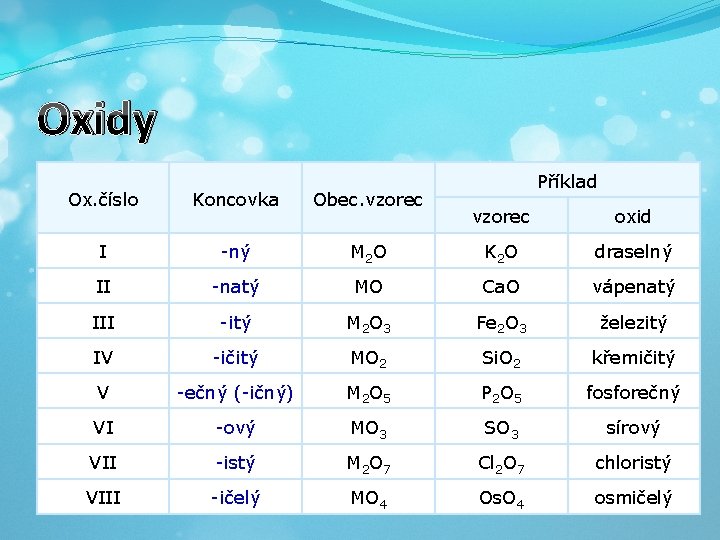
Oxidy Ox. číslo Koncovka Obec. vzorec I -ný II Příklad vzorec oxid M 2 O K 2 O draselný -natý MO Ca. O vápenatý III -itý M 2 O 3 Fe 2 O 3 železitý IV -ičitý MO 2 Si. O 2 křemičitý V -ečný (-ičný) M 2 O 5 P 2 O 5 fosforečný VI -ový MO 3 SO 3 sírový VII -istý M 2 O 7 Cl 2 O 7 chloristý VIII -ičelý MO 4 Os. O 4 osmičelý

Oxidy �Př. Cl 2 O 5 – oxid chlorečný Cr. O 3 – oxid chromový Te. O 3 – oxid telurový Cl 2 O 7 – oxid chloristý Hg. O – oxid rtuťnatý Al 2 O 3 – oxid hlinitý oxid manganičitý oxid fosforitý oxid nikelnatý tetraoxid didusičitý oxid cesný oxid rutheničelý Mn. O 2 P 2 O 3 Ni. O N 2 O 4 Cs 2 O Ru. O 4

Oxidy Li 2 O Ge. O 2 P 4 O 6 As 2 O 5 K 2 O Sn. O 2 Sb 2 O 5 Se. O 3 As 4 O 6 I 2 O 7 Ru. O 4 oxid lithný oxid germaničitý hexaoxid tetrafosforitý oxid arseničný oxid draselný oxid ciničitý oxid antimoničný oxid selenový hexaoxid tetraarsenitý oxid jodistý oxid rutheničelý oxid bromistý oxid chromový oxid fosforečný oxid hlinitý oxid manganistý oxid sírový oxid dusičný oxid uhličitý oxid osmičelý oxid sodný dekaoxid tetrafosforečný Br 2 O 7 Cr. O 3 P 2 O 5 Al 2 O 3 Mn 2 O 7 SO 3 N 2 O 5 CO 2 Os. O 4 Na 2 O P 4 O 10

Oxidy �Oxid siřičitý SO �Oxid sírový � �Oxid sirný S 2 O �Oxid sirnatý SO 2 SO 3

Halogenidy �Slouženina (F, Cl, Br, I, At) a dalšího prvku �Oxidační číslo halogenu –I �Obecný vzorec je MXn, kde n= 1 až 8 �n udává přímo oxidační číslo prvku M �Al. Br 3 - bromid hlinitý �Be. Cl 2 - chlorid berylnatý �Cr. F 6 – fluorid chromový �Al. I 3 – jodid hlinitý

�Sulfidy – binární sloučenina síry (obdoba oxidů) �Síra má OČ –II �Co 2 S 3 - sulfid kobaltitý �Hydridy �Binární sloučenina vodíku �S I. A a II. A skupinou obdobně jako u oxidů � Ca. H 2 – hydrid vápenatý �S III. A jednoslovný název se zakončením –an � Sulfan (H 2 S), alan (Al. H 3), boran (BH 3) �Kovové – proměnlivé složení, neuvádí se koncovka � Např. hydrid titanu, hydrid palladia, … �Triviální názvy hydridů � Např. voda(H 2 O), amoniak(NH 3), peroxid vodíku(H 2 O 2), chlorovodík (HCl), fluorovodík(HF), kianovodík(KCN), …

�Peroxidy �Sloučenina dvou atomového kyslíku 02 a dalšího prvku. � Většinou s prvky z 1. A skupiny �Kyslík má v peroxidech oxidační číslo –I �Na 2 O 2 – peroxid sodný, Li 2 O 2 – peroxid litný �Nitridy (N –III) – binární sloučeniny dusíku �nitrid barnatý - Ba 3 N 2 �Karbidy (C –IV) – binární sloučeniny uhlíku �karbid křemičitý - Si. C

Hydroxidy �Skupina OH �Oxidační číslo vždy –I (OH)-I �Obecný vzorec M(OH)r �Př. Na. OH – hydroxid sodný Be(OH)2 – hydroxid berylnatý KOH – hydroxid draselný Fe(OH)2 – hydroxid železnatý kde r= 1 až 4

Bezkyslíkaté kyseliny �Binární sloučeniny vodíku – vodný roztok �Název – kyselina xxx-ová �Kyselina fluorovodíková HF �Kyselina sirovodíková H 2 S �Kyselina chlorovodíková HCl �Kyselina jodovodíková HI

Kyslíkaté kyseliny �Základní vzorec: Hx. Ay. Oz �H 2 SO 4 – kyselina sírová (A – kyselinotvorný prvek) �Pokud existuje více kyselin se stejným OČ u H nebo kyselinotvorného prvku – přidáváme číslovkovou předponu �U H – trihydrogen, tetrahydrogen, … �U kys. tvor. prvku difosforečná, triželezitá, …

Kyslíkaté kyseliny �H 2 Se �HCl. O 3 �HBr. O 2 �H 5 P 3 O 4 kys. selenovodíková kys. chlorečná kys. bromitá pentahydrogentrifosforná �kyselina fluorovodíková HF �Kyselina bromná HBr. O �Kyselina chloritá HCl. O 2 �Kyselina tetrahydrogendifosforečná H 4 P 2 O 7
 Freie enthalpie gleichgewichtskonstante
Freie enthalpie gleichgewichtskonstante Chemie názvosloví
Chemie názvosloví Autohaus bonnemann
Autohaus bonnemann Organická chemie
Organická chemie Katedra fyziky chemie a odborného vzdělávání
Katedra fyziky chemie a odborného vzdělávání Studierendenportal hhu login
Studierendenportal hhu login Vis vitalis chemie
Vis vitalis chemie Chemie teilgebiete
Chemie teilgebiete Hochofen beschriftung
Hochofen beschriftung Burgerlijk ingenieur chemie
Burgerlijk ingenieur chemie Predchodkyňa chémie
Predchodkyňa chémie Jodometrie
Jodometrie Koncovky chemie
Koncovky chemie Atoomeconomie
Atoomeconomie Prinzip von le chatelier
Prinzip von le chatelier Chemie
Chemie Chemie
Chemie Stöchiometrische wertigkeit
Stöchiometrische wertigkeit Impuls chemie 4 lösungsheft
Impuls chemie 4 lösungsheft