Zklady enzymologie Petr Kolenko Enzymy biokatalyztory sloitch chemickch

Základy enzymologie Petr Kolenko

Enzymy - biokatalyzátory složitých chemických reakcí vysoká účinnost specificita reakce ve vodném prostředí regulace netoxičnost převážně bílkoviny, ale i úseky RNA nebo DNA nebílkovinná část enzymů se nazývá kofaktory mohou být vázány kovalentně i nekovalentně - stabilita? i nejjednodušší organismy mají 3000 různých enzymů zastoupení v široké škále biotechnologií
Proč jsou pro život nezbytné? Oxidace sacharosy na CO 2 a H 2 O: - vysoce exergonická - nekatalyzovaná reakce probíhá pomalu, v organismu je energie uvolněna během několika málo sekund Hydrolýza močoviny: - rychlost reakce: 3 x 10 -10/s - katalyzovaná reakce: 3 x 104/s - ureasa - zvýšení 1014 krát! … až 1016 krát

Rychlost katalysy Lehninger principles of Biochemistry
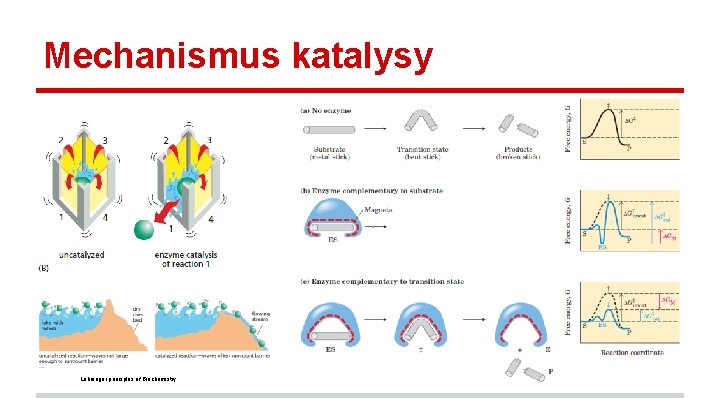
Mechanismus katalysy Lehninger principles of Biochemistry

Mechanismus katalýzy enzymů - aktivní místo komplementarita - zámek+klíč slabé vazby - velikost enzymů - konformační změny orientace v prostoru energetické spřažení reakcí Alberts et al. , Essential cell biology.
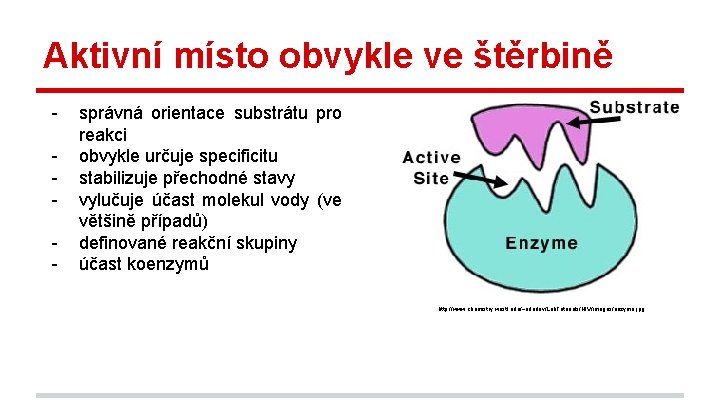
Aktivní místo obvykle ve štěrbině - správná orientace substrátu pro reakci obvykle určuje specificitu stabilizuje přechodné stavy vylučuje účast molekul vody (ve většině případů) definované reakční skupiny účast koenzymů http: //www. chemistry. wustl. edu/~edudev/Lab. Tutorials/HIV/images/enzyme. jpg
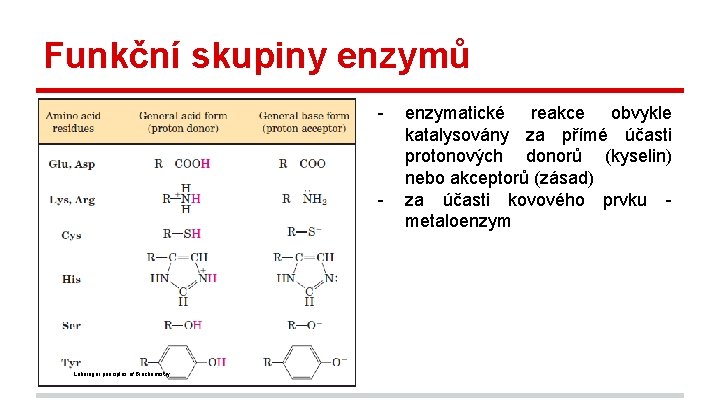
Funkční skupiny enzymů - - Lehninger principles of Biochemistry enzymatické reakce obvykle katalysovány za přímé účasti protonových donorů (kyselin) nebo akceptorů (zásad) za účasti kovového prvku metaloenzym

Klasifikace enzymů podle reakce 1. Oxidoreduktasy - katalyzují intermolekulové oxidačně redukční přeměny. 2. Transferasy - realizují přenos skupin (-CH 3, -NH 2, apod. ) z donoru na akceptor 3. Hydrolasy - hydrolytické štěpení vazby (peptidové, amidové, apod. ). Např. proteasy štěpí peptidové vazby 4. Lyasy - katalysují nehydrolytické štěpení a vznik vazeb C-C, C-O, apod. V triviálních názvech jsou označovány za synthasy. 5. Isomerasy - katalysují vnitromolekulové přesuny atomů a jejich skupin vzájemné přeměny isomerů. Nejméně početná skupina enzymů. 6. Ligasy - katalysují vznik energeticky náročných vazeb za současného rozkladu látky uvolňující energii, např. ATP.

Názvosloví a klasifikace enzymů Triviální: -in (např. pepsin, trypsin, chymotrypsin) a. Enzym katalysující přeměnu substrátu A reakcí typu R má název ARasa (např. D-glyceraldehyd-3 -fosfátfosfohydrolasa) b. Enzym katalysující reakci substrátu A se substrátem B reakcí typu R má název A: B-Rasa (např. (S)laktát-NAD+-oxidoreduktasa) Systémové číslo - zařazení enzymu v klasifikaci EC (Enzyme Comission) EC. 1. 1. 1. 27 EC. třída. podtřída. skupina. číslo enzymu uvnitř skupiny
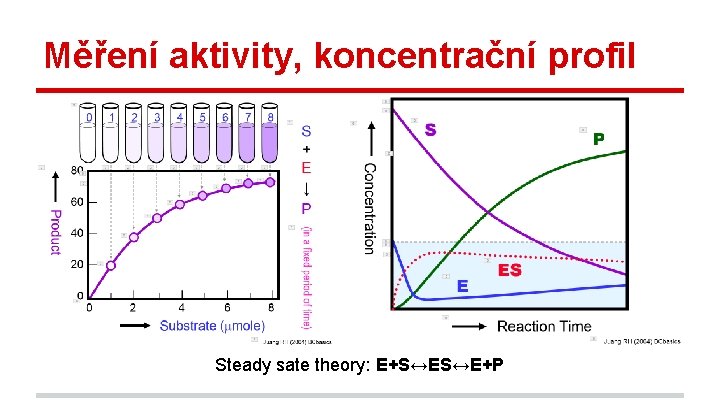
Měření aktivity, koncentrační profil Steady sate theory: E+S↔ES↔E+P

Kinetika enzymatických reakcí
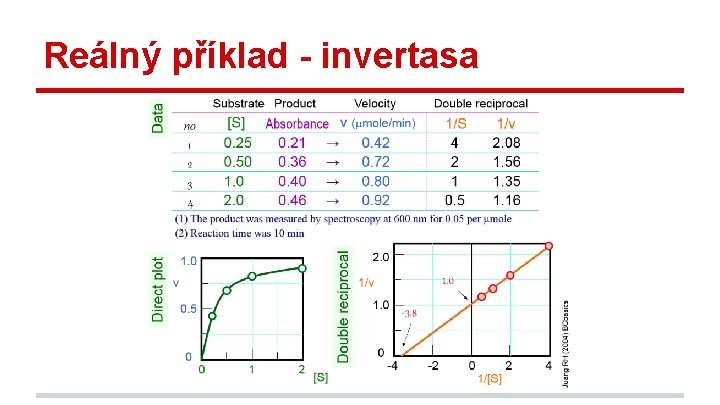
Reálný příklad - invertasa

Proteasy - patří do třídy hydrolas široce zastoupené enzymy - virové proteasy (např. HIV), proteasy produkované např. bakteriemi pro účely degradace proteinů pro vlastní metabolismus, štěpení signálních peptidů, nebo např. kontrola krevního tlaku - podle funkční skupiny v aktivním místě dělíme: 1. serinové proteasy (např. trypsin) 2. cysteinové proteasy (např. TEV proteasa) 3. aspartové proteasy (např. pepsin) 4. metaloproteasy (např. meltrin)

Serinové proteasy - např. trypsin, chymotrypsin katalytická triáda zachována: Asp-His-Ser široké spektrum specificity specificita závislá na složení (struktuře) štěrbin v okolí aktivního místa v některých případech schopné katalysovat i obrácené reakce
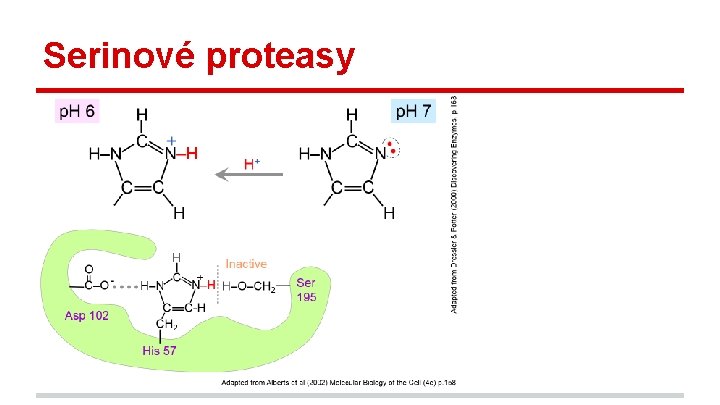
Serinové proteasy
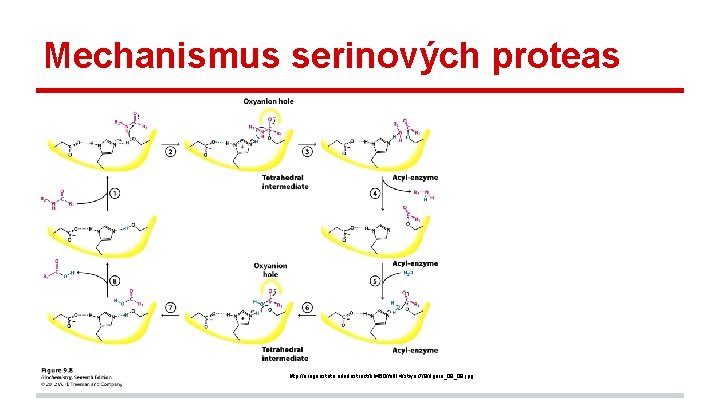
Mechanismus serinových proteas http: //oregonstate. edu/instruct/bb 450/fall 14/stryer 7/9/figure_09_08. jpg
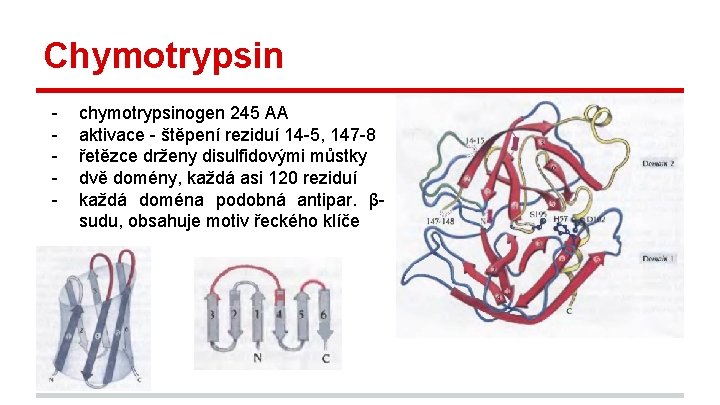
Chymotrypsin - chymotrypsinogen 245 AA aktivace - štěpení reziduí 14 -5, 147 -8 řetězce drženy disulfidovými můstky dvě domény, každá asi 120 reziduí každá doména podobná antipar. βsudu, obsahuje motiv řeckého klíče

Chymotrypsin - aktivní místo tvořeno rezidui pocházejícími ze smyček obou domén
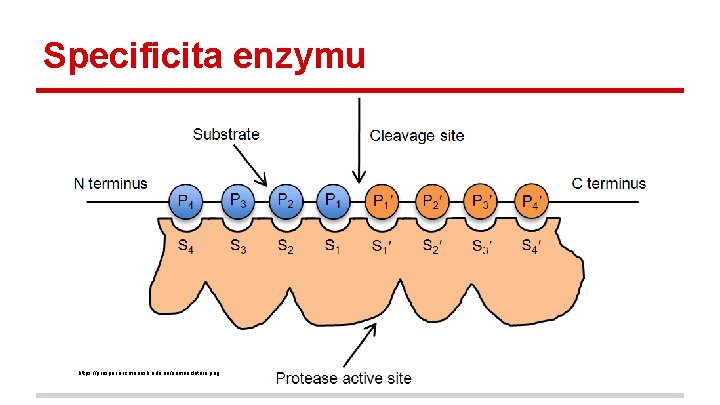
Specificita enzymu https: //prosper. erc. monash. edu. au/nomenclature. png
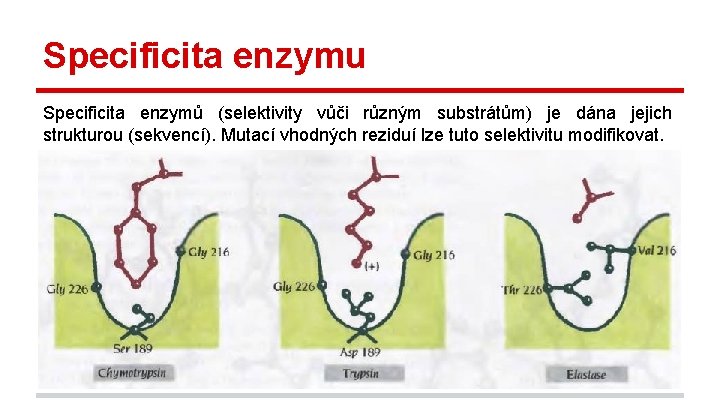
Specificita enzymu Specificita enzymů (selektivity vůči různým substrátům) je dána jejich strukturou (sekvencí). Mutací vhodných reziduí lze tuto selektivitu modifikovat.
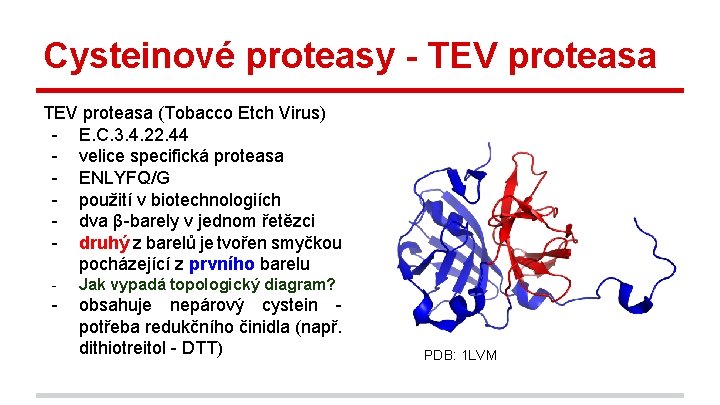
Cysteinové proteasy - TEV proteasa (Tobacco Etch Virus) - E. C. 3. 4. 22. 44 - velice specifická proteasa - ENLYFQ/G - použití v biotechnologiích - dva β-barely v jednom řetězci - druhý z barelů je tvořen smyčkou pocházející z prvního barelu - Jak vypadá topologický diagram? - obsahuje nepárový cystein potřeba redukčního činidla (např. dithiotreitol - DTT) PDB: 1 LVM
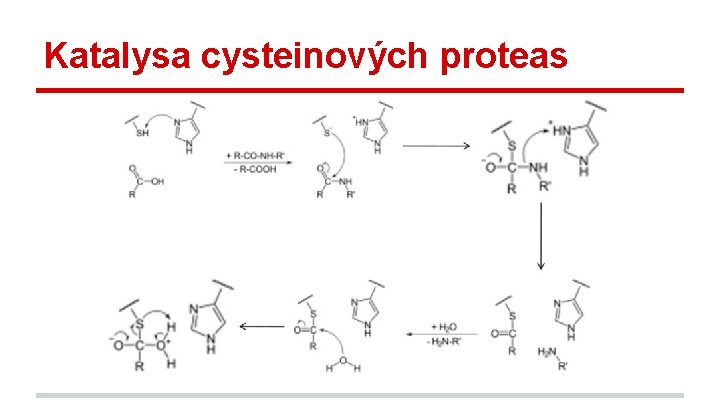
Katalysa cysteinových proteas
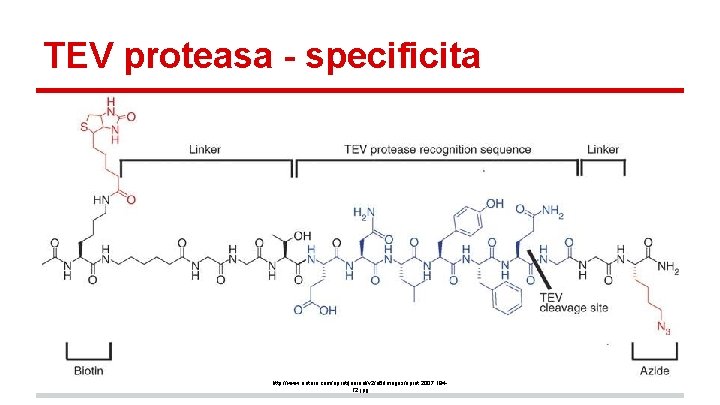
TEV proteasa - specificita http: //www. nature. com/nprot/journal/v 2/n 6/images/nprot. 2007. 194 F 2. jpg

TEV proteasa pro štěpení His-kotvy - obvykle produkována s neštěpitelnou His -kotvou jednoduchá separace cílového štěpeného vzorku Nakreslit na tabuli schéma produkce a purifikace pomocí TEV a štěpitelného His-tagu

Metaloenzym - enolasa - podílí se na glykolýze (jeden z konečných kroků) plný název 2 -phospho-D-glycerate hydro-lyasa katalyzuje přeměnu 2 -fosfoglycerátu na fosfoenolpyruvát a vodu přítomna ve všech tkáních, nedostatek vede k hemolytické anémii rovněž používána v diagnostice, protože nádorové buňky mají obvykle vysokou koncentraci tohoto enzymu infarkt myokardu

Enolasa - PDB 1 ONE - aktivní místo na C-koncové straně TIMsudu dva ionty Mg smyčky uzavírají aktivní místo - kanály? dva ligandy v aktivním místě dodatečné strukturní prvky v okolí TIMsudu
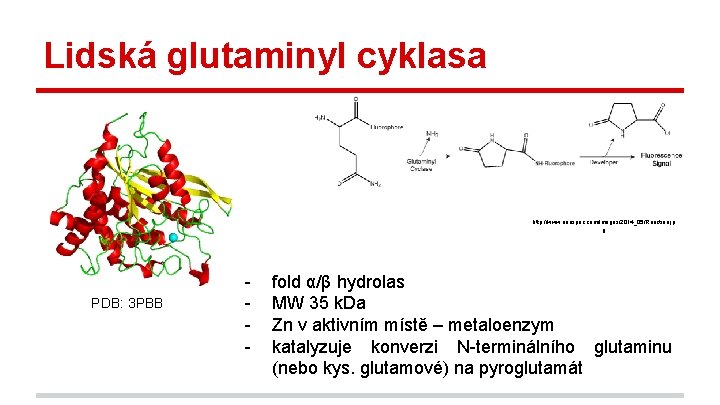
Lidská glutaminyl cyklasa http: //www. anaspec. com/images/2014_05/Reaction. jp g PDB: 3 PBB - fold α/β hydrolas MW 35 k. Da Zn v aktivním místě – metaloenzym katalyzuje konverzi N-terminálního glutaminu (nebo kys. glutamové) na pyroglutamát
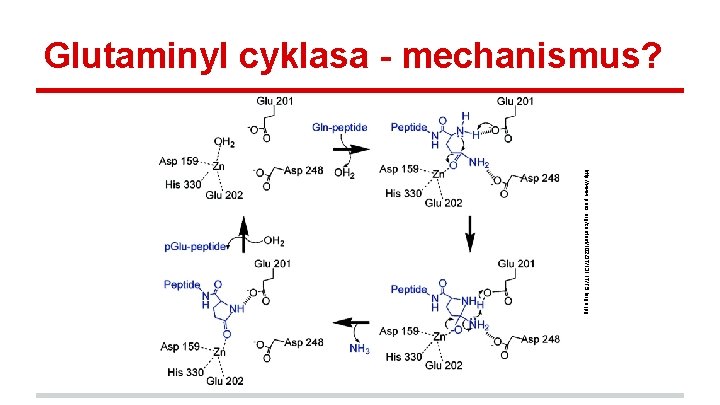
Glutaminyl cyklasa - mechanismus? http: //www. pnas. org/content/102/37/13117/F 5. large. jpg

Glutaminyl cyklasa z klíštěte K. -F. Huang, H. -L. Hsu, S. Karim, A. H. -J. Wang (2014) Structural and functional analyses of a glutaminyl cyclase from Ixodes scapularis reveal metal-independent catalysis and inhibitor binding. Acta Cryst. D 70, 789 -801. - vysoká strukturní homologie 1 m. M EDTA - zvýšení aktivity enzymu PDB: 4 MHZ

Enzymy využívající glycyl radikálů - zvláštní skupina enzymů, které ke své aktivaci (tvorbě glycylového radikálu) využívají Fe. S-proteiny Pfl. B z bakterie E. coli - Formate acetyltransferase 1, EC. xxxx, MW 160 k. Da Acetyl-Co. A + formate →Co. A + pyruvate - enzym je aktivován (vytvořen glycylový radikál) pouze v anaerobním prostředí - glycylový radikál je velmi nestabilní, po přechodu do aerobního prostředí dochází k proteolýze proteinu v místě glycylového radikálu - rychlá reaktivace pomocí proteinu Yfi. D - 15 k. Da (strukturně nevysvětleho)
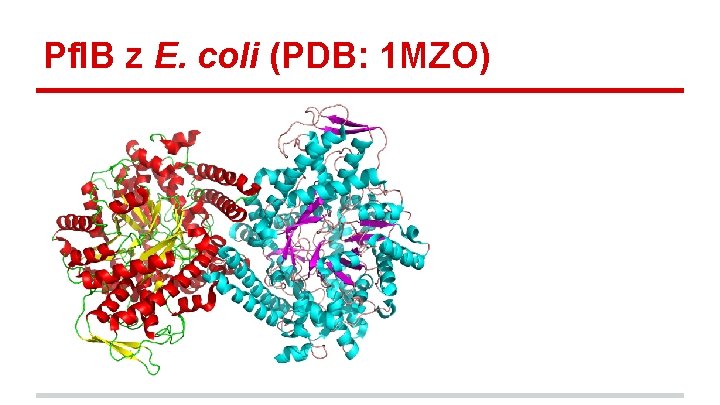
Pfl. B z E. coli (PDB: 1 MZO)
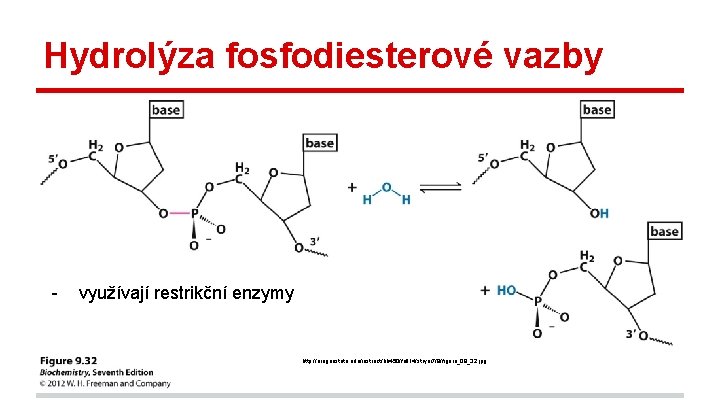
Hydrolýza fosfodiesterové vazby - využívají restrikční enzymy http: //oregonstate. edu/instruct/bb 450/fall 14/stryer 7/9/figure_09_32. jpg

Kofaktor, koenzym, . . . nebílkovinná část - kofaktor bílkovinná část - apoenzym kofaktor, který se může disociovat od apoenzymu - koenzym komplex koenzym: apoenzym - holoenzym Kofaktory se často podílejí na katalytické funkci (mechanismu) enzymu. Skutečnost, jestli je kofaktor vázán kovalentně či nekovalentně, může hrát velkou úlohu ve stabilitě enzymu jako takového, ale i v rychlosti reakce apod. Některé enzymy mají kofaktory mimo aktivní místa molekul - mají strukturní roli.
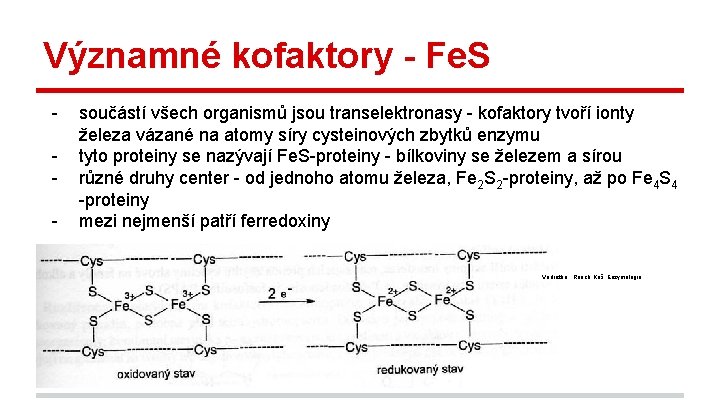
Významné kofaktory - Fe. S - součástí všech organismů jsou transelektronasy - kofaktory tvoří ionty železa vázané na atomy síry cysteinových zbytků enzymu tyto proteiny se nazývají Fe. S-proteiny - bílkoviny se železem a sírou různé druhy center - od jednoho atomu železa, Fe 2 S 2 -proteiny, až po Fe 4 S 4 -proteiny mezi nejmenší patří ferredoxiny Vodrážka , Rauch, Káš. Enzymologie.
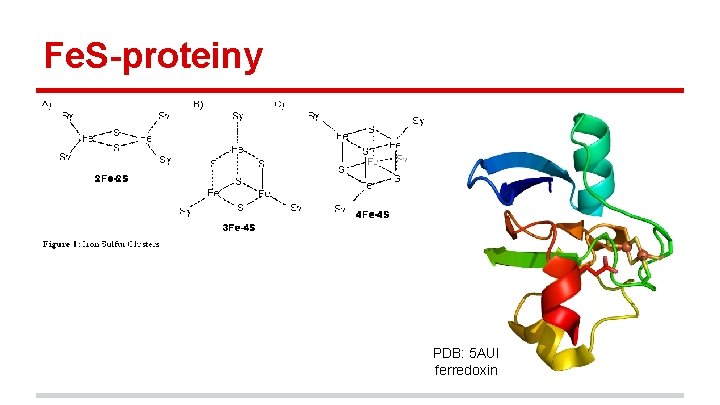
Fe. S-proteiny PDB: 5 AUI ferredoxin
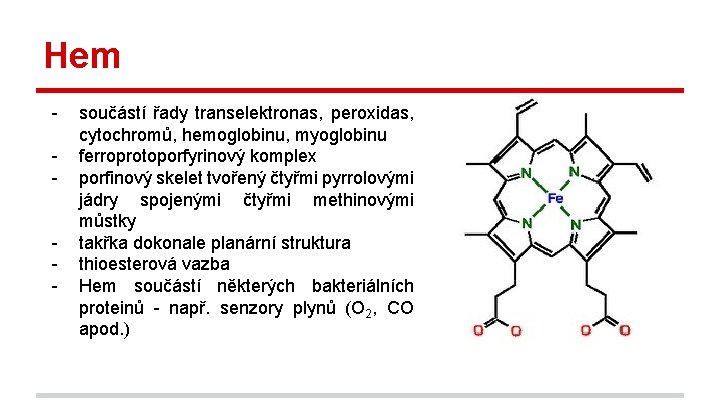
Hem - součástí řady transelektronas, peroxidas, cytochromů, hemoglobinu, myoglobinu ferroprotoporfyrinový komplex porfinový skelet tvořený čtyřmi pyrrolovými jádry spojenými čtyřmi methinovými můstky takřka dokonale planární struktura thioesterová vazba Hem součástí některých bakteriálních proteinů - např. senzory plynů (O 2, CO apod. )
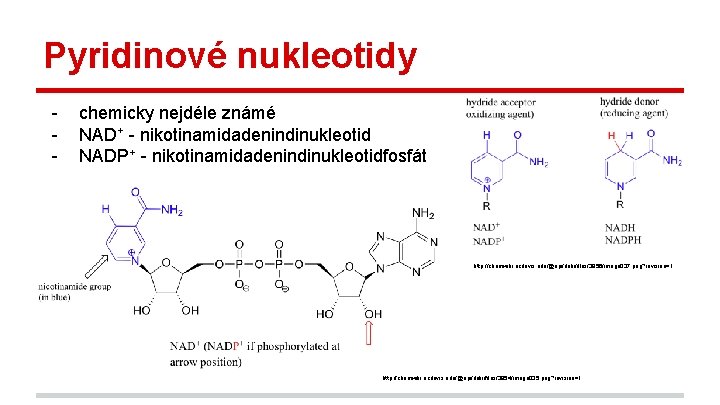
Pyridinové nukleotidy - chemicky nejdéle známé NAD+ - nikotinamidadenindinukleotid NADP+ - nikotinamidadenindinukleotidfosfát http: //chemwiki. ucdavis. edu/@api/deki/files/3956/image 037. png? revision=1 http: //chemwiki. ucdavis. edu/@api/deki/files/3954/image 035. png? revision=1
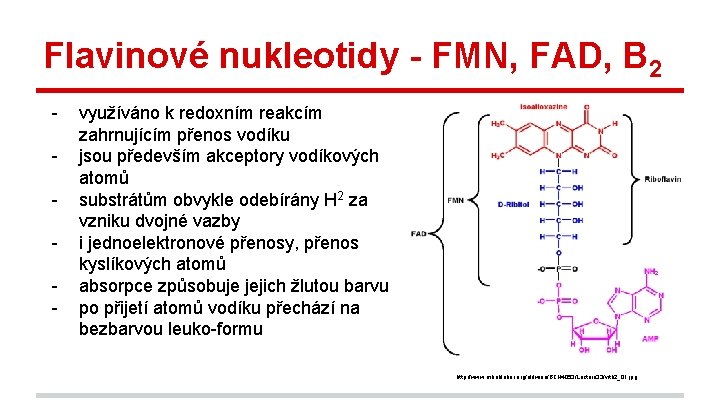
Flavinové nukleotidy - FMN, FAD, B 2 - využíváno k redoxním reakcím zahrnujícím přenos vodíku jsou především akceptory vodíkových atomů substrátům obvykle odebírány H 2 za vzniku dvojné vazby i jednoelektronové přenosy, přenos kyslíkových atomů absorpce způsobuje jejich žlutou barvu po přijetí atomů vodíku přechází na bezbarvou leuko-formu http: //www. mikeblaber. org/oldwine/BCH 4053/Lecture 33/vitb 2_01. jpg

Strukturní studie enzymů - často globulární proteiny - obecně vyšší pravděpodobnost krystalizace rychlost reakce příliš vysoká ve srovnání s rychlostí difrakčního experimentu enzymy mohou být krystalizovány v jiném než fyziologickém p. H! biotechnologické proteiny se často mohou sekvenčně lišit od svých přirozených forem obtížné pozorování struktury komplexu enzymu se substrátem či produktem cílem strukturních studií často i neaktivní mutovaná forma k plnému pochopení funkce enzymu je často třeba znát strukturu komplexu enzymu s inhibitorem
- Slides: 40