ZELTLERN FZKSEL ZELLKLER Copyright The Mc GrawHill Companies














- Slides: 26

ÇÖZELTİLERİN FİZİKSEL ÖZELLİKLERİ Copyright © The Mc. Graw-Hill Companies, Inc. Permission required for reproduction or display.

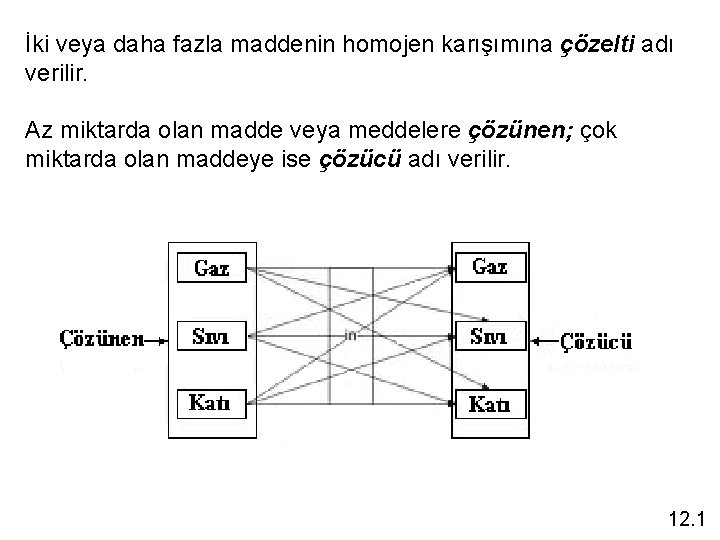
İki veya daha fazla maddenin homojen karışımına çözelti adı verilir. Az miktarda olan madde veya meddelere çözünen; çok miktarda olan maddeye ise çözücü adı verilir. 12. 1


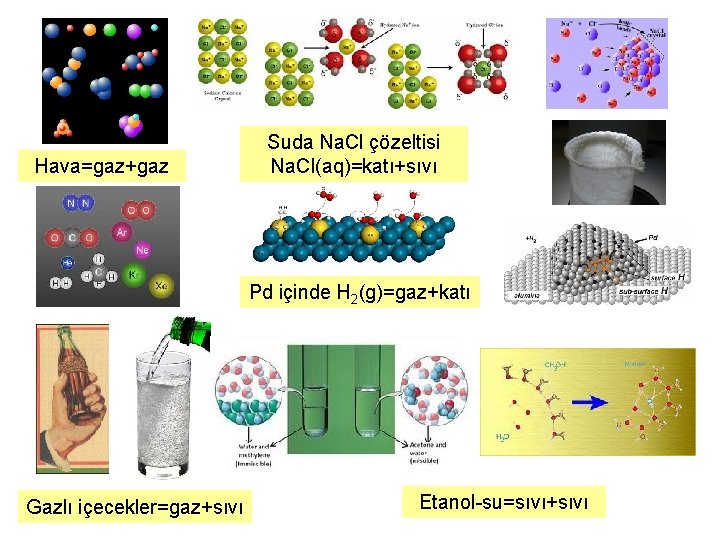
Hava=gaz+gaz Suda Na. Cl çözeltisi Na. Cl(aq)=katı+sıvı Pd içinde H 2(g)=gaz+katı Gazlı içecekler=gaz+sıvı Etanol-su=sıvı+sıvı

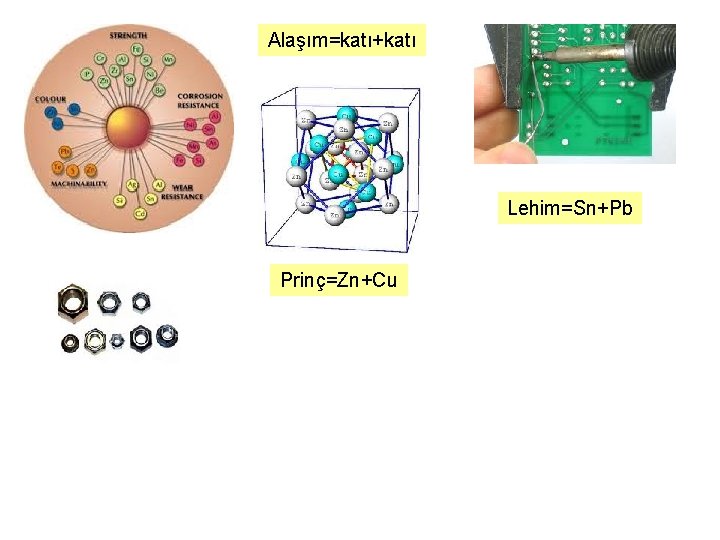
Alaşım=katı+katı Lehim=Sn+Pb Prinç=Zn+Cu

Bir çözücünün belirli bir sıcaklıkta çözebildiği en yüksek miktarda çözünen içeren çözeltilere doymuş çözelti adı verilir. Çözücünün belirli bir sıcaklıkta çözebildiği max. miktardaki çözünenden daha azını içeren çözeltilere doymamış çözelti adı verilir. Bir çözelti belirli bir sıcaklıkta çözülebilen max. miktardan daha fazla çözünen içeriyorsa bu çözelti de aşırı doymuş çözelti olarak adlandırılır. Sodyum asetatın aşırı doymuş çözeltisine bir çekirdek kristal Eklendiğinde bu çekirdek etrafında hızla kristallenme başlar. 12. 1


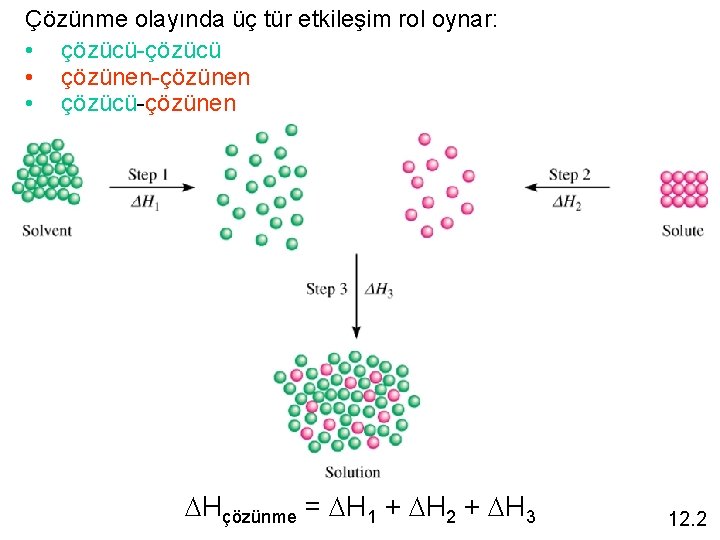
Çözünme olayında üç tür etkileşim rol oynar: • çözücü-çözücü • çözünen-çözünen • çözücü-çözünen DHçözünme = DH 1 + DH 2 + DH 3 12. 2

SIMILLIA SIMILIBUS SOLVUNTUR (Benzer benzeri çözer) Benzer moleküllerarası kuvvetlere sahip olan iki madde birbiriiçinde kolayca çözünür. • • • non-polar moleküler non-polar çözücülerde CCl 4 , C 6 H 6 de polar moleküller polar çözücülerde C 2 H 5 OH , H 2 O de İyonik bileşikler polar çözücülerde Na. Cl , H 2 O veya NH 3 de 12. 2

Seyrelme M 1 V 1 = M 2 V 2

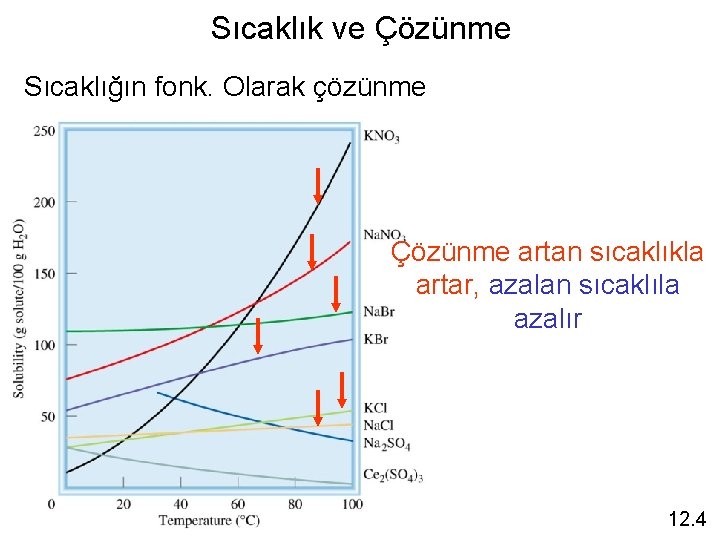
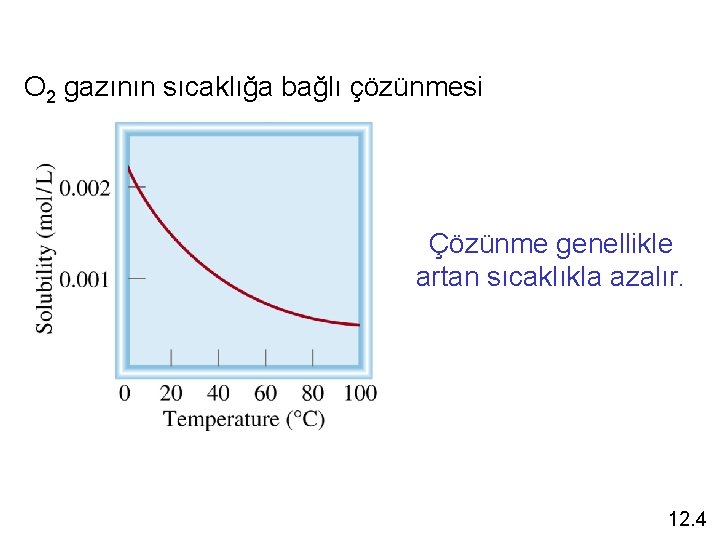
Sıcaklık ve Çözünme Sıcaklığın fonk. Olarak çözünme Çözünme artan sıcaklıkla artar, azalan sıcaklıla azalır 12. 4

O 2 gazının sıcaklığa bağlı çözünmesi Çözünme genellikle artan sıcaklıkla azalır. 12. 4

KONSATRASYON BİRİMLERİ Bir çözeltinin konsantrasyonu çözücü yada çözeltide bulunan madde miktarıdır. Kütlece Yüzde % Yüzde = çözünen kütlesi x 100% Çözünen kütlesi + çözücü kütlesi Çözücü kütlesi x 100% = Çözeltinin kütlesi Mol Fraksiyonu (X) A nın mol sayısı XA = Tüm bileşenlerin mol sayılarının toplamı 12. 3

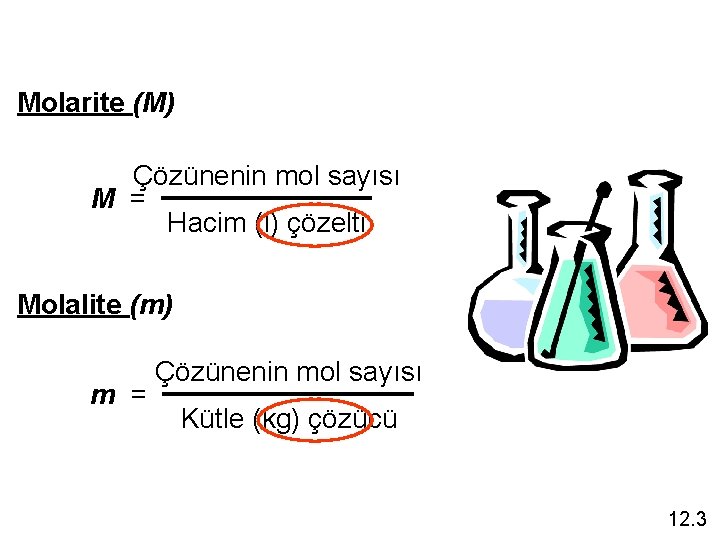
Molarite (M) Çözünenin mol sayısı M = Hacim (l) çözelti Molalite (m) m = Çözünenin mol sayısı Kütle (kg) çözücü 12. 3

ÖRNEK: Yoğunluğu 0, 927 g/m. L olan 5, 86 M etanol (C 2 H 5 OH, MA = 46 g/mol) çözeltisinin molalitesini hesaplayınız m = Çözünenin mol sayısı Çözücü kütlesi (kg) Çözünenin mol sayısı M = Çözelti Hacmi (l) 1 L çözelti için: 5, 86 mol etanol = 270 g (5, 86 x 46) dır. 927 g çözelti (1000 m. L x 0. 927 g/m. L) mass of solvent = mass of solution – mass of solute = 927 g – 270 g = 657 g = 0. 657 kg Çözünenin mol sayısı 5. 86 mol C 2 H 5 OH = m = 0, 657 kg çözücü Çözücü kütlesi (kg) = 8. 92 m 12. 3

Elektrolit Olmayan Çözeltilerin Koligatif (Sayısal) Özellikleri Koligatif Özellikler çözünen maddenin doğasından bağımsız olarak yalnızca çözeltideki madde miktarına dayanan özelliklerdir. Buhar-basıncı azalması P 1 = X 1 P 0 1 Raoult Kanunu P 10 = saf çözücünün buhar basıncı X 1 = çözücünün mol fraksiyonu Çözeltide yalnızca bir çözünen varsa: X 1 = 1 – X 2 P 10 - P 1 = DP = X 2 P 10 X 2 = çözünenin mol fraksiyonu 12. 6

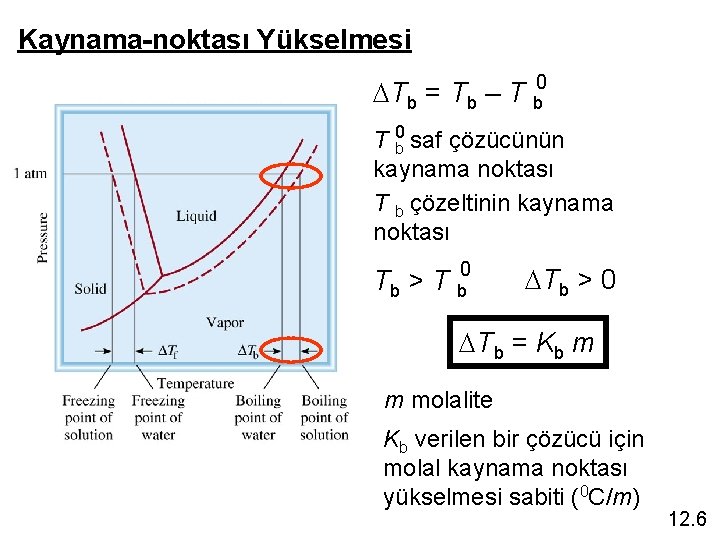
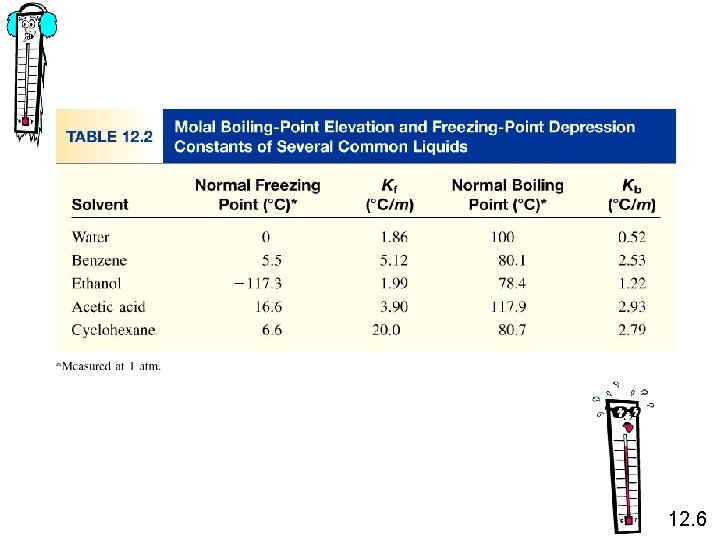
Kaynama-noktası Yükselmesi DTb = Tb – T b 0 saf çözücünün kaynama noktası T b çözeltinin kaynama noktası Tb > T b 0 DTb > 0 DTb = Kb m m molalite Kb verilen bir çözücü için molal kaynama noktası yükselmesi sabiti (0 C/m) 12. 6

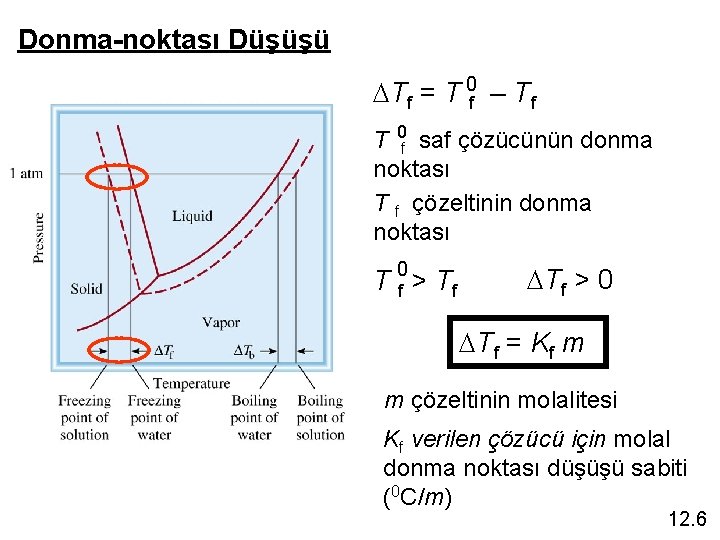
Donma-noktası Düşüşü DTf = T 0 f – Tf T 0 f saf çözücünün donma noktası T f çözeltinin donma noktası T 0 f > Tf DTf > 0 DTf = Kf m m çözeltinin molalitesi Kf verilen çözücü için molal donma noktası düşüşü sabiti (0 C/m) 12. 6

12. 6

ÖRNEK: 478 g etilen glikol (MA 62, 01 g/mol) içeren 3202 g of suyun donma noktasını bulunuz. DTf = Kf m Kf su = 1. 86 0 C/m Çözünenin mol sayısı = m = Çözücü kütlesi (kg) 478 g x 1 mol 62, 01 g = 2. 41 m 3, 202 kg çözüsü (Su) DTf = Kf m = 1. 86 0 C/m x 2. 41 m = 4. 48 0 C DTf = T 0 f – Tf Tf = T 0 f – DTf = 0. 00 0 C – 4. 48 0 C = -4. 48 0 C 12. 6

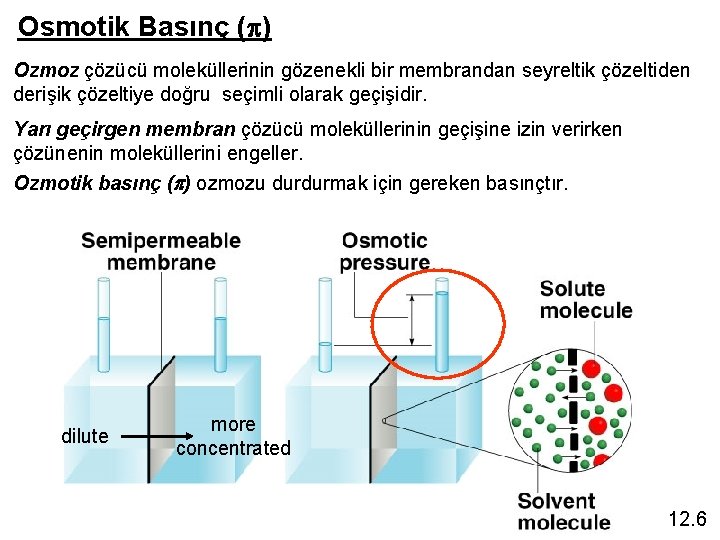
Osmotik Basınç (p) Ozmoz çözücü moleküllerinin gözenekli bir membrandan seyreltik çözeltiden derişik çözeltiye doğru seçimli olarak geçişidir. Yarı geçirgen membran çözücü moleküllerinin geçişine izin verirken çözünenin moleküllerini engeller. Ozmotik basınç (p) ozmozu durdurmak için gereken basınçtır. dilute more concentrated 12. 6

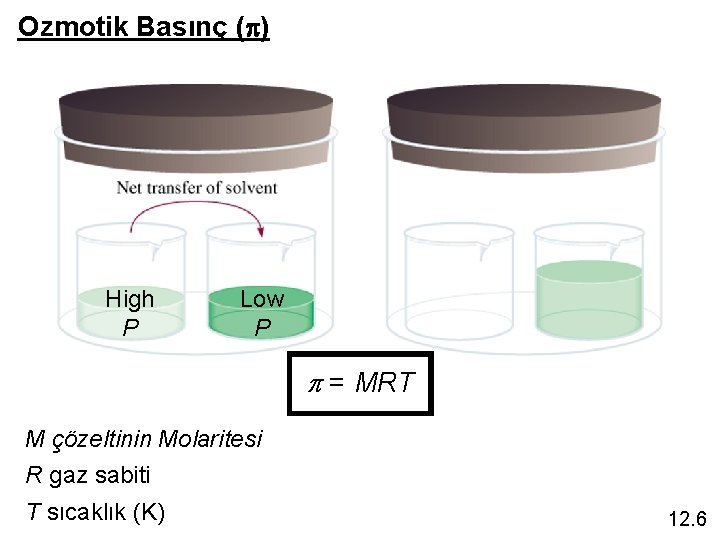
Ozmotik Basınç (p) High P Low P p = MRT M çözeltinin Molaritesi R gaz sabiti T sıcaklık (K) 12. 6

Elektrolit Çözeltilerin Koligatif Özellikleri 0. 1 m Na. Cl çözeltisi 0. 1 m Na+ iyonu ve 0. 1 m Cl– iyonu Koligatif Özellikler çözünen maddenin doğasından bağımsız olarak yalnızca çözeltideki madde miktarına dayanan özelliklerdir. 0. 1 m Na. Cl çözelti 0. 2 m iyon Çözünmenin ardından çözeltideki gerçek madde mik van’t Hoff faktorü (i) = Başlangıçta çözeltideki madde miktarı i should be nonelectrolytes Na. Cl Ca. Cl 2 1 2 3 12. 7

Colligative Properties of Electrolyte Solutions Boiling-Point Elevation DTb = i Kb m Freezing-Point Depression DTf = i Kf m Osmotic Pressure (p) p = i. MRT 12. 7

Kolloid bir maddenin yayıcı ortam olan diğer bir madde içerisinde partiküller halinde dağılmasıyla oluşur. Partiküller süspande olacak kadar küçük ışığı yayacak kadar büyük olmalıdır. (Tyndall etkisi). Kolloid vs. çözelti • kollodial partikülleri çözünen moleküllerinden daha büyüktür. • kollodial süspansyon homojen bir çözelti değildir 12. 8

 Mc grawhill
Mc grawhill Grawhill
Grawhill Grawhill
Grawhill Single user multitasking os
Single user multitasking os Grawhill
Grawhill Grawhill
Grawhill Grawhill
Grawhill Mc grawhill
Mc grawhill Grawhill
Grawhill Dot
Dot Bổ thể
Bổ thể Vẽ hình chiếu đứng bằng cạnh của vật thể
Vẽ hình chiếu đứng bằng cạnh của vật thể độ dài liên kết
độ dài liên kết Môn thể thao bắt đầu bằng chữ đua
Môn thể thao bắt đầu bằng chữ đua Thiếu nhi thế giới liên hoan
Thiếu nhi thế giới liên hoan Khi nào hổ mẹ dạy hổ con săn mồi
Khi nào hổ mẹ dạy hổ con săn mồi điện thế nghỉ
điện thế nghỉ Một số thể thơ truyền thống
Một số thể thơ truyền thống Biện pháp chống mỏi cơ
Biện pháp chống mỏi cơ Trời xanh đây là của chúng ta thể thơ
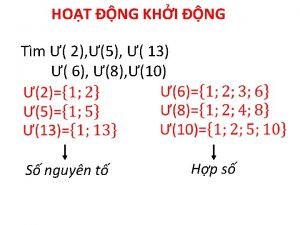
Trời xanh đây là của chúng ta thể thơ Số nguyên tố là gì
Số nguyên tố là gì Tỉ lệ cơ thể trẻ em
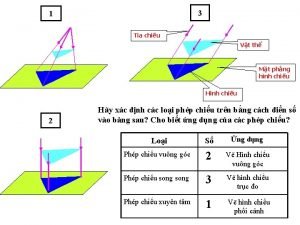
Tỉ lệ cơ thể trẻ em Tia chieu sa te
Tia chieu sa te Các châu lục và đại dương trên thế giới
Các châu lục và đại dương trên thế giới Thế nào là hệ số cao nhất
Thế nào là hệ số cao nhất Hệ hô hấp
Hệ hô hấp Tư thế ngồi viết
Tư thế ngồi viết