ZELTLER n ki yada daha ok komponentten olumu























































































































- Slides: 120

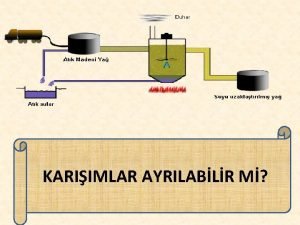
ÇÖZELTİLER n İki yada daha çok komponentten oluşmuş homojen karışımlara çözeltiler adı verilir. n Bir komponent diğerinden daha fazla miktarlarda bulunursa, bu komponente çözücü (dispersiyon ortamı, solvent) adı verilir.

n Komponentlerden az olana çözünen (disperz faz) adı verilir. n Bir çözücü içerisinde birden fazla çözünen bulunabilir.

n Çözücüler; n A) Polar n B) Apolar (+ veya – karakter göstermeyen, hiçbir madde tarafından çekilmeyen) n En iyi polar çözücü sudur.

n -OH, -OR n -NR 2 , - NR 3 n -COOH, -COO- n Karbontetraklorür ya da benzol gibi apolar çözücülerde hidrokarbonlar gibi hidrofobik (suyu kabul etmeyen) maddeler çözünürler. Bu tür maddeler yağlar içinde çok iyi çözündüklerinden lipofilik maddeler olarak da isimlendirilirler.

n Polar çözücülerde, tuzlar ve hidrofilik gruplara sahip organik bileşikler gibi polar bir kuruluşa sahip olan maddeler en iyi şekilde çözünürler.

Dispers Sistemler n Gerçek çözeltiler: Disperz faz partiküllerinin çapı 3 nm’den küçüktür. n Kolloidal çözeltiler: Disperz faz partiküllerinin çapı 3 nm’den büyüktür. n Süspansiyonlar: Disperz faz partiküllerinin çapı 100 nm’den büyüktür.

ÇÖZELTİLERİN ÖZELLİKLERİ n 1. Homojen karışımlardır. n 2. Saydam ve berrak görünürler. n 3. Asit baz ve Tuz gibi iyonik maddelerle hazırlanmış sulu çözeltiler elektrik akımını iletir.

n Elektrik akımını ileten çözeltilere ELEKTROLİT ÇÖZELTİ denir. Elektrik akımını ileten metallere ELEKTROT denir.

HİDRATASYON (SOLVATASYON) Katı bir maddenin çözünmesinde kristalin yapı taşları birbirlerinden ayrılırlar ve çözücüye taşınırlar. Bu sırada bu yapı taşları solvent molekülleri tarafından sarılırlar, bir başka deyişle solvatize edilirler. Çözücü olarak kullanılıyorsa bu olay hidratasyon adını alır. su

Bir başka ifadeyle; n İyonik bileşikler polar sıvılarda çok iyi çözünürler. Çünkü polar çözücü molekülleri, bileşikteki zıt yüklü iyonları iyon-dipol çekim kuvvetleri ile çekerek iyonun etrafını çözücü molekülleri ile sararlar. Bu tür iyonlara solvatize iyonlar adı verilir.

n Bir maddenin suda çözülmesinde hareketli katyonlar ve anyonlar oluşur ve her iki iyon türü de su molekülleri karşısında ters bir yerleşim gösterirler. n Çıplak halde bir katyonun solvent molekülü ile sarılmasında oldukça dikkat çekici bir miktarda enerji serbest bırakılır. Bu enerjiye solvatasyon enerjisi adı verilir.

n Anyon ve katyonların solvatasyon enerjilerinin toplamı kristal yapının çözülmesi için gerekli olan enerji miktarından büyükse çözülme işlemi sırasında çözeltinin ısısı yükselir. n Bir iyon ne kadar küçükse ve yükü ne kadar büyükse o derecede kuvvetli olarak solvatize edilir.

n Solventin polaritesinin düşmesi ve ısının yükselmesi ile solvatasyon azalır, solvent boşluğunda bulunan molekül sayısıda daha az olur. n Solvent boşluğunun büyük olması, solvent boşluğunun çapının büyümesine ve hidratize edilmiş parçacıkların hareketlerinin azalmasına neden olur.

n Porları küçük olan zarlardan parçacıkların geçişi de engellenir. Bu olay hücre zarından madde transportunda önem kazanır.

• Bir çözelti çözücüden daha düşük buhar basıncına sahip olduğundan daha yüksek ısı derecelerinde kaynar. • Bir çözücünün kaynama noktası yükselmesi çözücüde çözünen parçacıkların (iyon yada molekül) sayısı ile doğru orantılıdır. • Aynı durum donma noktası düşmesi içinde geçerlidir. Bir çözelti saf çözücüye göre daha düşük ısılarda donar.

Bileşenlerin Fiziksel Haline Göre n Çözücü / Çözünen Katı-Sıvı çözeltileri: Tuzlu su Katı-Katı çözeltileri: Alaşımlardır. Çelik, C ve Fe karışım Katı-Gaz çözeltileri : iyot buharı ve hava karışımı

Sıvı-Sıvı çözeltileri: Sirke, asetik asit ve tuz karışımı Sıvı-Katı çözeltileri: Amalgam; civa ve gümüş karışımı Sıvı-Gaz çözeltileri: Su buharı ve hava karışımı

n Gaz-Gaz çözeltileri: Hava n Gaz-Sıvı çözeltileri: Gazoz ; CO 2 ve su karışımı n Gaz-Katı: Hidrojen ve paladyum karışımı

Çözünenin miktarına göre n Seyreltik çözelti: Çözünen miktarının çözücünün miktarına göre az olduğu çözeltilerdir. n Derişik çözelti: Fazla miktarda çözünmüş madde içeren çözeltilerdir.

Çözünenin çözünürlüğüne göre 1 - Doymamış çözelti: Belirli bir sıcaklıkta çözebileceği miktardan daha az çözünen bulunduran çözeltilerdir. 2 - Doymuş çözelti: İçerisinde daha fazla madde çözünemeyen çözeltilerdir. 3 - Aşırı doymuş çözelti: Çözünebileceğinden daha fazla çözünen bulunduran çözeltilerdir.

Elektrik iletkenliğine göre; n Elektrolit çözelti: Sulu çözeltisi elektrik akımını ileten çözeltilerdir (Tuzlu su). n Elektrolit olmayan çözelti: Sulu çözeltisi elektrik akımını iletmeyen çözeltilerdir (şekerli su).

Çözüneni uçucu olmayan sıvı çözeltilerde a) Çözeltinin kaynama noktası saf çözücünün kaynama noktasından yüksektir. b) Çözeltinin donma noktası, saf çözücünün donma noktasından düşüktür. c) Çözeltinin buhar basıncı, saf çözücünün buhar basıncından düşüktür.

Çözüneni uçucu olmayan sıvı çözeltilerde çözünen madde miktarı (Derişim) arttıkça a) Kaynama noktası yükselir. b) Donma noktası düşer. c) Buhar basıncı düşer.

Bir maddenin elektrik akımını iletebilmesi için; a) Serbest halde elektronu olmalıdır. Bu olay metallerde vardır. b) Yapısında Anyon (-) ve Katyon (+) bulunmalıdır. c) Bileşikler katı halde elektriği iletmezler. Sıvı halde ve çözeltilerinde, iyonik bileşikler elektrik akımını iletir.

d) Bir çözeltide iyon sayısı arttıkça, ya da sıcaklık arttıkça çözeltinin iletkenliği artar (Endotermik çözünmelerde). e) Metallerin elektrik iletkenliği elektron akışı ile olur (Ötelenme hareketi), olay fizikseldir. f) Bileşiklerin sulu çözeltilerinin elektrik iletkenliği kimyasal yollarla olur. g) Suda moleküller halde çözünen (ağ örgülü) maddelerin çözeltileri elektrik akımını iletmez.


ASİTLER ve BAZLAR Brönsted’e göre asitler sulu ortamlarda H iyonları veren maddelerdir. Bazlar ise sulu ortamlarda H iyonları alan maddelerdir. Asit Baz + H+

NH 3 + H 2 O NH 4 + + OHBurada NH 3 bir bazdır. Çünkü sudan proton almıştır. H 2 O, bir asittir. Çünkü H+ vermiştir. Öte yandan bu bir denge tepkimesidir. Sol yöne olan tepkime düşünülürse NH 4+ iyonu bir proton vericisi, OH- ise bir proton alıcısıdır. Dolayısıyla NH 4+ iyonu bir asit, OH- ise bir bazdır.

Bir başka deyişle tepkimede 2 asit ve 2 baz vardır. Her asit bir baz ile çifttir. Bunlara ‘’ Eşlenik Çiftler’’veya ‘’ Konjuge çiftler’’ denir. Mesela NH 4+ iyonu NH 3 bazın konjuge asidi; NH 3 ise NH 4+ iyonunun (asitinin) konjuge bazıdır. NH 3 + H 2 O NH 4 + + OH (NH 3 örneğinde su bir asit iken burada bir bazdır).

Bir asit ortamda akseptör olarak bir bazın varlığında H’lerini (protonlarını) verebilir. Bir HA asidi protonunu bir B bazına verirse; Toplam HA H++A- B+H BH+ HA+B BH++A- A-, HA’nın konjuge bazıdır. HA ise A-’nın konjuge asididir.

Asitlere özgü ortak özellikler: Ø Yapılarında H iyonu vardır. Ø Aktif metallerle birleşince H 2 gazı verir. Ø Mavi turnusolu kırmızıya çevirirler. Ø Seyreltik çözeltilerinin tadı ekşidir.

v Bazlara özgü ortak özellikler: v Yapılarında OH iyonu vardır. v Asitlerle birleşince tuz oluşturur. v Kırmızı turnusolu maviye çevirirler. v Seyreltik çözeltilerinin tadı acıdır.

Su ile Asit Baz Reaksiyonları n Elektrolit: Bir sıvı içerisinde elektriksel yükü ileten maddelere denir. n Elektrolitler polar çözücülerde elektrik akımını iletirler. n Elektriksel alanda pozitif yüklü iyonlar katoda göçtüklerinden katyon, negatif yüklü parçacıklar anoda göçtüklerinden anyon olarak isimlendirilir.

Gerçek elektrolitler: Kafes yapılarında bu iyonları içerirler. (Na+Cl-)n (kristalize) n. Na(su) + n. Cl-(su) Potansiyel elektrolitler: Çözücü ile olan reaksiyonlarında iyonlar oluştururlar. Örn: HCl

R-COOH H 2 O H+(su) + R-COO-(su) Suda bir maddenin çözeltilmesinde serbest hareket edebilir solvatize iyonların oluşumu elektrolitik dissasiasyon olarak tanımlanır.

n Kuvvetli elektrolitler, suda tamamıyla dissosiye (iyonize) olan elektrolitlerdir. (Na. Cl) n Zayıf elektrolitlerde dissosiyasyon çok azdır. (R-COOH) n Kuvvetli asitler: Sulu çözeltilerinde ortama H+ iyonu verirler. n Kuvvetli bazlar: Sulu çözeltilerinde ortamdan H+ iyonu alırlar.

Suda çözündüklerinde büyük oranda iyonize olan asitler kuvvetli asitlerdir (Ka değerleri büyük, p. Ka değerleri küçük). Suda çözündüklerinde az miktarda iyonize olan asitler zayıf asitlerdir (Ka değerleri küçük, p. Ka değerleri büyük).


PROTOLİZ H+ iyonunun su üzerinde taşınması Bir madde birden fazla dissosiye olabilir protona sahipse protoliz olayı ardarda olur. H 3 PO 4 H 2 PO 4 HPO 4 -- H 2 PO 4 - + H+ (primer fosfat) HPO 4 -- + H+ (sekunder fosfat) PO 4 -- + H+ (tersiyer fosfat)

Tuzların suda çözeltilmelerinde protoliz • Zayıf asitlerin tuzları alkali reaksiyon verirler. Çünkü anyonlar su ile OH- iyonları oluşturarak reaksiyon verirler. Örn: Sodyum karbonat CO 3 -- + H 2 O HCO 3 - + OH- • Zayıf bazların tuzlarının sulu çözeltileri ise katyonların su ile H+ iyonları oluşturması nedeniyle asidiktirler. NH 4+ + H 2 O NH 3 + H 3 O

Suyun Otoprotolizi, p. H ve p. OH değerleri Su hem bir proton vericisi hem de bir proton alıcısı olarak görev yapar. Bu nedenle su bir amfolittir ve amfoter yapıya sahiptir. Suyun amfolit yapısı saf su içinde oluşan otoprotolizle de ortaya konabilir. Saf sudaki otoprotoliz olayında bir su molekülünün H+ iyonu bir başka su molekülüne taşınır. H 2 O H + +OH - asit baz H + + H 2 O H 3 O+ asit baz

Aynı bileşiğin iki molekülü arasındaki protolize oto protoliz denir. Suyun oto protoliz dengesi; H 2 O + H 2 O OH + H 3 O+ A 1 B 2 B 1 A 2

H 2 O H++ H 2 O 2 H 2 O H+ + OH H 3 O+ + OH- iyonları konsantrasyonu H+ iyonları konsantrasyonuna eşittir. H 2 O H++OH-


p. H Değerinin Tıptaki Önemi n Kanın normal p. H değerinin asit yöne kayması asidoz, alkali yöne kayması ise alkaloz olarak tanımlanır. n Vücutta bir dizi fonksiyon p. H değeri tarafından etkilenir. ¨ Hemoglobinin oksijen bağlama yeteneği, ¨ Protein yükleri ve protein molekülleri arasındaki hidrojen köprüleri, ¨ Kemik yapımı ve yıkımı

Hem asitlerle hem de bazlarla tuzlar oluşturabilen maddelere amfolitler ya da amfoter elektrolitler denir. Özellikleri; 1 -Asit ortamda katyonlar alkalik ortamda ise anyonlar oluştururlar. 2 -Bir amfolit belirli p. H’da aynı sayıda negatif ve pozitif yük taşırlar. Bu p. H’ya amfolitin izoelektrik noktası denir. 3 -Bir amfolit asit reaksiyonda katoda, alkali reaksiyonda anoda göç ettiği halde izoelektrik noktada hareket etmez.


4 -Amfolitler ortamın p. H’sına göre hem H+ iyonlarını, hem de OH+ iyonlarını bağlayabilirler. Bu nedenle amfolitler gerek asitlere karşı gerekse bazlara karşı tampon görevi görürler. H+ + OH- iyonlarının konsantrasyonlarının birbirlerine eşit olduğu noktaya nötral nokta adı verilir. H+ + OH- iyonlarının konsantrasyonları birbirleri ile ters orantılıdır. 25 o. C‘ deki saf suda H+ ve OH-in molar konsantrasyonu eşittir ve çözelti nötraldir.

İNDİKATÖRLER Çözeltinin p. H’sına bağlı olarak renk değiştiren kompleks yapıdaki organik bileşiklere indikatör denir. Bu tür çözeltiler titrasyonun bitiş noktasını saptamak amacıyla kullanılır. İndikatörleri asit baz, redoks ve çöktürme indikatörleri olarak ayırabiliriz.

Asit- Baz İndikatörleri n Asit Baz indikatörleri zayıf asit veya zayıf bazdırlar. Genelde indikatörle HIn sembolü ile gösterilirler. Bu indikatörlerin ayrışma tepkimeleri yazılacak olursa; Kırmızı n Mavi Örneğin metil kırmızısı [HIn] formundayken kırmızı, dissosiye olduktan sonra [In- ] formunda ise mavi renktedir.

Çeşitli indikatörlerin asit ve alkali ortamlardaki renk değiştirdikleri p. H sınırları ve çözeltilerinin hazırlanışı.

n İndikatörün renk değiştirdiği noktaya dönüm noktası denir.

n Sulu çözeltilerin p. H’ı, elektrometrik yöntemler denen, iki elektrot arasındaki potansiyel farkının bir galvanometre ile ölçülmesi esasına dayanan yöntemlerle daha hassas olarak ölçülebilir. n p. H metre denen aletlerde elektrottan çıkan sinyal, şiddetlendirilir ve p. H’ı bilinen bir çözelti tarafından oluşturulan sinyal ile karşılaştırılır.

Nötralizasyon n Bir asitle bir bazın reaksiyona sokulmasına nötralizasyon adı verilir. HCl+Na. OH n Aynı normaliteye sahip asit ve bazların eşit hacimleri birbirleri ile reaksiyona girerler. n Asit ve bazların titrasyonlarında kullanılırlar.


Tamponlar n Zayıf bir asit (proton donörü) ve onun konjuge bazını (proton akseptörü) eşit miktarlarda içeren karışımlar tampon sistemi olarak bilinirler. n Tamponlar, küçük miktarlarda asit (H+) veya baz (OH ) eklendiğinde p. H değişikliklerine karşı koyma eğiliminde olan sulu sistemlerdir.


n p. H, zayıf asit ile onun konjuge bazının bir karışımının tamponlama etkisi ve zayıf asidin p. Ka’sı arasındaki kantitatif ilişki, Henderson-Hasselbalch denklemi ile ifade edilir.

n Henderson-Hasselbalch denklemi, her hangi bir p. H’da proton donör ve proton akseptörün molar oranını hesaplamaya yarar. n Örneğin; asetik asidin p. Ka değeri 4, 76 olduğuna göre asetat ve asetik asitten p. H’ı 5, 30 olan asetat tamponu hazırlamak için gerekli asetat ve asetik asidin molar konsantrasyon oranı:

Henderson-Hasselbalch denklemi, verilen bir p. Ka ve molar orana göre bir asit-baz çiftinin p. H’ını hesaplamaya yarar.

İdeal bir tampon şu özellikleri taşımalıdır: 1) Arzu edilen p. H sınırlarına uygun tampon kapasitesine sahip olmalıdır. 2) Çok saf olarak elde edilebilmelidir. 3) Enzimatik ve hidrolitik olaylara dayanıklı olmalıdır. 4) Tamponun oluşturacağı p. H, ortamın ısısı, iyon içeriği ve konsantrasyonundan en az derecede etkilenmelidir.

5) Toksik ve inhibitör etki taşımamalıdır (Çoğu enzimler fosfat tamponlarınca inhibe edilirler). 6) Katyonlar ile yaptığı kompleksler çözünür nitelikte olmalıdır. 7) Ultraviyole ve görünür sahada ışığı absorbe etmemelidir.

Tampon Kapasitesi 1) Zayıf asit ile konjuge bazının eşit molar karışımı maksimal tampon kapasitesine sahiptir ve tamponun etki sahası p. H=p. K asit ± 1’dir. 2) Bir sistemin p. H değeri asit ve konjuge bazının molar konsantrasyonlarının oranına bağlıdır. Bu nedenle çözeltinin seyreltilmesi p. H değişimine yol açmaz.

3) Zayıf asit ile konjuge bazının molar konsantrasyonlarının bilinmesi ile çözeltinin p. H değeri hesaplanabilir. 4) Zayıf asit ile konjuge bazının molar konsantrasyonlarının yükselmesi ile tamponun kapasitesi yükselir.

Redoks Olayı Parçacıkların (atom, molekül ya da iyonlar) elektron aldıkları olaylara redüksiyon, elektron verdikleri olaylara ise oksidasyon adı verilir. Elektron alan bir parçacık elektronu bir başka parçacıktan alabilir. Bu nedenle redüksiyon ve oksidasyon olayları birbirlerine bağlı olarak oluşurlar (Redoks olayı).

n Eskiden redoks olayları yanma, bu olay metaller üzerinde gerçekleşirse paslanma olarak isimlendirilmekteydi. Yine aynı şekilde insan ve hayvan organizmasında redoks olayı, gıda maddelerinin yavaş yanması olarak tanımlanmıştır.

n Konjuge redoks çifti: Redüksiyon oksidasyon+nene-+oksidasyon vasıtası redüksiyon 5 e-+Mn. O 4+8 H+ Mn+++H 2 O

n Tanımlar Anlamı ve örnek Redüksiyon Elektron alınması (oksidasyon sayısında azalma) Cl+e- Cl-1 Oksidasyon Elektron verilmesi (oksidasyon sayısının yükselmesi) Na 0 Na+1+e. Redoks olayı Elektron taşınması (aktarılması) Na 0 +Clo Na+1 Cl -1 Redüksiyon vasıtası Oksidasyon vasıtası Redoks çifti (konjuge) Elektron vericisi Burada Na 0 Elektron alıcısı Burada Clo Red Oks+ne-

Redoks Olaylarının Biyokimyasal Önemi n Hayatın sürekliliği gıdalardan kazanılan kimyasal enerjinin diğer enerji formlarına dönüştürülmesi ile sağlanır. n Bu dönüşümler gıda maddelerinin oksidasyonu ile sağlanır. n Dönüşüm mitokondriyumlarda gerçekleşir.

n En önemli oksidasyon vasıtası oksijendir. n Kömür ya da petrol gibi fosil yakıtların yanmaları sırasında S’lü bileşiklerden SO 2 oluşur. n SO 2 havadaki nem ile karşılaştığında H 2 SO 3 oluşturur. n Hidrojen sülfür de oksitlenmeye devam ederek H 2 SO 4’e dönüşür.

n H 2 SO 4 binaların karbonatlı malzemeleri ile reaksiyon vererek bunların parçalanıp dağılmalarına yol açar. n Yağmur suları ile toprağa ulaşan H 2 SO 4 ağır metal iyonları ile suda çözünür kükürtlü bileşikleri oluşturur. Oluşan bu bileşikler birçok bitkinin kökleri için zararlıdır ve orman ölümlerine yol açar.

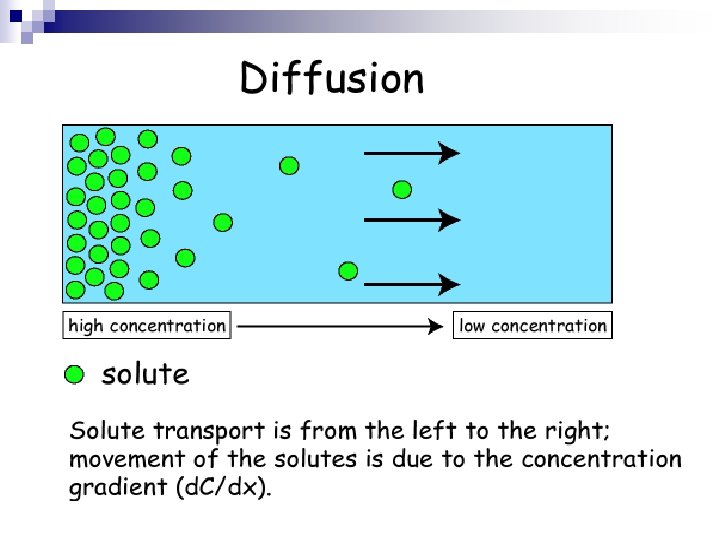
DİFFÜZYON n Moleküllerin eriyiğin her tarafında eşit olarak kendiliklerinden yayılması olayına diffüzyon denir. n Bu olayda parçacıklar küçüldükçe ve ısı arttıkça diffüzyonun hızı artar. n Diffüzyonda iki faz arasında herhangi bir zar yoktur. n Geçiş çok yoğun çözeltiden az yoğuna doğrudur.


Diffüzyonun Önemi • Diffüzyon organizmanın madde alışverişinde, • Oksijenin havadan kana ve kandan dokulara geçmesinde, • Besin maddelerinin kandan dokulara geçmesinde, • İlaçların enjekte edildikleri yayılmasında büyük rol oynar. yerde etrafa

Ozmoz ve Ozmotik Basınç n Suyun yarı geçirgen bir zarı geçerek çözeltiye katılmasına Ozmoz denir. n Düşük yoğunluktaki çözünmüş bir maddenin yüksek yoğunlukta çözünmüş bir maddeye ozmoz gösteren su veya bir çözücünün neden olduğu basınçtır.


n ÖNEMİ: İnsan ve hayvanlarda hücre içi ve hücre dışı sıvılarının ozmotik basınçları %0. 09’luk Na. Cl çözeltisinin ozmotik basıncına denktir. Hücreler ve kan hücreleri normal çalışmalarını bu ozmotik basınca yakın nötr ortamlarda sürdürürler.


Ø Hastalara verilen serumların ve damar içi enjeksiyonlarının daima bu ozmotik basınca sahip çözeltiler olması gerekir. Ø Göz ve burun boşlukları gibi narin membranların ilaçla tedavisinde su yerine serum fizyolojik kullanılması herhangi bir ağrı duyulmasını önler.

DİALİZ Sudan başka küçük ve basit moleküllerin veya iyonların geçmesine izin veren bir zar aracılığı ile büyük kompleks moleküllerin ayrılması olayıdır. ÖNEMİ: Laboratuvarlarda elektroforez tekniklerinin hazırlayıcı bir basamağı olarak kullanılır. Yapay böbrek cihazlarının prensibini oluşturur.

n Artık maddelerin vücuttan atılması kısmen bu olaya dayanır. Lab. da difteri ve tetanoz antitoksinleri, fazla elektrolitlerinden dializle atılır.

YÜZEY GERİLİMİ Yüzey gerilimi yüzeylerdeki dengelenmemiş intermoleküler çekim güçlerinden ileri gelen bir olaydır.

n Homojen bir sıvının iç molekülleri, çevrelerindeki moleküller tarafından, bütün yönlerden eşit olarak çekildikleri ve bu karşılıklı çekim güçleri birbirini dengelediği için, her yöne ve serbestçe hareket edebilirler.

Yüzeyde yer alan moleküllerde: bunlar yatay yönlerden yine karşılıklı olarak birbirini dengeleyen çekim güçlerinin etkisinde kalırlar ve yatay doğrultularda serbestçe yer değiştirebilirler. Düşey yönde etkileyen çekim güçleri ise dengelenemez. Çünkü, yukarı doğru hava moleküllerinin pek küçük olan çekimleri hesaba alınmazsa hemen hiçbir çekim gücü ile karşılaşmamaktadırlar. Bu nedenle iç moleküller gibi serbestçe hareket edemezler ve birarada tutularak adeta yüzeyde bir zar oluştururlar.

ÖNEMİ n Bir jilet yada bir toplu iğnenin su yüzeyine yavaşça bırakıldıklarında batmamaları, n Küçük böceklerin su yüzeyinden batmadan yürüyebilmeleri, n Suyun ince cam borularda ve süzgeç kağıdında,

n Gazın lamba fitilinde yükselmesi gibi olaylar yüzey gerilimi ile ilişkili görünümlerdir. n Yüzey gerilimini artıran maddeler: inorganik maddeler n Yüzey gerilimini azaltan maddeler: yağ, sabun, safra gibi organik maddeler

ADSORBSİYON • Yüzey gerilimi ile ilişkili bir olaydır. • Bir ortamda yer alan bütün yüzeylerde dengelenmemiş kuvvet alanları ve serbest valanslar bulunur. Bu yüzeyler diğer molekülleri kendilerine bağlayabilirler. Bu olaya adsorpsiyon adını veriyoruz.

n Adsorpsiyon yüzey genişliği ve adsorbe edici maddenin miktarıyla doğru orantılıdır, çevre ısısı ile ters orantılıdır. n Başka maddeleri yüzeylerinde tutma nitelikleri belirgin olan maddelere adsorban diyoruz. n Adsorpsiyona dayanan bazı yöntemler, karışımlardan belirli maddelerin ayrılması ve saflaştırılmasında çok kullanılır.

• Adsorbsiyon metotları biyokimyada çok kullanılmaktadır. • Büyük moleküllü ve renkli maddeler, hayvan kömürü ve diğer adsorbanlar tarafından adsorbe edilirler ve bu suretle çözeltilerden ayırt edilirler.

• İdrarın rengi, iyi bir adsorban madde olan hayvansal kömür ile çalkalanarak yok edilebilir. • Hormonlar ve enzimler Al 2 O 3 tarafından belirli p. H’da adsorbe edilirler ve p. H değiştiği zaman birbirinden ayrılabilirler.

Donnan Zar Dengesi ve Zar Potansiyeli n Bir kap bir zar ile ortadan ayrılır ve kabın her iki yanına elektrolit çözeltisi ilave edilirse, elektrolit çözeltisi zarın porlarını geçebiliyorsa kabın her iki yanına eşit konsantrasyonlarda dağılır.

Bu olayda denge; n K+=K+ ve Cl-=Cl- şeklindedir.

n Zarın ayırdığı boşluğun birisi Cl- iyonları yerine bir polianyon içerirse (örn; Poly 10 -), polianyonlar zarı geçemezler ve dengeli olmayan bir iyon dağılımı meydana gelir. n Öncelikle Cl- iyonları içermeyen I. No’lu boşluğa geçen Cl- iyonları K+ iyonları ile birlikte bir konsantrasyon dengesi oluştururlar.

n Bu dengede; n K+ II/ K+ I= Cl- I/ Cl-II şeklinde gösterilebilir. n (şekil) Bir iyon türü zarı geçemezse (örneğin, bir polianyon) eşit olmayan bir iyon dağılımı ortaya çıkar (Donnan zar dengesi).

n Canlı hücreleri protein içermeleri nedeniyle donnan zar dengesine göre ekstrasellüler boşluktan daha fazla iyon konsantrasyonuna sahiptirler. Örneğin, hücre içindeki H+ iyon konsantrasyonu hücre dışından daha yüksektir.

n Ayrıca yarı geçirgen bir zarın her iki yanındaki iyon konsantrasyonlarının farklı olması bir zar potansiyelinin oluşumuna yol açar.

ENERJİ FORMLARI / SİSTEMLER / DURUM DEĞİŞİMLERİ n Bir kimyasal reaksiyon sırasında enerji kullanılabilir, üretilebilir, taşınabilir (örneğin ısıtma ve soğutma) ya da enerji formları birbirlerine dönüşebilir.

Isı enerjisi Mekanik enerji (buhar makinası, tren) Kimyasal enerji Isı enerjisi (Yanma) Kimyasal enerji Mekanik enerji (benzin motoru) Işık enerjisi Kimyasal enerji (fotosentez) Elektrik enerjisi Kimyasal enerjisi (akümülatör)

n Ölçü birimi olarak (enerji formları için) jul kullanılır. n 1 kalori= 4, 184 jul n Enerji formlarının değişimleri sistemlerde incelenir. n Sistem, fiziksel ya da düşüncesel olarak çevreden ayrılmış bir boşluktur. n Sistemler izole, kapalı ve açık sistemler olarak sınıflandırırlar.

n İzole sistemler: Enerji ve madde için geçirgen değildir (termos) n Kapalı sistemler: Enerji için geçirgen, madde için geçirgen değil (ampul, enerji alışverişi vardır). n Açık sistemler: Enerji ve madde geçirgendirler (hayvanlar ve bitkiler) için

İÇ ENERJİ VE ENTALPİ Her sistem belli bir enerjiye sahiptir ve bu enerjiye iç enerji (U) adı verilir, sistemin bir niteliğidir. İç enerjide bir değişim olabilir, yani bir sistemden başka bir sisteme enerji taşınması olabilir. İç enerji ya ısı (Q) ya da iş (A) olarak aktarılabilir.

Bir sistemin başlangıç ve son durumu arasındaki farklılıklara termodinamik denir. Termodinamiğin birinci kuralı; sistemden çevreye verilen ya da alınan ısı ile işin toplamı sistemin iç enerjisindeki değişimlere eşittir ve izole bir sistemde ΔU=0 ya da U sabittir ve iç enerjide bir değişim görülmez.

n Kapalı sistemlerde ise; ΔU=Q+A şeklinde bir enerji değişimi oluşur ve bulunan değer: n + ise sisteme dışardan enerji alındığı, n - ise sistemden dış ortama enerji verildiği anlaşılır. n Bir sistemin iç enerjisi ısıtılma ile yükseltilirken (Q>0), soğutma ile (Q<0) düşürülebilir. n A (iş) olarak da, genelde elektriksel iş ve hacim değişiklikleri ile karşılaşılır.

n Sabit basınç altında oluşan reaksiyonlar sırasında açığa çıkan reaksiyon ısısı entalpi (Δ H) olarak tanımlanır. Bu bilgiler ışığında; n ΔU= ΔH+Avol (hacimsel iş) veya ΔU= ΔH-p ΔV veya ΔH= ΔU+p ΔV şeklinde bulunur.

n Bu nedenle, sabit basınç altında oluşan kimyasal bir reaksiyonda dışarıdan alınan enerji (ΔH) pozitif, dışarıya verilen enerji ise (ΔH) negatif değere sahiptir ve reaksiyon ısısı ya da reaksiyon entalpisi olarak isimlendirilir. n H<0 ise reaksiyon ekzoterm (ısı oluşumu) n H>0 ise reaksiyon endoterm (ısı kaybı, dışarıdan ısı alınır)

n Entalpi, gözlenen olaya göre erime, buharlaşma, karışım, çözelme, solvatasyon, hidratasyon, nötralizasyon oluşum ya da (genel olarak) reaksiyon entalpisi olarak isimlendirilir.

Serbest Entalpi ve Entropi n Fiziksel ya da kimyasal bir olayın başlayabilmesi için izobar ve izotermik olaylarda hareketi başlatıcı güç serbest entalpidir (ΔG). n Serbest entalpi, entalpi ve kararlılık ya da kararsızlık için bir ölçü oluşturan ikinci bir faktör entropi tarafından belirlenir.

n Entropi (ΔS) bir sistemde var olan kararsızlığın ölçüsüdür. Sistemde kararsızlığın artması entropinin yükselmesine yol açar. n Her reaksiyon belli bir ısıda sabit bir ΔG 0 değerine sahiptir. Bu nedenle standart şartlarda G= ΔG 0’dır (standart şartlarda serbest entalpi değişimi). n G reaksiyona giren (edukt) ve reaksiyon sonucu oluşan maddelerin (produkt) konsantrasyonları ile değişir.

n ΔG 0 =0 ise produkt oluşumu %50 (reaksiyon dengede ise) n ΔG 0<0 ise reaksiyona giren maddelerin %50’den fazlası ürüne dönüşmüştür. n ΔG 0 >0 ise ürün oluşumu %50’den azdır. n ΔG 0’ın negatif değeri ne kadar büyük ise denge o derecede reaksiyon ürünleri oluşturulması yönündedir.

n Kinetik: Reaksiyon hızını (bir reaksiyonun zamana bağlı olarak oluşumu) ve reaksiyon yolunu (mekanizma) kapsar. n Reaksiyon hızı (RH): konsantrasyon değişimidir. Birim zamandaki

Aktivasyon Entalpisi n Başlangıçtaki enerji içeriği ile uyarılmış pozisyondaki enerji içeriği arasındaki fark, çoğu biyokimyasal reaksiyonlarda görülen ve sabit basınç altında oluşan serbest aktivasyon entalpisi adını alır (EA).

n Aktivasyon enerjisi sabit hacimlerdeki reaksiyonlar için geçerlidir. n Aktivasyon enerji değeri ne kadar düşükse reaksiyon da o derece hızlı seyreder. n Bir reaksiyon için birçok reaksiyon yolu olası ise, reaksiyon aktivasyon entalpisi en düşük yol üzerinden gerçekleşir.

Katalizör n Birçok reaksiyonun hızı belirli maddelerin katılımı ile artırılabilir (kataliz). n Kimyasal bir tepkimenin hızını tepkimede harcanmaksızın artıran maddelere katalizör denir.

n Katalizör varlığında aktivasyon enerjisi düşük olan yeni bir reaksiyon yolu açılır. Bu sayede reaksiyon hızı artırılır, hızın artmasının nedeni ise daha fazla sayıda parçacığın enerjilerinin EA değerini aşmasıdır.

n Katalizörler selektif etki gösterirler ve normal olarak seyredebilen tüm reaksiyonları aynı derecede hızlandıramazlar. Özellikle biyolojik katalizörlerde bu etki belirgindir ve reaksiyon sadece hızlandırılmaz, aynı zaman da bir yönlendirme de söz konusudur.

n Enzimler belirli spesifik reaksiyonları katalize ederler. Enzimlerin en önemli özellikleri katalitik güçleri ve spesifik oluşlarıdır.

Kimyasal reaksiyonlara ısının etkisi n Kimyasal reaksiyonlar ısıdan etkilenirler ve ısının yaklaşık 10 o’lik bir yükselişi reaksiyon hızının yaklaşık iki katına çıkmasına yol açar. n Bu olay öncelikle yeterli derecede aktiviteye sahip parçacıkların sayılarının artmasından, daha az derecede de parçacıkların birbirlerine çarpma olasılıklarının artmasından ileri gelir.

n Yüksek ısı derecesinde EA’ dan daha yüksek enerjiye sahip parçacık sayısı artar ve birim zamanda daha reaksiyona girer. fazla sayıda parçacık

Reaksiyon Hızını Etkileyen Diğer Faktörler n Reaksiyon hızı, reaksiyona giren maddelerin; n 1 - Yüzey genişlikleri ile de ilişkilidir. Parçacıkların çapı ne kadar küçükse, RH o derecede yüksektir. Reaksiyon hızındaki bu artış birim zamanda karşılan parçacık sayısının artmasından ileri gelir ve bu olgu hazırlanmasında önemlidir. özellikle ilaçların

n 2 - Molekül yapısı da RH’nı etkiler. Dipol yapısındaki su, yine dipol yapıya sahip SO 2 ile düz bir yapıya sahip CO 2’den daha hızlı bir reaksiyon verir.
 Beyin ölümü solunumsal hedefleri
Beyin ölümü solunumsal hedefleri Okülosefalik refleks nedir
Okülosefalik refleks nedir Ya çare sizsiniz yada çaresizsiniz
Ya çare sizsiniz yada çaresizsiniz Geometrik ortalama nedir
Geometrik ortalama nedir Gruplandırılmış serilerde medyan
Gruplandırılmış serilerde medyan Excel veri birleştirme
Excel veri birleştirme Niçin güneşi aydan daha küçük görürüz
Niçin güneşi aydan daha küçük görürüz Yok bir tane daha senden
Yok bir tane daha senden Den daha az sıklıkları bulma
Den daha az sıklıkları bulma Daha iyiye en ileriye
Daha iyiye en ileriye Nota değerleri ve vuruşları
Nota değerleri ve vuruşları Bu konuyu bir daha açmayacağım
Bu konuyu bir daha açmayacağım üleştirme sayılarının yazımı
üleştirme sayılarının yazımı Daha dün annemizin notaları
Daha dün annemizin notaları çarpık tablosu
çarpık tablosu Sarı ve cyan filtreler
Sarı ve cyan filtreler