YVES MARKOWICZ matre de confrences Laboratoire Adaptation et

YVES MARKOWICZ (maître de conférences) Laboratoire Adaptation et Pathogénie des Micro-organismes (CNRS UMR 5163) Bâtiment J. Roget - 508 F Domaine de la Merci La Tronche Tél. : 0476 637484 - Fax : 0476 637497 Courriel : yves. markowicz@ujf-grenoble. fr Mars/Avril 2010 Yves Markowicz - LAPM (CNRS UMR 5163) - Université J. Fourier 1

Quelques livres à la B. U. • Microbiologie (Prescott et al. ) • Microbe (Schaechter et al. ) Mars/Avril 2010 Yves Markowicz - LAPM (CNRS UMR 5163) - Université J. Fourier 2

BIO 241 METABOLISME : SPECIFICITES BACTERIENNES Mars/Avril 2010 Yves Markowicz - LAPM (CNRS UMR 5163) - Université J. Fourier 3

METABOLISME : SPECIFICITES MICROBIENNES LA MORALE DU COURS ü Comme les plantes, les bactéries sont capables de synthétiser tout ce qui est nécessaire à leur croissance à partir de nutriments plus ou moins complexes (prototrophie) ü Au sein de l’immense biodiversité des procaryotes, on trouve des bactéries capables d’utiliser n’importe quels aliments ü La grande majorité des bactéries disposent de plusieurs catabolismes alternatifs : elles peuvent s’adapter à d’importants changements environnementaux Mars/Avril 2010 Yves Markowicz - LAPM (CNRS UMR 5163) - Université J. Fourier 4

METABOLISME : SPECIFICITES MICROBIENNES LES CYCLES BIOGEOCHIMIQUES Mars/Avril 2010 Yves Markowicz - LAPM (CNRS UMR 5163) - Université J. Fourier 5
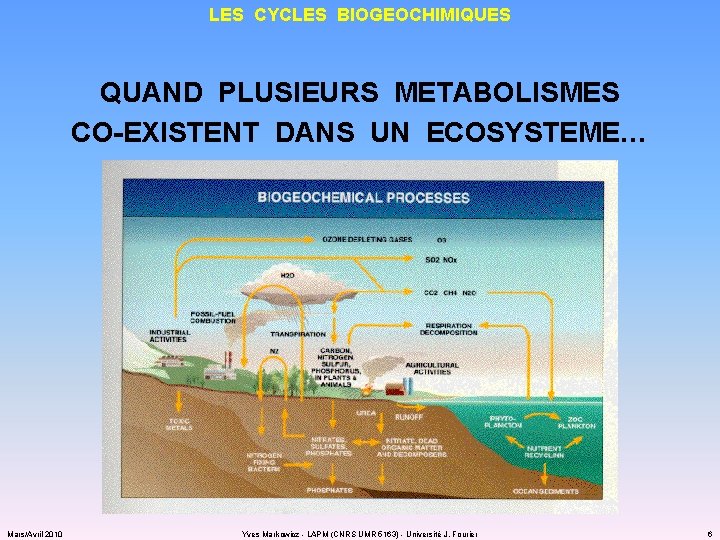
LES CYCLES BIOGEOCHIMIQUES QUAND PLUSIEURS METABOLISMES CO-EXISTENT DANS UN ECOSYSTEME… Mars/Avril 2010 Yves Markowicz - LAPM (CNRS UMR 5163) - Université J. Fourier 6
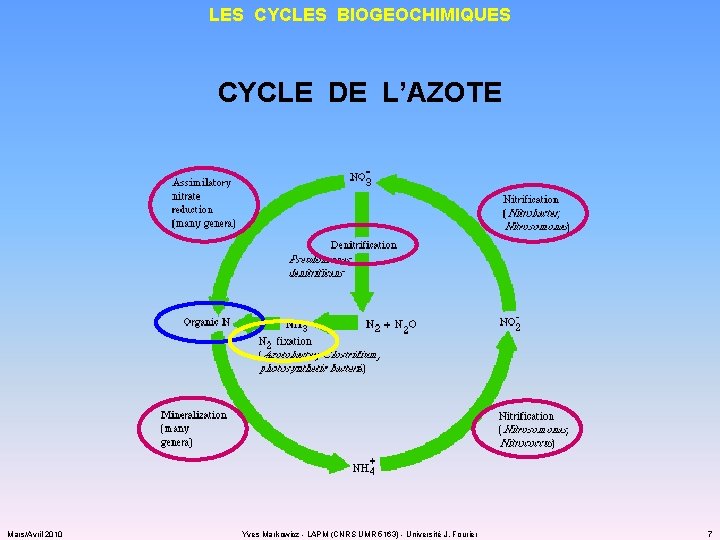
LES CYCLES BIOGEOCHIMIQUES CYCLE DE L’AZOTE Mars/Avril 2010 Yves Markowicz - LAPM (CNRS UMR 5163) - Université J. Fourier 7
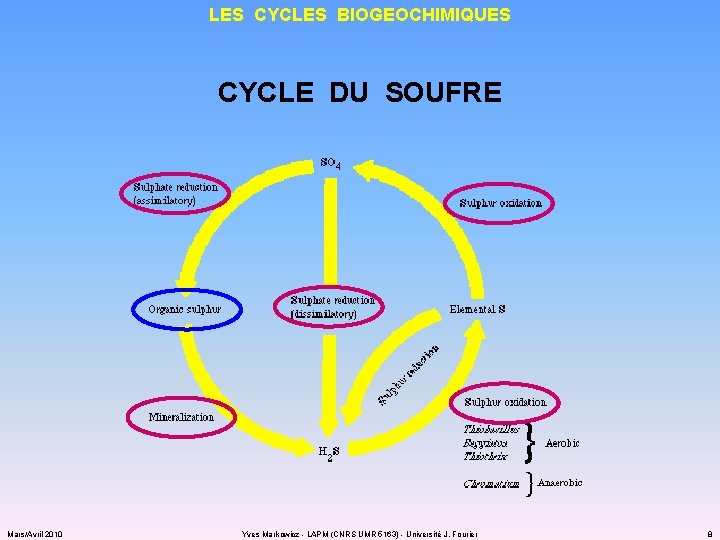
LES CYCLES BIOGEOCHIMIQUES CYCLE DU SOUFRE Mars/Avril 2010 Yves Markowicz - LAPM (CNRS UMR 5163) - Université J. Fourier 8
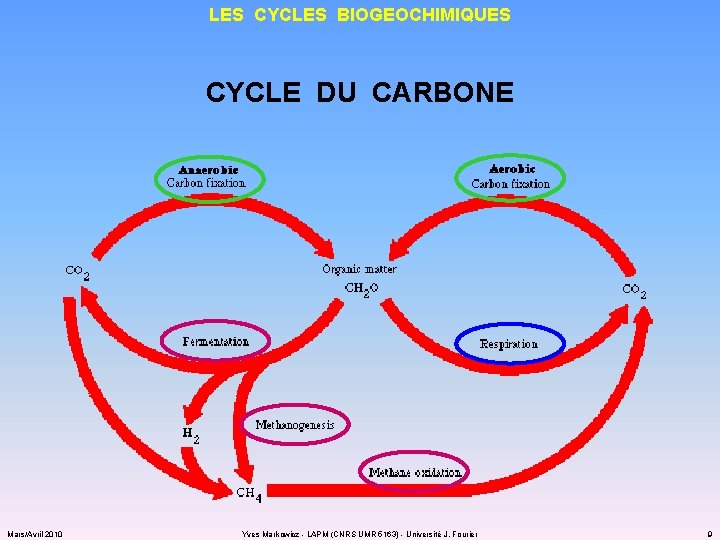
LES CYCLES BIOGEOCHIMIQUES CYCLE DU CARBONE Mars/Avril 2010 Yves Markowicz - LAPM (CNRS UMR 5163) - Université J. Fourier 9

CATABOLISMES LA COLONNE DE WINOGRADSKY Mars/Avril 2010 Yves Markowicz - LAPM (CNRS UMR 5163) - Université J. Fourier 10

CATABOLISMES LA COLONNE DE WINOGRADSKY Mars/Avril 2010 Yves Markowicz - LAPM (CNRS UMR 5163) - Université J. Fourier 11

METABOLISME : SPECIFICITES MICROBIENNES L’USINE MICROBIENNE Mars/Avril 2010 Yves Markowicz - LAPM (CNRS UMR 5163) - Université J. Fourier 12

L’USINE MICROBIENNE LA PROBLEMATIQUE ü les participants : ü la ligne de montage : matériaux (nutriments, substrats) énergie (catabolisme) plan de fabrication (génome) approvisionnements catabolisme biosynthèses polymérisations assemblages Mars/Avril 2010 Yves Markowicz - LAPM (CNRS UMR 5163) - Université J. Fourier 13

LA LIGNE DE MONTAGE DEUX TYPES D’ENERGIE ü ATP phosphorylation au niveau du substrat X~ P + ADP X + ATP phosphorylation oxydative photophosphorylation ATPase ADP + Pi ATP (biosynthèses et) polymérisations transports, assemblages ü NADPH + H+ (pouvoir réducteur) oxydations XH 2 + NADP+ X + NADPH + H+ biosynthèses Mars/Avril 2010 Yves Markowicz - LAPM (CNRS UMR 5163) - Université J. Fourier 14
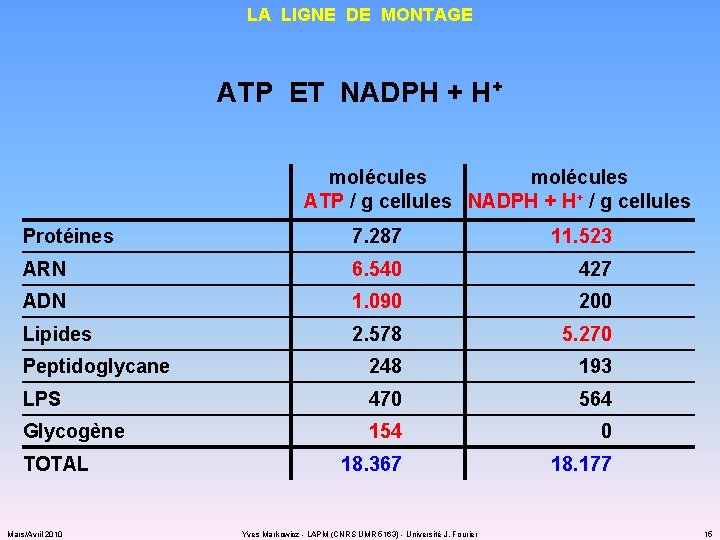
LA LIGNE DE MONTAGE ATP ET NADPH + H+ molécules ATP / g cellules NADPH + H+ / g cellules Protéines 7. 287 11. 523 ARN 6. 540 427 ADN 1. 090 200 Lipides 2. 578 5. 270 Peptidoglycane 248 193 LPS 470 564 Glycogène 154 0 18. 367 18. 177 TOTAL Mars/Avril 2010 Yves Markowicz - LAPM (CNRS UMR 5163) - Université J. Fourier 15
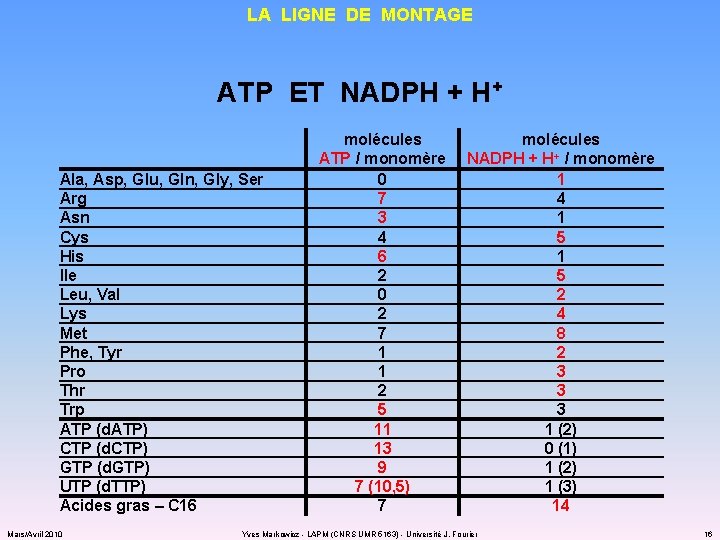
LA LIGNE DE MONTAGE ATP ET NADPH + H+ Ala, Asp, Glu, Gln, Gly, Ser Arg Asn Cys His Ile Leu, Val Lys Met Phe, Tyr Pro Thr Trp ATP (d. ATP) CTP (d. CTP) GTP (d. GTP) UTP (d. TTP) Acides gras – C 16 Mars/Avril 2010 molécules ATP / monomère 0 7 3 4 6 2 0 2 7 1 1 2 5 11 13 9 7 (10, 5) 7 molécules NADPH + H+ / monomère 1 4 1 5 2 4 8 2 3 3 3 1 (2) 0 (1) 1 (2) 1 (3) 14 Yves Markowicz - LAPM (CNRS UMR 5163) - Université J. Fourier 16
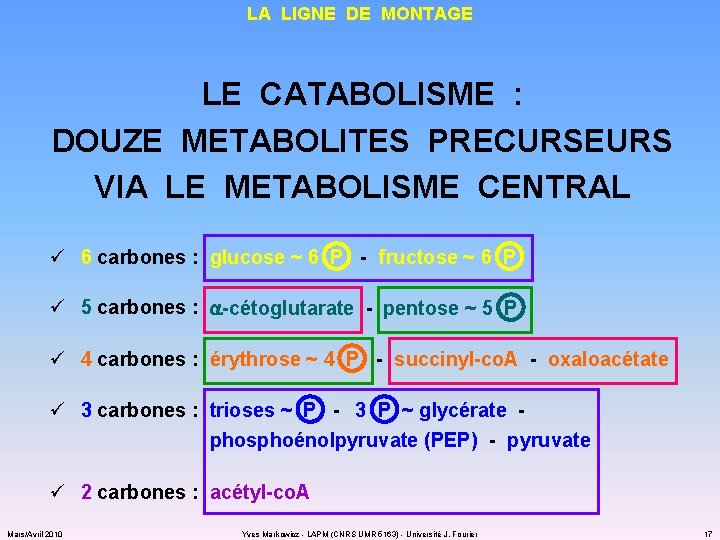
LA LIGNE DE MONTAGE LE CATABOLISME : DOUZE METABOLITES PRECURSEURS VIA LE METABOLISME CENTRAL ü 6 carbones : glucose ~ 6 P - fructose ~ 6 P ü 5 carbones : a-cétoglutarate - pentose ~ 5 P ü 4 carbones : érythrose ~ 4 P - succinyl-co. A - oxaloacétate ü 3 carbones : trioses ~ P - 3 P ~ glycérate - phosphoénolpyruvate (PEP) - pyruvate ü 2 carbones : acétyl-co. A Mars/Avril 2010 Yves Markowicz - LAPM (CNRS UMR 5163) - Université J. Fourier 17
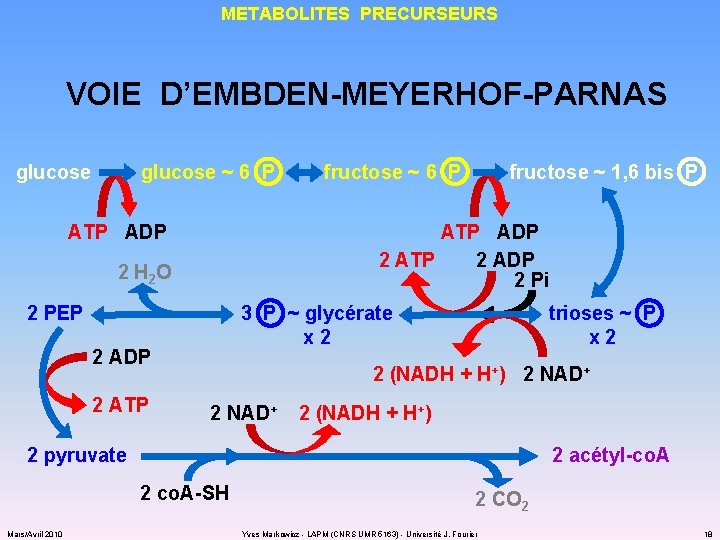
METABOLITES PRECURSEURS VOIE D’EMBDEN-MEYERHOF-PARNAS glucose ~ 6 P ATP ADP fructose ~ 1, 6 bis P ATP ADP 2 ATP 2 ADP 2 Pi 2 H 2 O 2 PEP 3 P ~ glycérate x 2 2 ADP 2 ATP fructose ~ 6 P trioses ~ P x 2 2 (NADH + H+) 2 NAD+ 2 (NADH + H+) 2 pyruvate 2 acétyl-co. A 2 co. A-SH Mars/Avril 2010 2 CO 2 Yves Markowicz - LAPM (CNRS UMR 5163) - Université J. Fourier 18
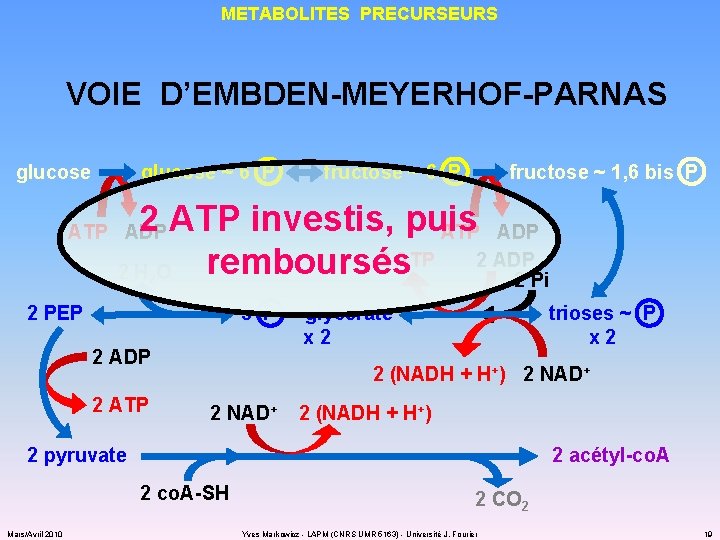
METABOLITES PRECURSEURS VOIE D’EMBDEN-MEYERHOF-PARNAS glucose ~ 6 P fructose ~ 1, 6 bis P 2 ATP investis, puis ATP ADP 2 ATP 2 ADP remboursés 2 H O 2 Pi ATP ADP 2 2 PEP 3 P ~ glycérate x 2 2 ADP 2 ATP trioses ~ P x 2 2 (NADH + H+) 2 NAD+ 2 (NADH + H+) 2 pyruvate 2 acétyl-co. A 2 co. A-SH Mars/Avril 2010 2 CO 2 Yves Markowicz - LAPM (CNRS UMR 5163) - Université J. Fourier 19

METABOLITES PRECURSEURS VOIE D’EMBDEN-MEYERHOF-PARNAS : BILAN Glucose + 2 (ADP + Pi) + 2 NAD+ 2 pyruvate + 2 H 2 O + 2 ATP + 2 (NADH + H+) + 2 co. A-SH + 2 NAD+ 2 acétyl-co. A + 2 CO 2 + 2 (NADH + H+) Mars/Avril 2010 Yves Markowicz - LAPM (CNRS UMR 5163) - Université J. Fourier 20

METABOLITES PRECURSEURS VOIE D’EMBDEN-MEYERHOF-PARNAS : BILAN Glucose + 2 (ADP + Pi) + 4 NAD+ + 2 co. A-SH 2 acétyl-co. A + 2 CO 2 + 2 H 2 O + 2 ATP + 4 (NADH + H+) Mars/Avril 2010 Yves Markowicz - LAPM (CNRS UMR 5163) - Université J. Fourier 21
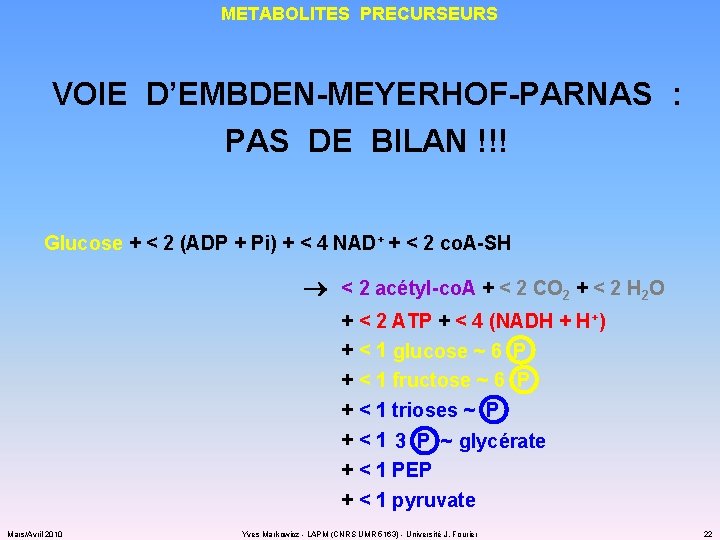
METABOLITES PRECURSEURS VOIE D’EMBDEN-MEYERHOF-PARNAS : PAS DE BILAN !!! Glucose + < 2 (ADP + Pi) + < 4 NAD+ + < 2 co. A-SH < 2 acétyl-co. A + < 2 CO 2 + < 2 H 2 O + < 2 ATP + < 4 (NADH + H+) + < 1 glucose ~ 6 P + < 1 fructose ~ 6 P + < 1 trioses ~ P + < 1 3 P ~ glycérate + < 1 PEP + < 1 pyruvate Mars/Avril 2010 Yves Markowicz - LAPM (CNRS UMR 5163) - Université J. Fourier 22
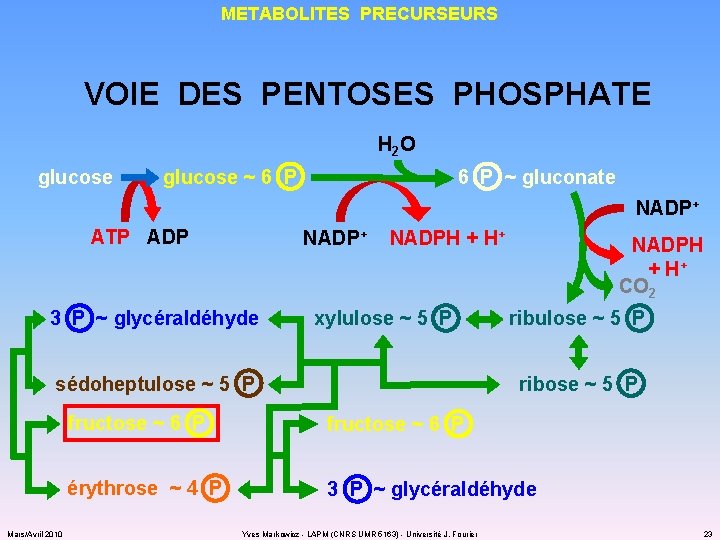
METABOLITES PRECURSEURS VOIE DES PENTOSES PHOSPHATE H 2 O glucose ~ 6 P ~ gluconate NADP+ ATP ADP NADP+ NADPH + H+ 3 P ~ glycéraldéhyde xylulose ~ 5 P sédoheptulose ~ 5 P Mars/Avril 2010 NADPH + H+ CO 2 ribulose ~ 5 P ribose ~ 5 P fructose ~ 6 P érythrose ~ 4 P 3 P ~ glycéraldéhyde Yves Markowicz - LAPM (CNRS UMR 5163) - Université J. Fourier 23

METABOLITES PRECURSEURS VOIE DES PENTOSES PHOSPHATE : BILAN 3 Glucose + 3 ATP + 6 NADP+ + 3 H 2 O 1 3 P ~ glycéraldéhyde fructose ~ 6 P + 2 + 3 CO 2 + 6 (NADPH + H+) + 3 ADP Mars/Avril 2010 Yves Markowicz - LAPM (CNRS UMR 5163) - Université J. Fourier 24

METABOLITES PRECURSEURS VOIE DES PENTOSES PHOSPHATE : PAS DE BILAN !!! 3 Glucose + 3 ATP + < 6 NADP+ + < 3 H 2 O < 1 3 P ~ glycéraldéhyde fructose ~ 6 P + < 2 + < 3 CO 2 + < 6 (NADPH + H+) + 3 ADP + < 1 érythrose ~ 4 P + < 1 pentose ~ 5 P Mars/Avril 2010 Yves Markowicz - LAPM (CNRS UMR 5163) - Université J. Fourier 25
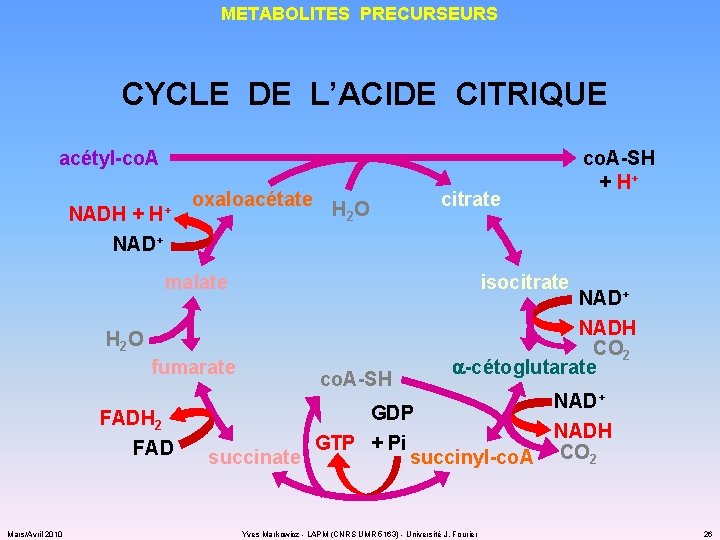
METABOLITES PRECURSEURS CYCLE DE L’ACIDE CITRIQUE acétyl-co. A NADH + H+ oxaloacétate H O 2 co. A-SH + H+ citrate NAD+ malate isocitrate H 2 O fumarate FADH 2 FAD Mars/Avril 2010 co. A-SH NAD+ NADH CO 2 a-cétoglutarate GDP GTP + Pi succinate succinyl-co. A Yves Markowicz - LAPM (CNRS UMR 5163) - Université J. Fourier NAD+ NADH CO 2 26

METABOLITES PRECURSEURS CYCLE DE L’ACIDE CITRIQUE : BILAN 2 acétyl-co. A + 4 H 2 O + 2 (GDP + Pi) + 6 NAD+ + 2 FAD+ 4 CO 2 + 2 co. A-SH + 2 GTP + 4 (NADH + H+) + 2 NADH + 2 (FADH + H+) Mars/Avril 2010 Yves Markowicz - LAPM (CNRS UMR 5163) - Université J. Fourier 27

METABOLITES PRECURSEURS CYCLE DE L’ACIDE CITRIQUE : PAS DE BILAN !!! 2 acétyl-co. A + < 4 H 2 O + < 2 (GDP + Pi) + < 6 NAD+ + < 2 FAD+ < 4 CO 2 + < 2 co. A-SH + < 2 GTP + < 4 (NADH + H+) + < 2 NADH + < 2 (FADH + H+) + < 1 a-cétoglutarate + < 1 succinyl-co. A + < 1 oxaloacétate Mars/Avril 2010 Yves Markowicz - LAPM (CNRS UMR 5163) - Université J. Fourier 28

METABOLITES PRECURSEURS MORALITE ü catabolisme et biosynthèses sont interconnectés, donc pas de bilans cataboliques (dans ce cours) ü la cellule n’est pas un tube à essai ! Mars/Avril 2010 Yves Markowicz - LAPM (CNRS UMR 5163) - Université J. Fourier 29
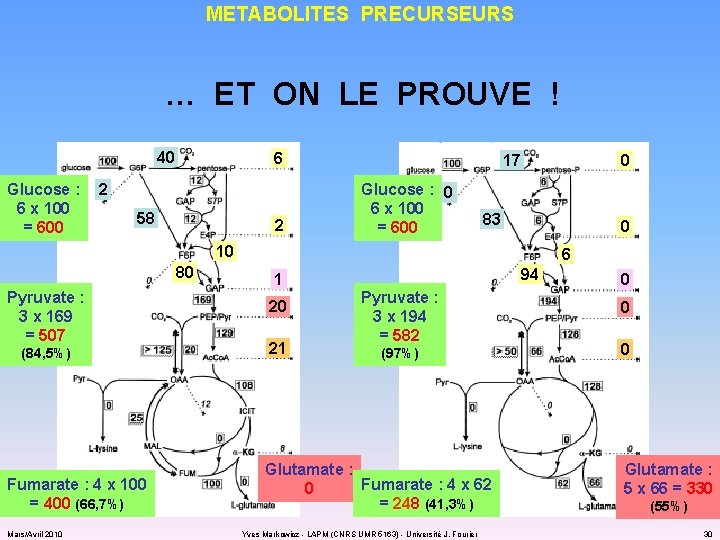
METABOLITES PRECURSEURS … ET ON LE PROUVE ! 40 Glucose : 6 x 100 = 600 6 2 58 2 17 Glucose : 0 6 x 100 = 600 0 83 0 10 80 Pyruvate : 3 x 169 = 507 (84, 5%) Fumarate : 4 x 100 = 400 (66, 7%) Mars/Avril 2010 6 1 20 21 94 Pyruvate : 3 x 194 = 582 (97%) Glutamate : Fumarate : 4 x 62 0 = 248 (41, 3%) Yves Markowicz - LAPM (CNRS UMR 5163) - Université J. Fourier 0 0 0 Glutamate : 5 x 66 = 330 (55%) 30

LA LIGNE DE MONTAGE LES BIOSYNTHESES : « BRIQUES ELEMENTAIRES » ü sucres (25) PEP, , glucose ~ 6 P fructose ~ 6 P ü acides gras (8) acétyl-co. A ü acides aminés (20) PEP, érythrose ~ 4 P pyruvate, acétyl-co. A oxaloacétate, succinyl-co. A a-cétoglutarate 3 P ~ glycérate ü nucléotides (8) pentose ~ 5 P érythrose ~ 4 P ü coenzymes, vitamines, … trioses ~ P , , … Mars/Avril 2010 Yves Markowicz - LAPM (CNRS UMR 5163) - Université J. Fourier 31

LA LIGNE DE MONTAGE POLYMERISATIONS ü lipides = polymères d’acides gras ü LPS = sucres + acides gras ü peptidoglycane = sucres + acides aminés ü protéines = polymères d’acides aminés ü ADN, ARN = polymères de nucléotides ü glycogène = polymère de sucres ü … Mars/Avril 2010 Yves Markowicz - LAPM (CNRS UMR 5163) - Université J. Fourier 32
![LA LIGNE DE MONTAGE ASSEMBLAGES ü enveloppe = membrane plasmique [acides gras + protéines] LA LIGNE DE MONTAGE ASSEMBLAGES ü enveloppe = membrane plasmique [acides gras + protéines]](http://slidetodoc.com/presentation_image_h/019c915ea9ecda504f2757202fd5035c/image-33.jpg)
LA LIGNE DE MONTAGE ASSEMBLAGES ü enveloppe = membrane plasmique [acides gras + protéines] + peptidoglycane (+ acides téichoïques) (+ membrane externe [acides gras + protéines + LPS]) ü flagelles et pili = « polymères » de protéines ü ribosomes = ARN + protéines ü nucléoïde = ADN (+ ARN) + protéines ü … Mars/Avril 2010 Yves Markowicz - LAPM (CNRS UMR 5163) - Université J. Fourier 33
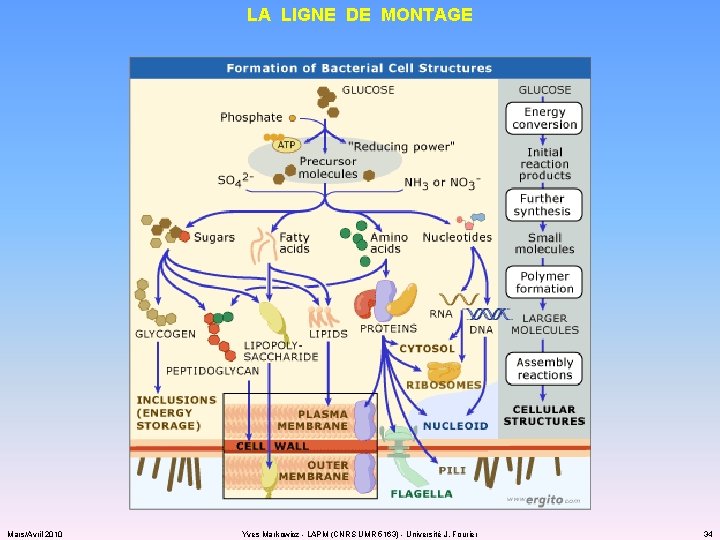
LA LIGNE DE MONTAGE Mars/Avril 2010 Yves Markowicz - LAPM (CNRS UMR 5163) - Université J. Fourier 34

METABOLISME : SPECIFICITES MICROBIENNES APPROVISIONNEMENT Mars/Avril 2010 Yves Markowicz - LAPM (CNRS UMR 5163) - Université J. Fourier 35

APPROVISIONNEMENT LES PROBLEMATIQUES ü les bactéries vivent généralement dans un environnement où les nutriments sont moins concentrés que dans le cytosol : COMMENT CROITRE EXPONENTIELLEMENT MALGRE LA CARENCE ? ü les molécules importées ne doivent pas pouvoir ressortir (avant d’avoir été métabolisées) ü les molécules autres que nutriments ne doivent pas pouvoir sortir (sauf excrétion ou sécrétion) ! ü la plupart des molécules ne peuvent pas transiter à travers la membrane plasmique Mars/Avril 2010 Yves Markowicz - LAPM (CNRS UMR 5163) - Université J. Fourier 36
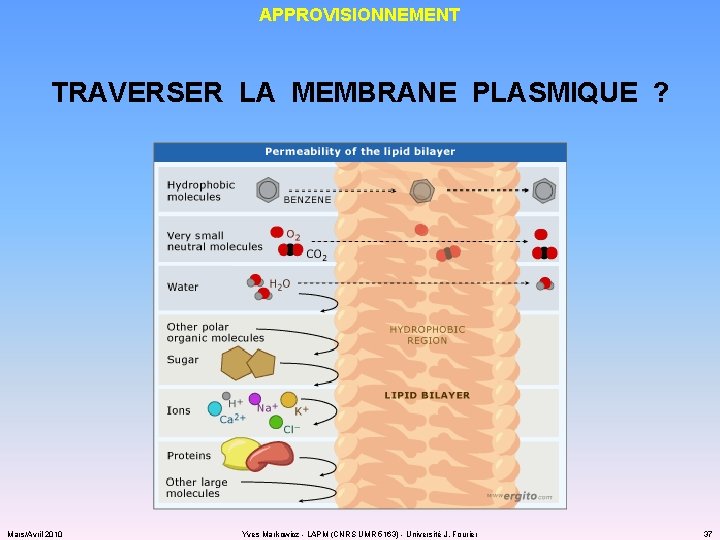
APPROVISIONNEMENT TRAVERSER LA MEMBRANE PLASMIQUE ? Mars/Avril 2010 Yves Markowicz - LAPM (CNRS UMR 5163) - Université J. Fourier 37

APPROVISIONNEMENT DIFFERENTS MODES D’APPROVISIONNEMENT ü diffusion simple (passive) v = f (DC, P, A) ü diffusion facilitée v = f (P, A) à faible DC ü transports actifs v = f (P, A) coût énergétique Mars/Avril 2010 Yves Markowicz - LAPM (CNRS UMR 5163) - Université J. Fourier 38

APPROVISIONNEMENT DIFFUSION SIMPLE : GRATUIT… MAIS LIMITE ! Mars/Avril 2010 Yves Markowicz - LAPM (CNRS UMR 5163) - Université J. Fourier 39

APPROVISIONNEMENT DIFFUSION SIMPLE : GRATUIT… MAIS LIMITE ! Mars/Avril 2010 Yves Markowicz - LAPM (CNRS UMR 5163) - Université J. Fourier 40
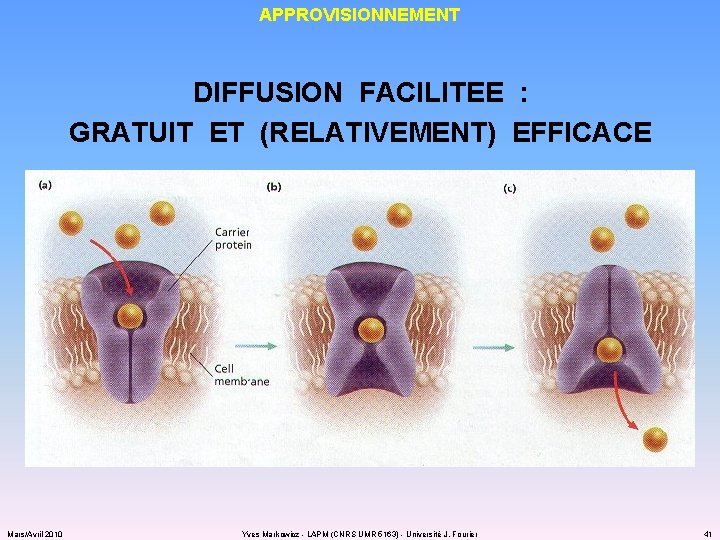
APPROVISIONNEMENT DIFFUSION FACILITEE : GRATUIT ET (RELATIVEMENT) EFFICACE Mars/Avril 2010 Yves Markowicz - LAPM (CNRS UMR 5163) - Université J. Fourier 41
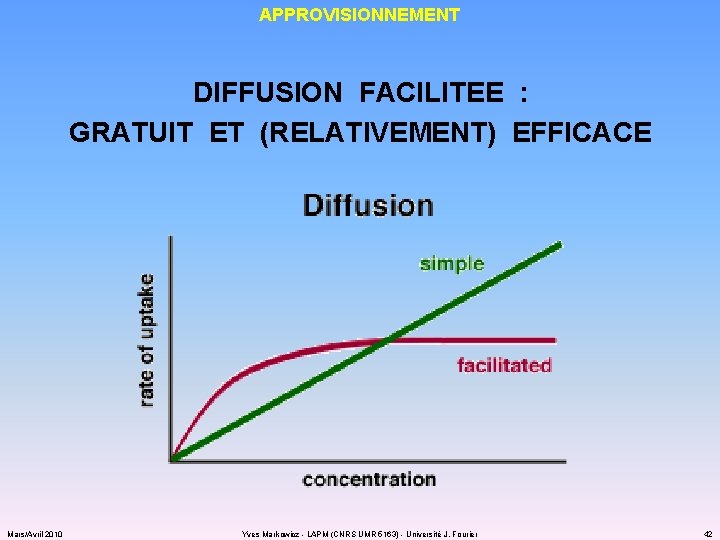
APPROVISIONNEMENT DIFFUSION FACILITEE : GRATUIT ET (RELATIVEMENT) EFFICACE Mars/Avril 2010 Yves Markowicz - LAPM (CNRS UMR 5163) - Université J. Fourier 42

APPROVISIONNEMENT TRANSPORTS ACTIFS : « PAYER » POUR CONTRER LE GRADIENT DE CONCENTRATION Mars/Avril 2010 Yves Markowicz - LAPM (CNRS UMR 5163) - Université J. Fourier 43
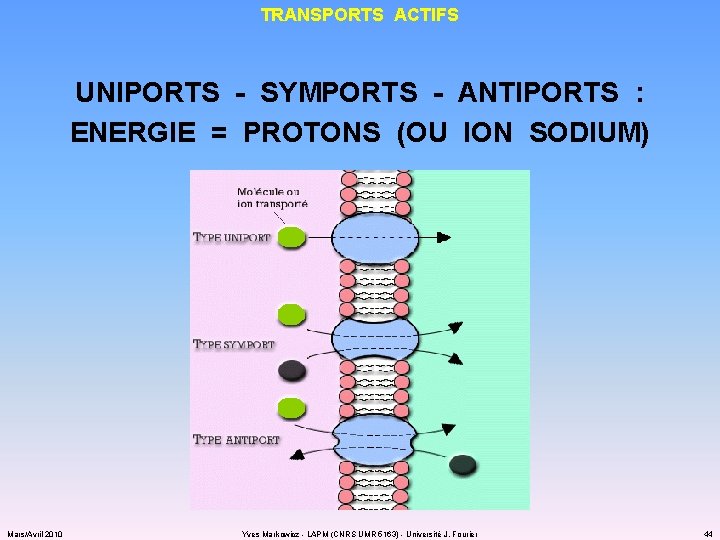
TRANSPORTS ACTIFS UNIPORTS - SYMPORTS - ANTIPORTS : ENERGIE = PROTONS (OU ION SODIUM) Mars/Avril 2010 Yves Markowicz - LAPM (CNRS UMR 5163) - Université J. Fourier 44
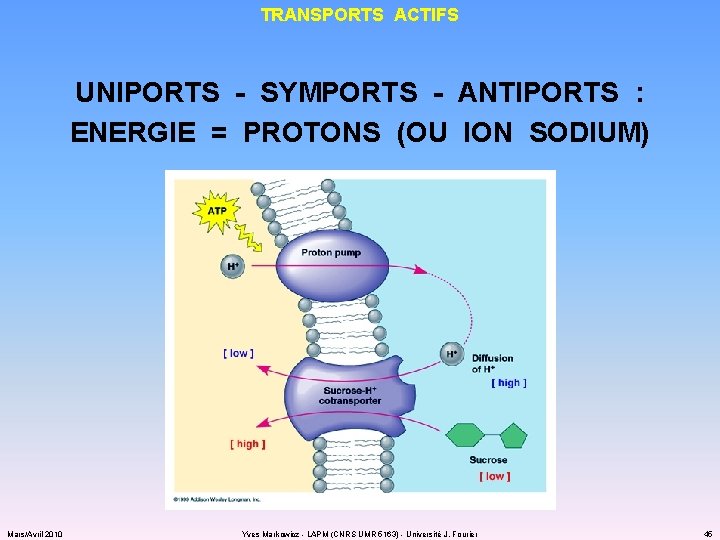
TRANSPORTS ACTIFS UNIPORTS - SYMPORTS - ANTIPORTS : ENERGIE = PROTONS (OU ION SODIUM) Mars/Avril 2010 Yves Markowicz - LAPM (CNRS UMR 5163) - Université J. Fourier 45
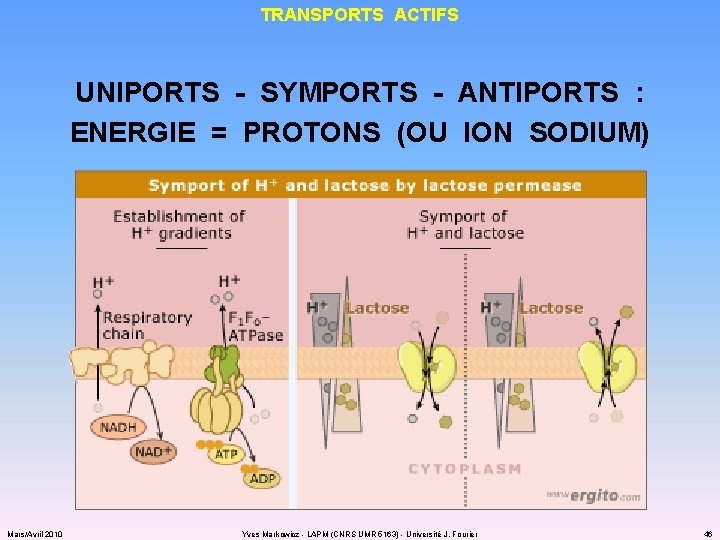
TRANSPORTS ACTIFS UNIPORTS - SYMPORTS - ANTIPORTS : ENERGIE = PROTONS (OU ION SODIUM) Mars/Avril 2010 Yves Markowicz - LAPM (CNRS UMR 5163) - Université J. Fourier 46
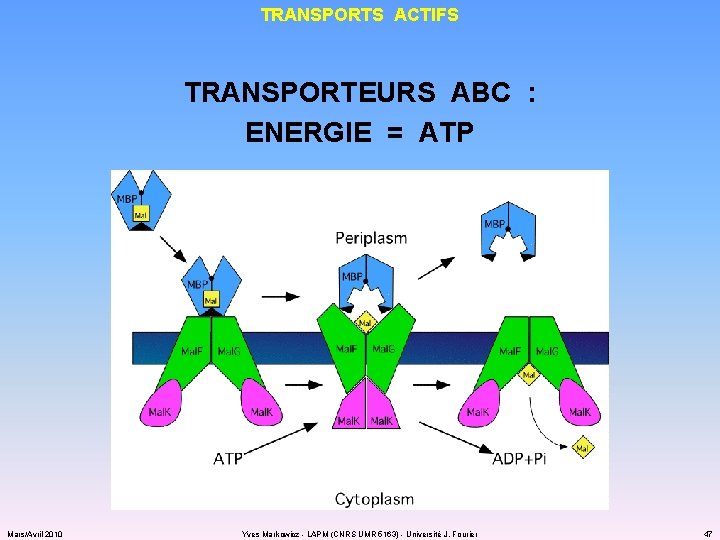
TRANSPORTS ACTIFS TRANSPORTEURS ABC : ENERGIE = ATP Mars/Avril 2010 Yves Markowicz - LAPM (CNRS UMR 5163) - Université J. Fourier 47
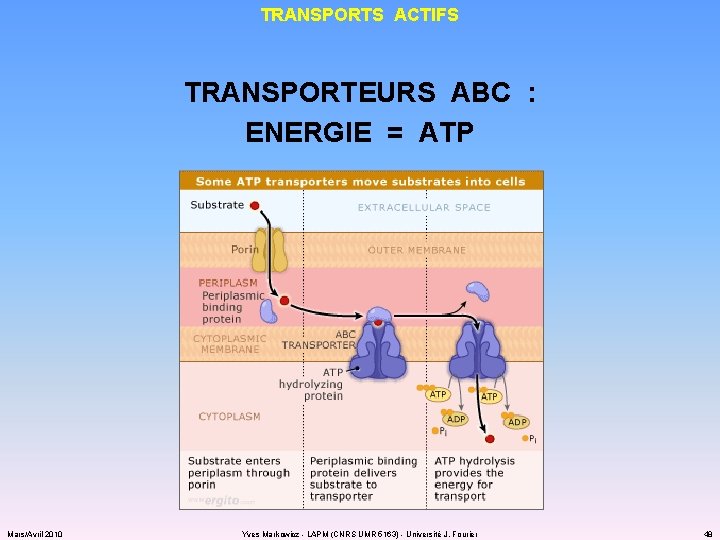
TRANSPORTS ACTIFS TRANSPORTEURS ABC : ENERGIE = ATP Mars/Avril 2010 Yves Markowicz - LAPM (CNRS UMR 5163) - Université J. Fourier 48
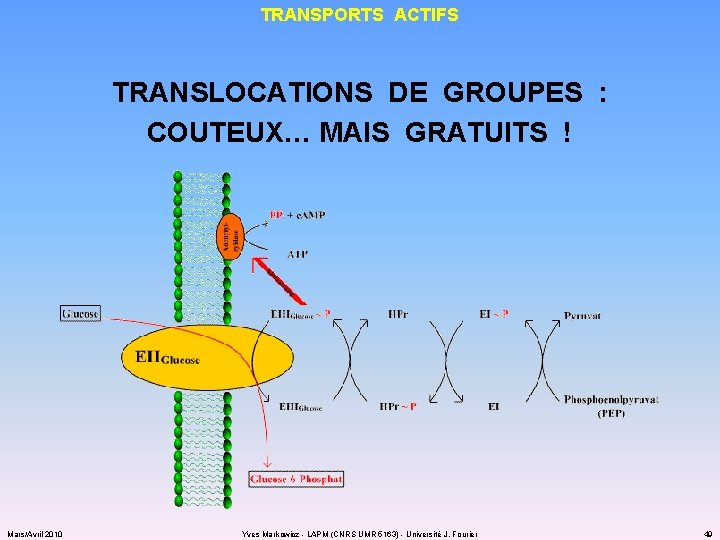
TRANSPORTS ACTIFS TRANSLOCATIONS DE GROUPES : COUTEUX… MAIS GRATUITS ! Mars/Avril 2010 Yves Markowicz - LAPM (CNRS UMR 5163) - Université J. Fourier 49
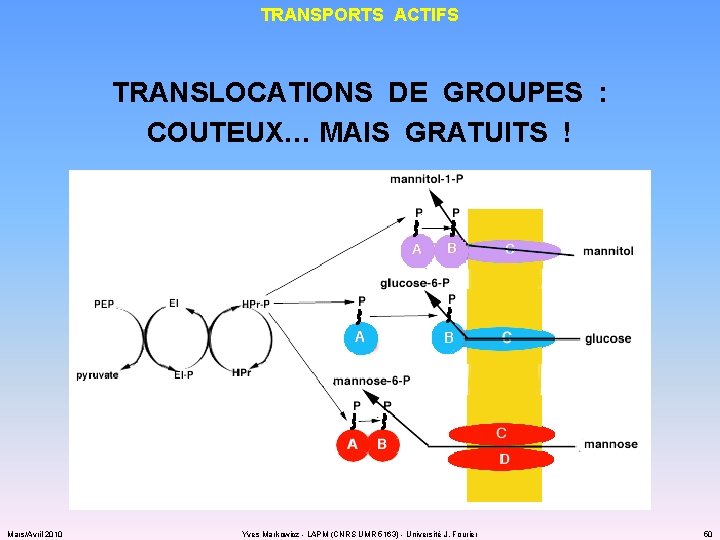
TRANSPORTS ACTIFS TRANSLOCATIONS DE GROUPES : COUTEUX… MAIS GRATUITS ! Mars/Avril 2010 Yves Markowicz - LAPM (CNRS UMR 5163) - Université J. Fourier 50
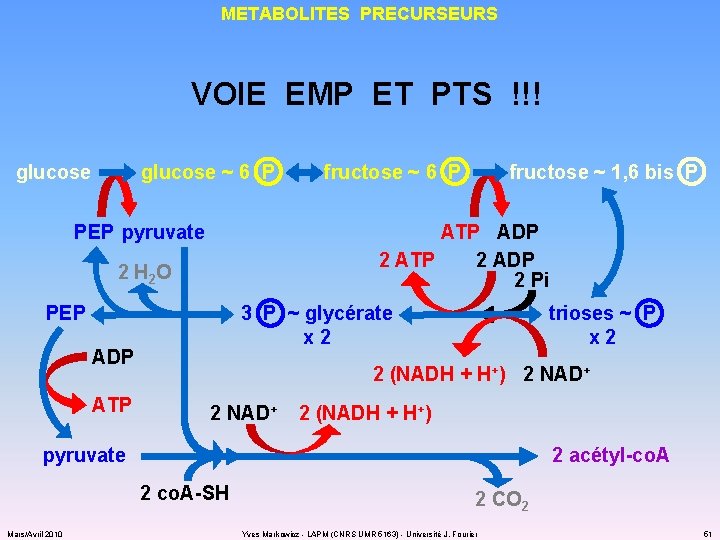
METABOLITES PRECURSEURS VOIE EMP ET PTS !!! glucose ~ 6 P PEP pyruvate fructose ~ 1, 6 bis P ATP ADP 2 ATP 2 ADP 2 Pi 2 H 2 O PEP 3 P ~ glycérate x 2 ADP ATP fructose ~ 6 P trioses ~ P x 2 2 (NADH + H+) 2 NAD+ 2 (NADH + H+) pyruvate 2 acétyl-co. A 2 co. A-SH Mars/Avril 2010 2 CO 2 Yves Markowicz - LAPM (CNRS UMR 5163) - Université J. Fourier 51

APPROVISIONNEMENT DES MODES D’APPROVISIONNEMENT ADAPTES AUX MOLECULES DESTINEES A ETRE CATABOLISEES ü un même sucre n’est pas transporté de la même façon par toutes les bactéries exemple : lactose glucose E. coli Lactobacillus symport PTS transport actif ü les métabolites préférentiels sont importés via les transports les moins coûteux ü les métabolites rares sont importés (et catabolisés) via des systèmes inductibles Mars/Avril 2010 Yves Markowicz - LAPM (CNRS UMR 5163) - Université J. Fourier 52

METABOLISME : SPECIFICITES MICROBIENNES CATABOLISMES Mars/Avril 2010 Yves Markowicz - LAPM (CNRS UMR 5163) - Université J. Fourier 53

CATABOLISMES PROTOTROPHES VS. AUXOTROPHES ü prototrophes : poussent sur milieu minimum (synthétisent AA, bases azotées, vitamines) ü auxotrophes : ne poussent pas sur milieu minimum quelle que soit la source de carbone (problème de biosynthèse) sauf si on leur donne une source de carbone appropriée (problème de catabolisme) Mars/Avril 2010 Yves Markowicz - LAPM (CNRS UMR 5163) - Université J. Fourier 54

CATABOLISMES UNE DIVERSITE CATABOLIQUE TRES SUPERIEURE A CELLE DU REGNE EUCARYOTE ü diversité des sources de carbone ü diversité des sources d’énergie TYPES TROPHIQUES ü diversité des sources d’électrons ü diversité des comportements vis-à-vis de l’oxygène Mars/Avril 2010 Yves Markowicz - LAPM (CNRS UMR 5163) - Université J. Fourier 55

CATABOLISMES TYPES TROPHIQUES ü source de carbone : autotrophes CO 2 hétérotrophes autre(s) que CO 2 (différents niveaux rédox) ü source d’énergie : phototrophes lumière (photosynthèses) oxydation de composés organiques / inorganiques ü source d’électrons : chimiotrophes lithotrophes organotrophes Mars/Avril 2010 molécules inorganiques (réduites) molécules organiques (réduites) Yves Markowicz - LAPM (CNRS UMR 5163) - Université J. Fourier 56

TYPES TROPHIQUES 5 TYPES NUTRITIONNELS MAJEURS ü photo-lithotrophes autotrophes cyanobactéries, bactéries sulfureuses pourpres et vertes ü chimio-organotrophes hétérotrophes flores animales, pathogènes, . . . ü photo-organotrophes hétérotrophes bactéries non sulfureuses pourpres et vertes ü chimio-lithotrophes autotrophes bactéries oxydant le soufre, l’hydrogène ou le fer, bactéries nitrifiantes ü chimio-lithotrophes hétérotrophes Mars/Avril 2010 Yves Markowicz - LAPM (CNRS UMR 5163) - Université J. Fourier 57

HETEROTROPHES Y’A PAS QUE LE GLUCOSE DANS LA VIE ! ü d’autres sucres réserves intra-cellulaires sucres simples disaccharides polysaccharides ü protéines et acides aminés ü lipides et acides gras ü acides organiques, alcools, hydrocarbures aliphatiques, composés aromatiques, . . . Mars/Avril 2010 Yves Markowicz - LAPM (CNRS UMR 5163) - Université J. Fourier 58

HETEROTROPHES LES REGLES DU JEU ü quelle que soit la source de carbone, elle devra servir de précurseur pour la fabrication des 12 métabolistes précurseurs ü selon le nombre de carbones du métabolite, ceux-ci seront injectés plus ou moins haut dans le métabolisme central v tout en haut, pas de problème v plus bas… il va falloir renvoyer des carbones en sens inverse ! ü si le métabolite est trop gros pour rentrer dans la cellule, il faudra le découper à l’extérieur enzymes extracellulaires Mars/Avril 2010 Yves Markowicz - LAPM (CNRS UMR 5163) - Université J. Fourier 59

HETEROTROPHES CE QUE JE VOUS DEMANDE ü être capable de proposer un site d’injection dans le métabolisme central pour les carbones en fonction du métabolite consommé ü se rappeler que les réactions peuvent aller dans les deux sens v réactions réversibles v réactions inverses ü avoir en tête que tout métabolite carboné est (théoriquement) consommable par une bactérie à la surface de la planète ü ne pas connaître les réactions par coeur !!!!! Mars/Avril 2010 Yves Markowicz - LAPM (CNRS UMR 5163) - Université J. Fourier 60

SOURCES DE CARBONE D’AUTRES SUCRES. . . ü réserves intra-cellulaires : glycogène Glcn + Pi Glcn-1 + Glc ~ 1 P poly-b-hydroxybutyrate (PHB) HBn + 2 co. A-SH HBn-1 + 2 acétyl-co. A ü sucres simples fructose Fru + Pi Fru ~ 6 P galactose Gal + ATP Gal ~ P + ADP (épimérisation) Gal ~ P + UTP UDP-Gal + PPi UDP-Gal UDP-Glc + Pi Glc ~ 1 P + UDP galacturonate ~ P (épimérisation) UDP- galacturonate UDP-Glc ~ 1 P Mars/Avril 2010 Yves Markowicz - LAPM (CNRS UMR 5163) - Université J. Fourier 61

SOURCES DE CARBONE . . . ET ENCORE D’AUTRES SUCRES ü disaccharides : saccharose lactose maltose cellobiose ü polysaccharides : amidon glycogène cellulose pectine Mars/Avril 2010 Sac + H 2 O Glc + Fru / Sac + Pi Glc ~ 1 P + Fru Lac + H 2 O Glc + Gal Mal + H 2 O 2 Glc / Mal + Pi Glc + Glc ~ 1 P Cel + Pi Glc + Glc ~ 1 P Glcn Mal (+ maltodextrines) amylases Glcn Cel cellulases galacturonaten galactose pectinases galacturonaten galacturonate ~ 1 P Yves Markowicz - LAPM (CNRS UMR 5163) - Université J. Fourier 62

SOURCES DE CARBONE PROTEINES ET ACIDES AMINES ü protéines acides aminés protéases ü acides aminés : transaminations : AA 1 + a-cétoacide 2 a-cétoacide 1 + AA 2 Asp + a-cétoglutarate Glu + oxaloacétate Val + pyruvate Ala + 2 -cétoisovalérate désaminations : AA a-cétoacide + NH 3 Ser pyruvate + NH 3 Thr 2 -cétobutyrate + NH 3 Asp fumarate + NH 3 oxydations : Mars/Avril 2010 AA + ½ O 2 a-cétoacide + NH 3 AA + NAD+ + H 2 O a-cétoacide + NADH +H+ + NH 4+ Yves Markowicz - LAPM (CNRS UMR 5163) - Université J. Fourier 63

SOURCES DE CARBONE LIPIDES ET ACIDES GRAS ü lipides : triglycérides glycérol triacylglycérols glycérol + acides gras lipases ü acides gras : b-oxydation acyln + co. A-SH acyln-co. A (au cours du transport) acyln-co. A + co. A-SH + H 2 O + FAD + NAD+ acyln-2 -co. A + acétyl-co. A + FADH 2 + NADH + H+ ü glycérol + ATP + NAD+ dihydroxyacétone ~ P + ADP + NADH + H+ Mars/Avril 2010 Yves Markowicz - LAPM (CNRS UMR 5163) - Université J. Fourier 64
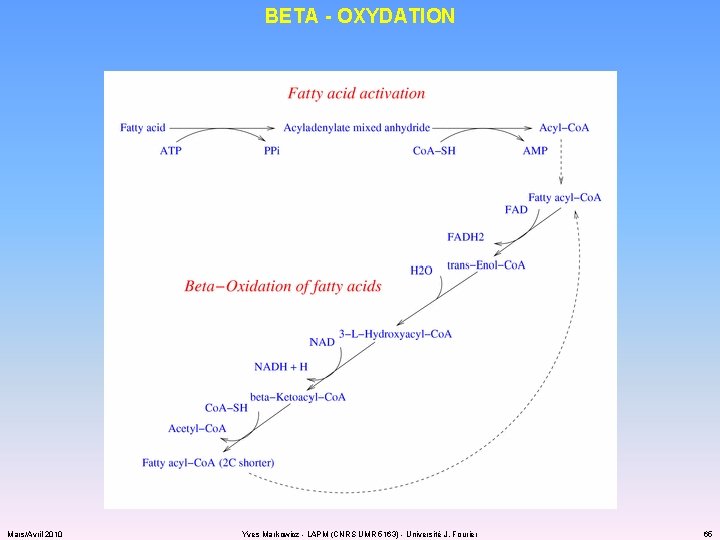
BETA - OXYDATION Mars/Avril 2010 Yves Markowicz - LAPM (CNRS UMR 5163) - Université J. Fourier 65

SOURCES DE CARBONE ET ENCORE… ü acides organiques acétate + co. A-SH + ATP acétyl-co. A + AMP + PPi propionate + co. A-SH + ATP propionyl-co. A + AMP + Ppi propionyl-co. A + H 2 O pyruvate + co. A-SH propionyl-co. A + CO 2 + ATP succinyl-co. A 2 lactate propionate + acétate / lactate + acétate butyrate + CO 2 propionate + 3 H 2 O acétate + CO 2 + 3 H 2 + H+ butyrate + 2 H 2 O 2 acétate + 2 H 2 + H+ ü éthanol Gluconobacter, Acetobacter éthanol + PQQ acétaldéhyde + PQQ-H 2 acétaldéhyde + PQQ + H 2 O acétate + PQQ-H 2 Mars/Avril 2010 Yves Markowicz - LAPM (CNRS UMR 5163) - Université J. Fourier 66

SOURCES DE CARBONE … MAIS AUSSI. . . ü méthanol et méthane CH 4 + NADH + H+ + O 2 CH 3 OH + NAD+ + H 2 O méthylotrophes méthanol + PQQ CH 2 O + PQQ-H 2 CH 2 O + NAD+ + H 2 O HCOOH (formate) + NADH + H+ formate + NAD+ CO 2 + NADH + H+ ü hydrocarbures aliphatiques XXX-CH 3 + O 2 + AH 2 XXX-CH 2 OH + H 2 O + A XXX-CH 2 OH + NAD+ XXX-CHO + NADH + H+ XXX-CHO + H 2 O + NAD+ XXX-COOH + NADH + H+ XXX-COOH b-oxydation. . . (A + NADH + H+ AH 2 + NAD+) pseudomonades, nocardiformes, mycobactéries, . . . Mars/Avril 2010 Yves Markowicz - LAPM (CNRS UMR 5163) - Université J. Fourier 67

SOURCES DE CARBONE … ET ENFIN (QUOIQUE. . . ) ü aromatiques Phe Tyr homogentisate fumarate + acétoacétate toluène catéchol (id. pour Trp, benzène, naphtalène, phénol, …) catéchol succinate + acétyl-co. A ou catéchol pyruvate + acétaldéhyde + formate vanillate protocatéchuate (id. pour shikimate, benzoate, …) protocatéchuate succinate + acétyl-co. A + CO 2 ou protocatéchuate 2 pyruvate + formate Pseudomonades (Ralstonia, Burkholderia, …) Mars/Avril 2010 Yves Markowicz - LAPM (CNRS UMR 5163) - Université J. Fourier 68
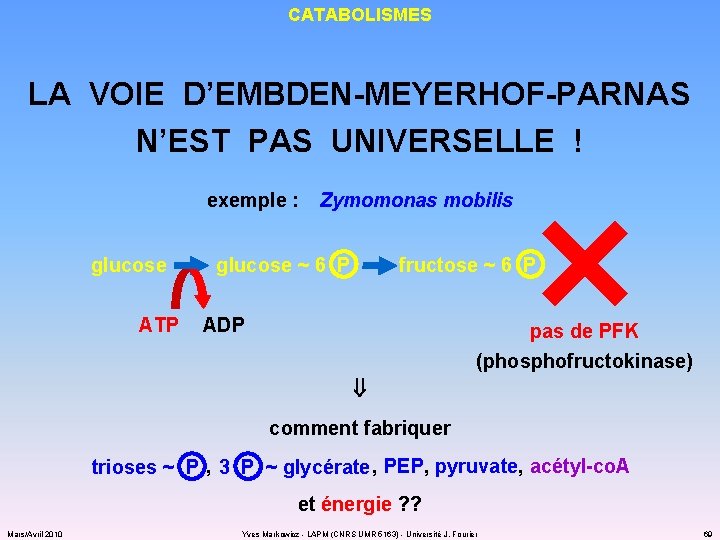
CATABOLISMES LA VOIE D’EMBDEN-MEYERHOF-PARNAS N’EST PAS UNIVERSELLE ! exemple : glucose ATP Zymomonas mobilis glucose ~ 6 P fructose ~ 6 P ADP pas de PFK (phosphofructokinase) comment fabriquer , PEP, pyruvate, acétyl-co. A trioses ~ P 3 P ~ glycérate et énergie ? ? Mars/Avril 2010 Yves Markowicz - LAPM (CNRS UMR 5163) - Université J. Fourier 69
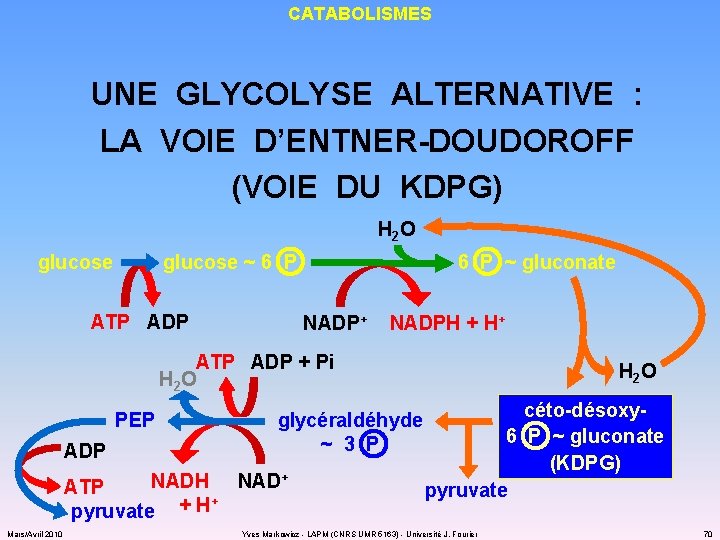
CATABOLISMES UNE GLYCOLYSE ALTERNATIVE : LA VOIE D’ENTNER-DOUDOROFF (VOIE DU KDPG) H 2 O glucose ~ 6 P ATP ADP 6 P ~ gluconate NADP+ NADPH + H+ ATP ADP + Pi H 2 O PEP ADP glycéraldéhyde ~ 3 P NADH NAD+ ATP + pyruvate + H Mars/Avril 2010 H 2 O céto-désoxy 6 P ~ gluconate (KDPG) pyruvate Yves Markowicz - LAPM (CNRS UMR 5163) - Université J. Fourier 70

CATABOLISMES LA VOIE D’ENTNER-DOUDOROFF EST MOINS ENERGETIQUE LA VOIE EMP… Glucose + (ADP + Pi) + NAD+ + NADP+ 2 pyruvate + H 2 O + ATP + NADH + H+ + NADPH + H+ Mars/Avril 2010 Yves Markowicz - LAPM (CNRS UMR 5163) - Université J. Fourier 71

CATABOLISMES LA VOIE D’ENTNER-DOUDOROFF EST MOINS ENERGETIQUE LA VOIE EMP… Glucose + (ADP + Pi) + 3 NAD+ + NADP+ + 2 co. A-SH 2 acétyl-co. A + 2 CO 2 + H 2 O + ATP + 3 (NADH + H+) + NADPH + H+ Mars/Avril 2010 Yves Markowicz - LAPM (CNRS UMR 5163) - Université J. Fourier 72
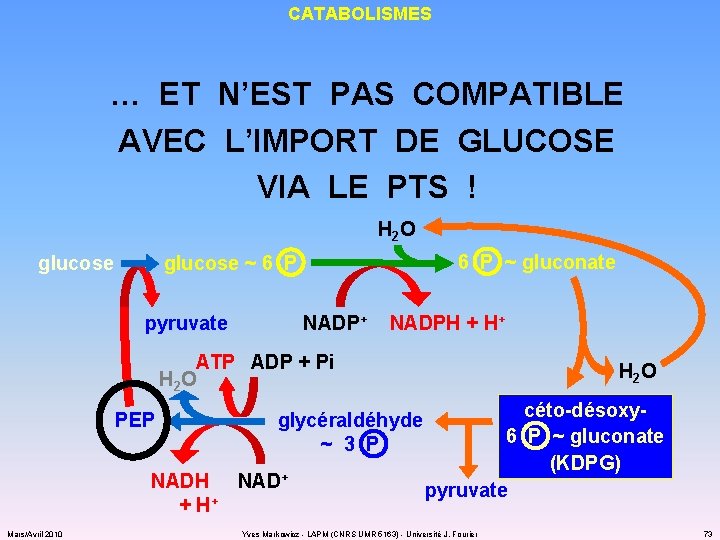
CATABOLISMES … ET N’EST PAS COMPATIBLE AVEC L’IMPORT DE GLUCOSE VIA LE PTS ! H 2 O glucose 6 P ~ gluconate glucose ~ 6 P pyruvate NADP+ NADPH + H+ ATP ADP + Pi H 2 O PEP glycéraldéhyde ~ 3 P NADH NAD+ + H+ Mars/Avril 2010 H 2 O céto-désoxy 6 P ~ gluconate (KDPG) pyruvate Yves Markowicz - LAPM (CNRS UMR 5163) - Université J. Fourier 73

CATABOLISMES CATABOLISME DES SUCRES : DIFFERENTES STRATEGIES Mars/Avril 2010 Yves Markowicz - LAPM (CNRS UMR 5163) - Université J. Fourier 74

CATABOLISMES RE-OXYDER LES COENZYMES REDUITS : SPECIFICITES BACTERIENNES ü système de transport (membranaire) des électrons (STE) : un complexe, donc une sortie de protons, en moins chez les bactéries, c’est moins énergétique ! 2 ATP par NAD(P)H + H+ ré-oxydé - 1 ATP par FADH 2 ré-oxydé ü de nombreuses bactéries sont capables de suppléer à l’absence d’oxygène en sortie du STE respirations anaérobies (accepteur d’électrons alternatif) fermentations (pas d’accepteur final d’électrons) Mars/Avril 2010 Yves Markowicz - LAPM (CNRS UMR 5163) - Université J. Fourier 75
CATABOLISMES BACTERIES ET OXYGENE Mars/Avril 2010 Yves Markowicz - LAPM (CNRS UMR 5163) - Université J. Fourier 76
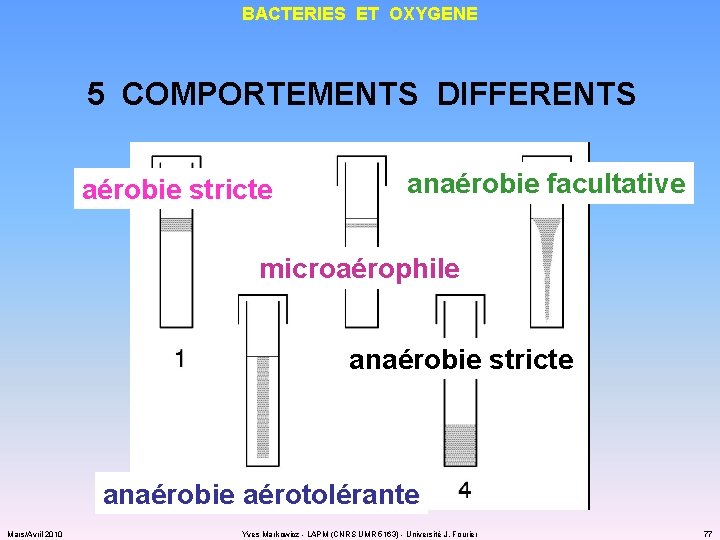
BACTERIES ET OXYGENE 5 COMPORTEMENTS DIFFERENTS aérobie stricte anaérobie facultative microaérophile anaérobie stricte anaérobie aérotolérante Mars/Avril 2010 Yves Markowicz - LAPM (CNRS UMR 5163) - Université J. Fourier 77

BACTERIES ET OXYGENE POURQUOI CES DIFFERENCES DE COMPORTEMENT ? ü deux enzymes clés : superoxyde dismutase (SOD) 2 O 2 - + 2 H+ H 2 O 2 + O 2 catalase 2 H 2 O 2 H 2 O + O 2 ü aucune des deux enzymes : anaérobie strictes Mars/Avril 2010 ü les deux enzymes : aérobie strictes anaérobie facultatives microaérophiles ü seulement la SOD : anaérobie aérotolérantes Yves Markowicz - LAPM (CNRS UMR 5163) - Université J. Fourier 78
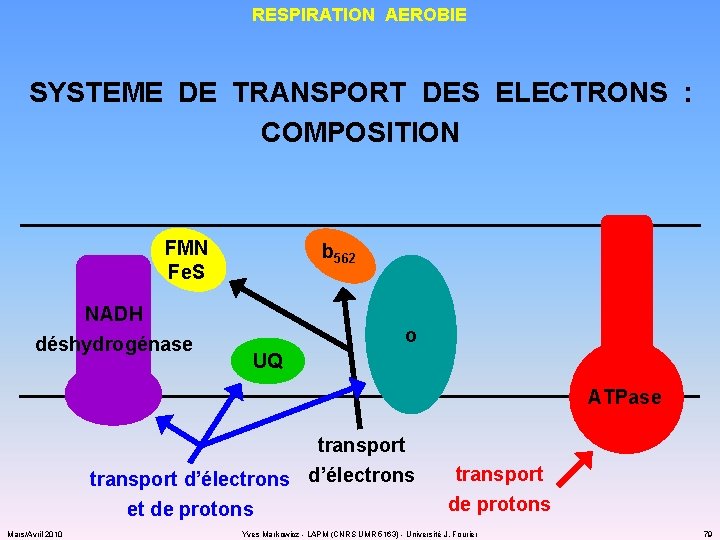
RESPIRATION AEROBIE SYSTEME DE TRANSPORT DES ELECTRONS : COMPOSITION FMN Fe. S NADH déshydrogénase b 562 o UQ ATPase transport d’électrons et de protons Mars/Avril 2010 transport de protons Yves Markowicz - LAPM (CNRS UMR 5163) - Université J. Fourier 79
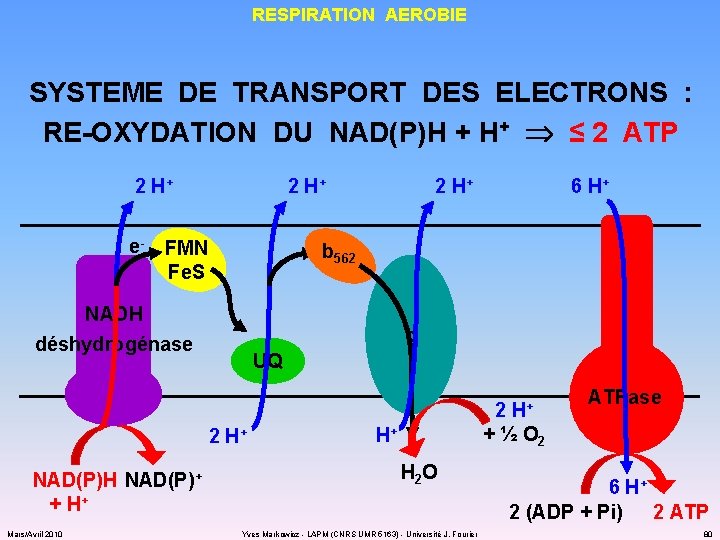
RESPIRATION AEROBIE SYSTEME DE TRANSPORT DES ELECTRONS : RE-OXYDATION DU NAD(P)H + H+ ≤ 2 ATP 2 H+ e- 2 H+ FMN Fe. S 2 H+ 6 H+ b 562 NADH déshydrogénase o UQ 2 H+ NAD(P)H NAD(P)+ + H+ Mars/Avril 2010 ATPase + ½ O 2 H+ H 2 O Yves Markowicz - LAPM (CNRS UMR 5163) - Université J. Fourier 6 H+ 2 (ADP + Pi) 2 ATP 80
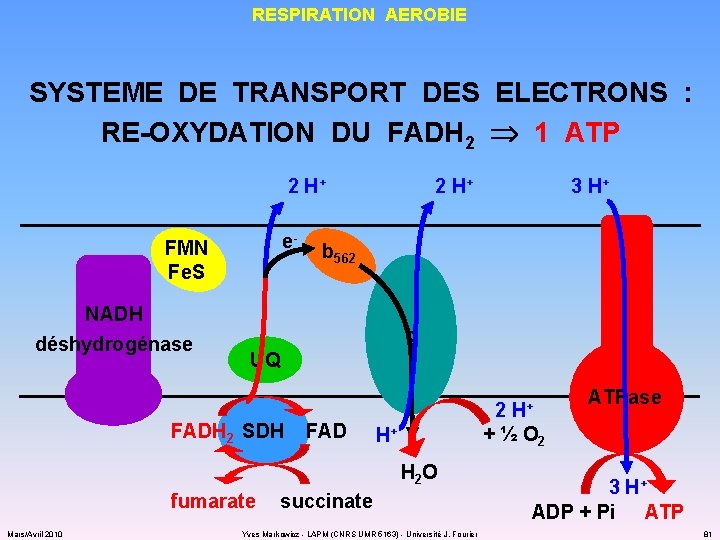
RESPIRATION AEROBIE SYSTEME DE TRANSPORT DES ELECTRONS : RE-OXYDATION DU FADH 2 1 ATP 2 H+ e- FMN Fe. S NADH déshydrogénase 2 H+ b 562 o UQ FADH 2 SDH FAD 2 H+ fumarate ATPase + ½ O 2 H+ H 2 O Mars/Avril 2010 3 H+ succinate Yves Markowicz - LAPM (CNRS UMR 5163) - Université J. Fourier 3 H+ ADP + Pi ATP 81
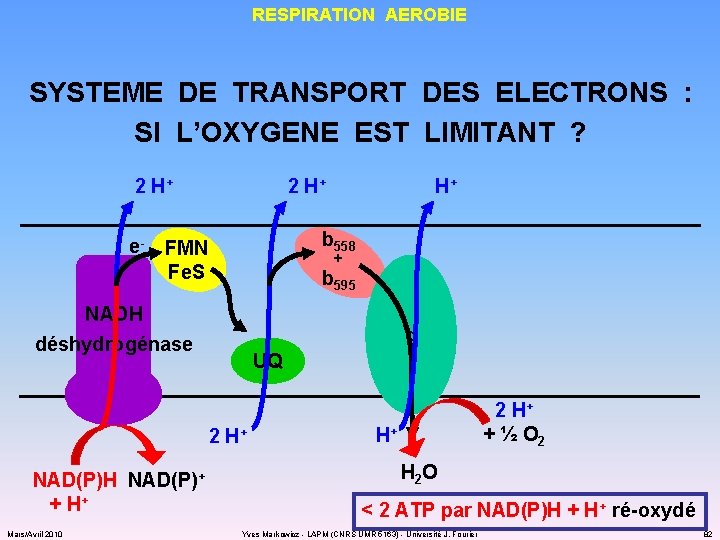
RESPIRATION AEROBIE SYSTEME DE TRANSPORT DES ELECTRONS : SI L’OXYGENE EST LIMITANT ? 2 H+ e- 2 H+ b 558 b 562 + b 595 FMN Fe. S NADH déshydrogénase d o UQ 2 H+ NAD(P)H NAD(P)+ + H+ Mars/Avril 2010 H+ 2 H+ + ½ O 2 H+ H 2 O < 2 ATP par NAD(P)H + H+ ré-oxydé Yves Markowicz - LAPM (CNRS UMR 5163) - Université J. Fourier 82

CATABOLISMES SYSTEME DE TRANSPORT DES ELECTRONS : S’IL N’Y A PAS D’OXYGENE ? ? ? ü il y a un autre accepteur d’électrons utilisable respiration anaérobie ü il y n’a pas d’accepteur d’électrons (utilisable) fermentation Mars/Avril 2010 Yves Markowicz - LAPM (CNRS UMR 5163) - Université J. Fourier 83

RESPIRATIONS ANAEROBIE LES RESPIRATIONS ANAEROBIES CHEZ ESCHERICHIA COLI ü pas d’oxygène mais du nitrate : respiration sur nitrate ü même en présence d’oxygène : respiration sur nitrite ü respiration sur sulfate ü respirations « exotiques » Mars/Avril 2010 Yves Markowicz - LAPM (CNRS UMR 5163) - Université J. Fourier 84
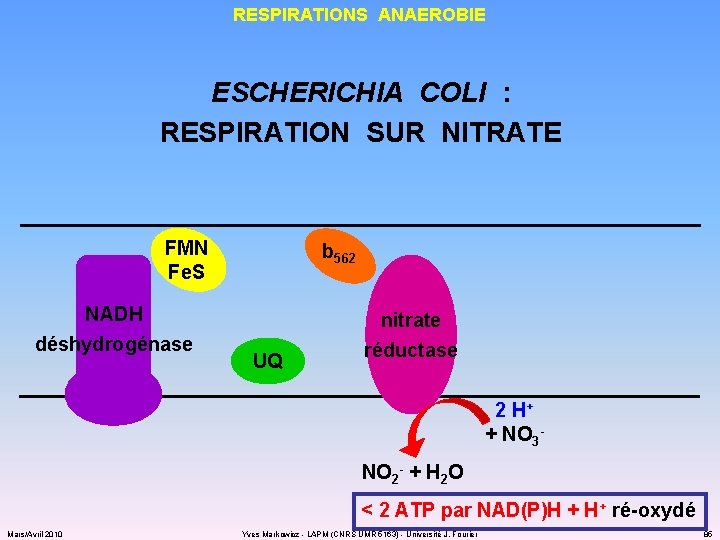
RESPIRATIONS ANAEROBIE ESCHERICHIA COLI : RESPIRATION SUR NITRATE FMN Fe. S NADH déshydrogénase b 562 UQ nitrate réductase 2 H+ + NO 3 NO 2 - + H 2 O < 2 ATP par NAD(P)H + H+ ré-oxydé Mars/Avril 2010 Yves Markowicz - LAPM (CNRS UMR 5163) - Université J. Fourier 85
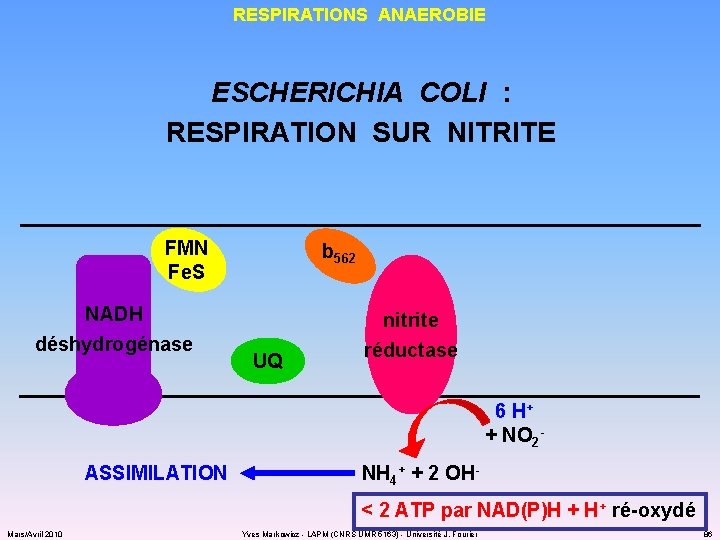
RESPIRATIONS ANAEROBIE ESCHERICHIA COLI : RESPIRATION SUR NITRITE FMN Fe. S NADH déshydrogénase b 562 UQ nitrite réductase 6 H+ + NO 2 - ASSIMILATION NH 4+ + 2 OH< 2 ATP par NAD(P)H + H+ ré-oxydé Mars/Avril 2010 Yves Markowicz - LAPM (CNRS UMR 5163) - Université J. Fourier 86

RESPIRATIONS ANAEROBIE ESCHERICHIA COLI : RESPIRATION SUR SULFATE sulfate + ATP adénosine phosulfate (APS) + PPi + ATP phospho-adénosine phosulfate (PAPS) + ADP PAPS + H 2 O + 2 R-(SH)2 SO 32 - + RS 2 + AMP-3’-phosphate (thiorédoxine) SO 32 - + 3 (NADPH + H+) S 2 - + 3 H 2 O + 3 NADP+ S 2 - + 2 H+ + o-acétyl-L-Ser acétate + L-Cys Mars/Avril 2010 Yves Markowicz - LAPM (CNRS UMR 5163) - Université J. Fourier ASSIMILATION 87

RESPIRATIONS ANAEROBIE DES RESPIRATIONS « EXOTIQUES » ü respiration sur fumarate : fumarate + 2 H+ + 2 e- succinate (!) = ü respiration sur diméthylsulfoxyde : DMSO + 2 H+ + 2 e- diméthylsulfide + H 2 O H 3 C - S - CH 3 O Mars/Avril 2010 - - - ü respiration sur triméthylamine-N-oxyde : TMAO + 2 H+ + 1 e- triméthylamine + H 2 O CH 3 H 3 C - N - CH 3 OYves Markowicz - LAPM (CNRS UMR 5163) - Université J. Fourier 88
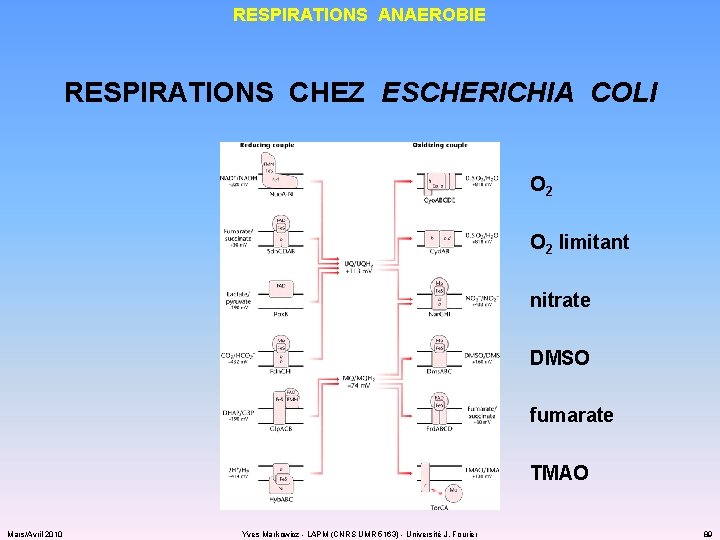
RESPIRATIONS ANAEROBIE RESPIRATIONS CHEZ ESCHERICHIA COLI O 2 limitant nitrate DMSO fumarate TMAO Mars/Avril 2010 Yves Markowicz - LAPM (CNRS UMR 5163) - Université J. Fourier 89

RESPIRATIONS ANAEROBIE D’AUTRES RESPIRATIONS ANAEROBIES ü dénitrification (dissimilation) Pseudomonas stutzeri, Bacillus licheniformis, Paracoccus denitrificans ü respiration sur sulfate (dissimilation) Desulfovibrio ü respiration sur sulfure (dissimilation) Desulfuromonas ü respiration sur fer Bacillus, Pseudomonas ü respiration sur carbonate ü méthanogénèse Mars/Avril 2010 Clostridium, Acetobacterium méthanogènes (Archaea) Yves Markowicz - LAPM (CNRS UMR 5163) - Université J. Fourier 90

RESPIRATIONS ANAEROBIE DENITRIFICATION 2 NO 3 - + 4 H+ + 4 e- 2 NO 2 - + 2 H 2 O nitrate réductase 2 NO 2 - + 6 H+ + 4 e- N 2 O + 3 H 2 O nitrite réductase NO 2 - + 2 H+ + X-Fe 2+ − N≡O+ + H 2 O NO 2 - + X-Fe 2+ − N≡O+ X-Fe 2+ − N+=O l -O− N=O - + 2 e X-Fe 2+ − N− OX-Fe 2+ − N+=O ll l -O − N− O- -O− N=O 2+ − N− O+ + 2 e- N O + 2 H O + X-Fe 2+ X-Fe + 4 H 2 2 ll -O − N− O N 2 O + 2 H+ + 2 e- N 2 + H 2 O Mars/Avril 2010 Yves Markowicz - LAPM (CNRS UMR 5163) - Université J. Fourier N 2 O réductase 91
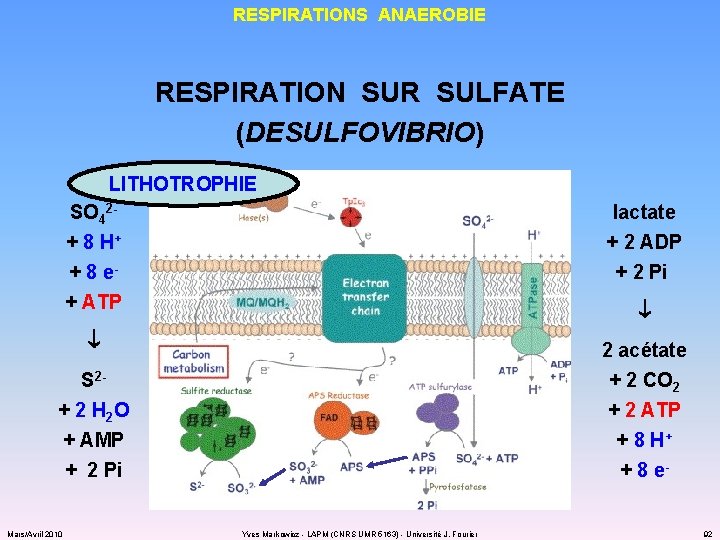
RESPIRATIONS ANAEROBIE RESPIRATION SUR SULFATE (DESULFOVIBRIO) LITHOTROPHIE SO 42+ 8 H+ lactate + 2 ADP + 8 e+ ATP + 2 Pi 2 acétate + 2 CO 2 + 2 ATP + 8 H+ + 8 e- S 2+ 2 H 2 O + AMP + 2 Pi Mars/Avril 2010 Yves Markowicz - LAPM (CNRS UMR 5163) - Université J. Fourier 92

RESPIRATIONS ANAEROBIE RESPIRATION SUR SOUFRE (DESULFUROMONAS ACETOXIDANS) oxydation de molécules organiques H+ + e----------S 0 + 2 H+ + 2 e H 2 S Mars/Avril 2010 Yves Markowicz - LAPM (CNRS UMR 5163) - Université J. Fourier 93

RESPIRATIONS ANAEROBIE RESPIRATION SUR SOUFRE (DESULFUROMONAS ACETOXIDANS) Electrode-Reducing Microorganisms That Harvest Energy from Marine Sediments Bond et al. (2002) Science 295: 483 -485 Mars/Avril 2010 Yves Markowicz - LAPM (CNRS UMR 5163) - Université J. Fourier 94

RESPIRATIONS ANAEROBIE RESPIRATION SUR SOUFRE ET CHATEAUX DE SABLE. . . Mars/Avril 2010 Yves Markowicz - LAPM (CNRS UMR 5163) - Université J. Fourier 95
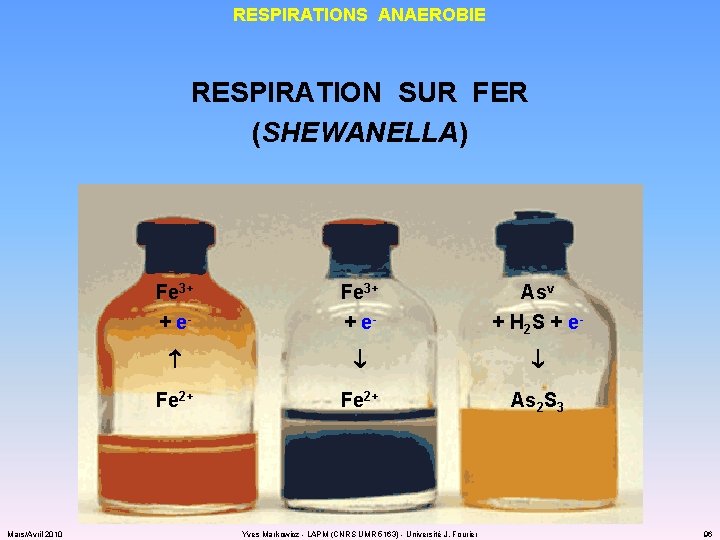
RESPIRATIONS ANAEROBIE RESPIRATION SUR FER (SHEWANELLA) Mars/Avril 2010 Fe 3+ + e- Asv + H 2 S + e- Fe 2+ As 2 S 3 Yves Markowicz - LAPM (CNRS UMR 5163) - Université J. Fourier 96

RESPIRATIONS ANAEROBIE RESPIRATION SUR FER (SHEWANELLA) Mars/Avril 2010 Yves Markowicz - LAPM (CNRS UMR 5163) - Université J. Fourier 97

RESPIRATIONS ANAEROBIE RESPIRATION SUR CARBONATE (ACETOGENES) 2 CO 2 + 8 H+ + 8 e- CH 3 COOH + 2 H 2 O (2 HCO 3 -) 4 H 2 LITHOTROPHIE Clostridium aceticum Desulfosporosinus orientis Mars/Avril 2010 Yves Markowicz - LAPM (CNRS UMR 5163) - Université J. Fourier 98
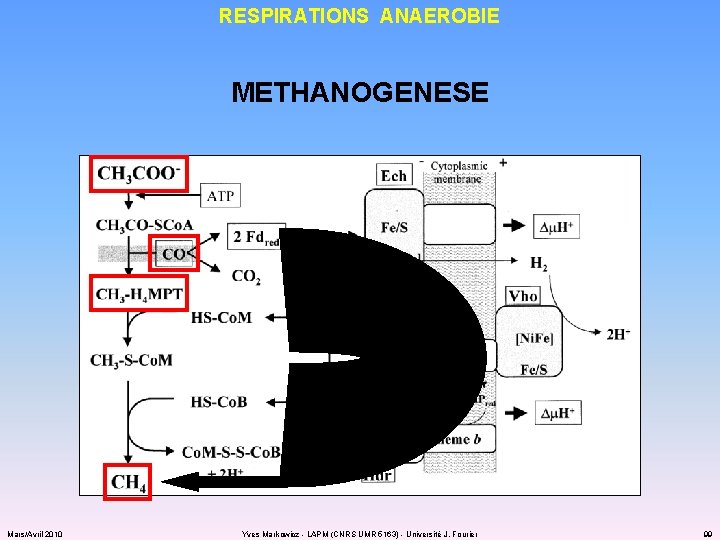
RESPIRATIONS ANAEROBIE METHANOGENESE Mars/Avril 2010 Yves Markowicz - LAPM (CNRS UMR 5163) - Université J. Fourier 99
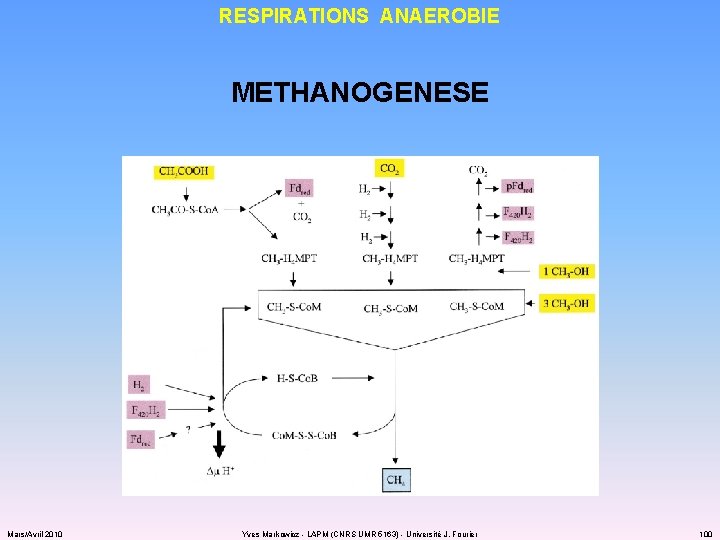
RESPIRATIONS ANAEROBIE METHANOGENESE Mars/Avril 2010 Yves Markowicz - LAPM (CNRS UMR 5163) - Université J. Fourier 100

RESPIRATIONS ANAEROBIE POURQUOI L’OXYGENE EST-IL L’ACCEPTEUR D’ELECTRONS PREFERENTIEL ? ü les formes réduite (H 2 O) et oxydée (O 2) diffusent librement à travers l’enveloppe ü la forme oxydée est (presque) toujours biodisponible ü la forme réduite n’est pas toxique ü le couple O 2 / H 2 O a le potentiel rédox le plus élevé (après le couple N 2 / N 2 O) Mars/Avril 2010 Yves Markowicz - LAPM (CNRS UMR 5163) - Université J. Fourier 101

RESPIRATIONS ANAEROBIE A PROPOS DE POTENTIELS REDOX. . . Mars/Avril 2010 forme oxydée forme réduite E’ 0 (m. V) SO 42 - HSO 3 - - 516 NAD(P)+ FAD HSO 3 fumarate 2 quinone TMAO DMSO NO 2 NO 3½ O 2 NAD(P)H + H+ FADH 2 HSsuccinate 2 quinone-H 2 triméthylamine diméthylsulfate NO NO 2 H 2 O - 320 - 220 - 116 + 33 + 100 + 130 + 160 + 360 + 421 + 815 Yves Markowicz - LAPM (CNRS UMR 5163) - Université J. Fourier 102

RESPIRATIONS ANAEROBIE D’AUTRES POTENTIELS REDOX. . . Mars/Avril 2010 forme oxydée forme réduite E’ 0 (m. V) 2 H+ H 2 - 410 ferrédoxine oxydée HS 2 O 3 CO 2 S 0 CO 2 acétaldéhyde pyruvate HSO 3 Fe 3+ N 2 O ferrédoxine réduite H 2 S + HSO 3 acétate. HSCH 4 éthanol lactate. S 0 Fe 2+ N 2 - 432 - 412 - 290 - 270 - 240 - 197 - 185 - 38 + 771 + 1360 Yves Markowicz - LAPM (CNRS UMR 5163) - Université J. Fourier 103

RESPIRATIONS ANAEROBIE POURQUOI RESPIRER L’OXYGENE EST PLUS ENERGETIQUE forme oxydée forme réduite E’ 0 (m. V) SO 42 - SO 32 - + H 2 O - 516 NAD(P)H + H+ FADH 2 HSsuccinate 2 triméthylamine diméthylsulfate NO NO 2 H 2 O - 320 - 220 - 116 + 33 + 130 + 160 + 360 + 421 + 815 NAD(P)+ FAD HSO 3 fumarate 2 TMNO DMSO NO 2 NO 3½ O 2 Mars/Avril 2010 - 320 815 - (- 320) = 1135 +815 Yves Markowicz - LAPM (CNRS UMR 5163) - Université J. Fourier 104

RESPIRATIONS ANAEROBIE POURQUOI RESPIRER L’OXYGENE EST PLUS ENERGETIQUE Mars/Avril 2010 forme oxydée forme réduite E’ 0 (m. V) SO 42 - SO 32 - + H 2 O - 516 NAD(P)+ FAD HSO 3 fumarate 2 TMNO DMSO NO 2 NO 3½ O 2 NAD(P)H + H+ FADH 2 HSsuccinate 2 triméthylamine diméthylsulfate NO NO 2 H 2 O - 320 - 220 - 116 + 33 + 130 + 160 + 360 + 421 + 815 - 220 815 - (- 220) = 1035 + 815 Yves Markowicz - LAPM (CNRS UMR 5163) - Université J. Fourier 105

RESPIRATIONS ANAEROBIE POURQUOI RESPIRER L’OXYGENE EST PLUS ENERGETIQUE forme oxydée forme réduite E’ 0 (m. V) SO 42 - SO 32 - + H 2 O - 516 NAD(P)H + H+ FADH 2 HSsuccinate 2 triméthylamine diméthylsulfate NO NO 2 H 2 O - 320 - 220 - 116 + 33 + 130 + 160 + 360 + 421 + 815 NAD(P)+ FAD HSO 3 fumarate 2 TMNO DMSO NO 2 NO 3½ O 2 Mars/Avril 2010 - 836 ! - 320 421 - (- 320) = 741 + 421 Yves Markowicz - LAPM (CNRS UMR 5163) - Université J. Fourier + 204 106

CATABOLISMES ET S’IL N’Y A AUCUN ACCEPTEUR D’ELECTRONS ? ? ü les coenzymes réduits ne peuvent plus être ré-oxydés et s’accumulent dans le cytoplasme : il faut arrêter d’en produire ! ü blocage du cycle de Krebs : inhibitions allostériques successives a-cétoglutarate déshydrogénase (NADH + H+, succinyl-co. A) citrate synthase (NADH + H+, a-cétoglutarate) ü effets allostériques au niveau du couple PEP / pyruvate déshydrogénase (acétyl-co. A, NADH + H+ : effecteurs négatifs) PEP carboxylase (acétyl-co. A : effecteur positif) ü activation / répression de régulateurs de l’expression des gènes Mars/Avril 2010 Yves Markowicz - LAPM (CNRS UMR 5163) - Université J. Fourier 107
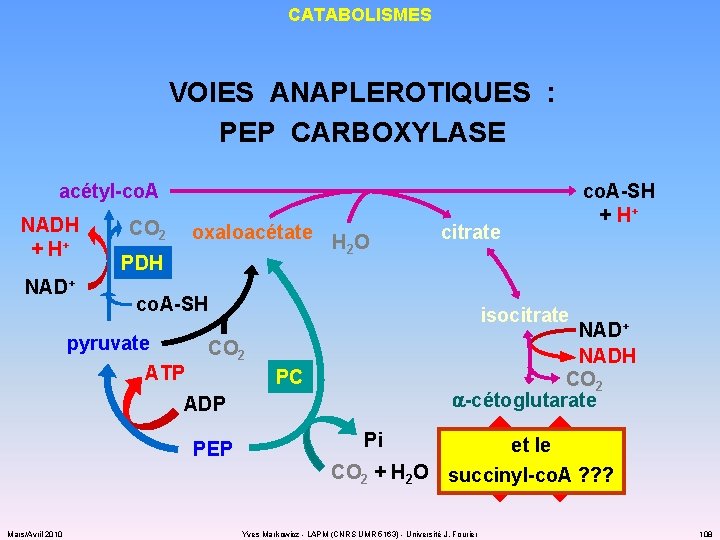
CATABOLISMES VOIES ANAPLEROTIQUES : PEP CARBOXYLASE acétyl-co. A NADH + H+ NAD+ CO 2 PDH oxaloacétate H O 2 co. A-SH pyruvate ATP isocitrate NAD+ NADH CO 2 a-cétoglutarate CO 2 PC ADP PEP Mars/Avril 2010 citrate co. A-SH + H+ Pi et le CO 2 + H 2 O succinyl-co. A ? ? ? Yves Markowicz - LAPM (CNRS UMR 5163) - Université J. Fourier 108
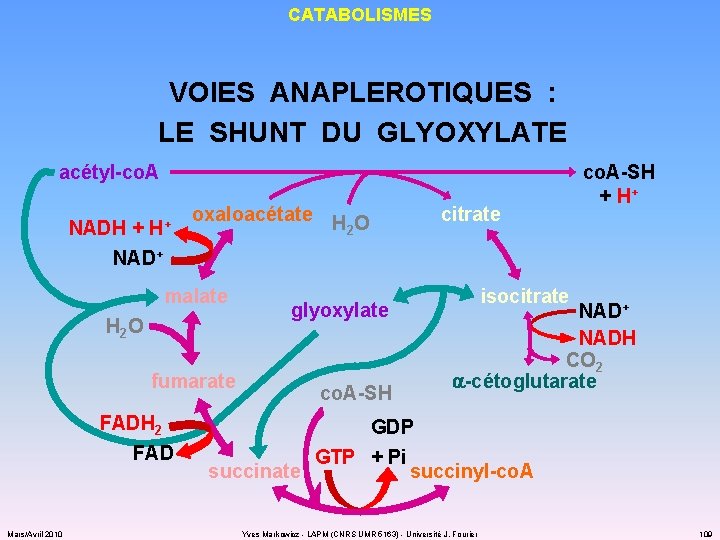
CATABOLISMES VOIES ANAPLEROTIQUES : LE SHUNT DU GLYOXYLATE acétyl-co. A NADH + H+ NAD+ oxaloacétate H O 2 malate H 2 O fumarate FADH 2 FAD Mars/Avril 2010 glyoxylate co. A-SH citrate co. A-SH + H+ isocitrate NAD+ NADH CO 2 a-cétoglutarate GDP GTP + Pi succinate succinyl-co. A Yves Markowicz - LAPM (CNRS UMR 5163) - Université J. Fourier 109

CATABOLISMES QUID DES COENZYMES REDUITS PRODUITS (AU COURS DE LA GLYCOLYSE) ? utilisation de pyruvate ou de ses dérivés substrats destinés à être réduits (via la ré-oxydation des coenzymes) = FERMENTATIONS Xox + NADH + H+ → Xréd + NAD+ le seul ATP produit l’est par phosphorylation au niveau du substrat Mars/Avril 2010 Yves Markowicz - LAPM (CNRS UMR 5163) - Université J. Fourier 110

CATABOLISMES PHOSPHORYLATIONS AU NIVEAU DU SUBSTRAT X~ P + ADP X + ATP 3 P ~ glycérate + ATP (glycolyse) 1, 3 -bisphoglycérate + ADP PEP + ADP pyruvate + ATP (glycolyse) acétyl-phosphate + ADP acétate + ATP butyryl-phosphate + ADP butyrate + ATP Mars/Avril 2010 (acétogenèse) (fermentation butyrique) Yves Markowicz - LAPM (CNRS UMR 5163) - Université J. Fourier 111

FERMENTATIONS Mars/Avril 2010 Yves Markowicz - LAPM (CNRS UMR 5163) - Université J. Fourier 112

FERMENTATIONS : QUELQUES GENERALITES ü faible rendement en ATP (YATP) : < 3 ATP par glucose consommé ü mais… s’il n’y a pas d’accepteur d’électrons disponible : alternative à l’arrêt total du catabolisme ! ü strict équilibre entre oxydations et réductions ü mais… le carbone n’est que (très) partiellement assimilé ü et l’essentiel du carbone se trouve dans des produits non utilisés. . . sauf par les hommes !!! Mars/Avril 2010 Yves Markowicz - LAPM (CNRS UMR 5163) - Université J. Fourier 113

FERMENTATIONS PETITS RAPPELS : QU’Y A-T-IL A RE-OXYDER ? REDUIRE ? ü glycolyse (voie EMP) : glucose + 2 (ADP + Pi) + 2 NAD+ 2 pyruvate + 2 H 2 O + 2 ATP + 2 (NADH + H+) ü voie des pentoses phosphates : glucose + 1 H 2 O + 1 ATP + 2 NADP+ (1/3 pyruvate + 2/3 fructose ~ 6 P + 1 CO 2 + 1 ATP + 2 (NADPH + H+) ü voie d’Entner-Doudoroff : glucose + 1 (ADP + Pi) + NAD+ + NADP+ 2 pyruvate + ATP + 1 (NADH + H+) + 1 (NADPH + H+) Mars/Avril 2010 Yves Markowicz - LAPM (CNRS UMR 5163) - Université J. Fourier 114
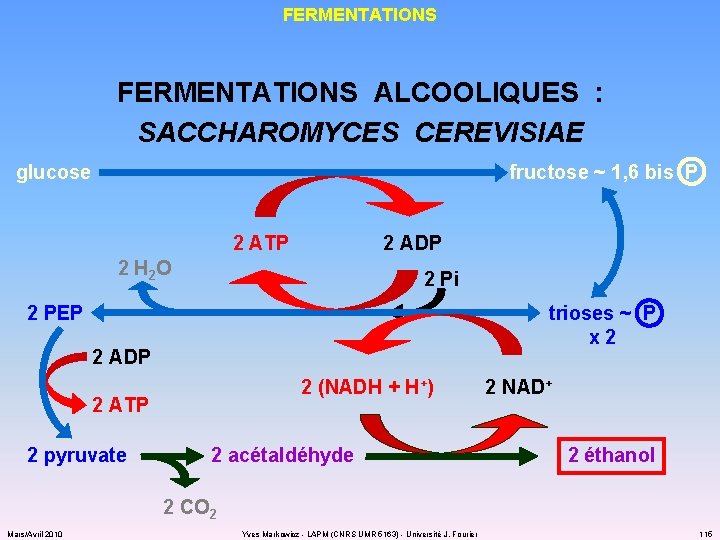
FERMENTATIONS ALCOOLIQUES : SACCHAROMYCES CEREVISIAE glucose fructose ~ 1, 6 bis P 2 ATP 2 ADP 2 H 2 O 2 Pi 2 PEP trioses ~ P x 2 2 ADP 2 (NADH + H+) 2 ATP 2 pyruvate 2 acétaldéhyde 2 NAD+ 2 éthanol 2 CO 2 Mars/Avril 2010 Yves Markowicz - LAPM (CNRS UMR 5163) - Université J. Fourier 115
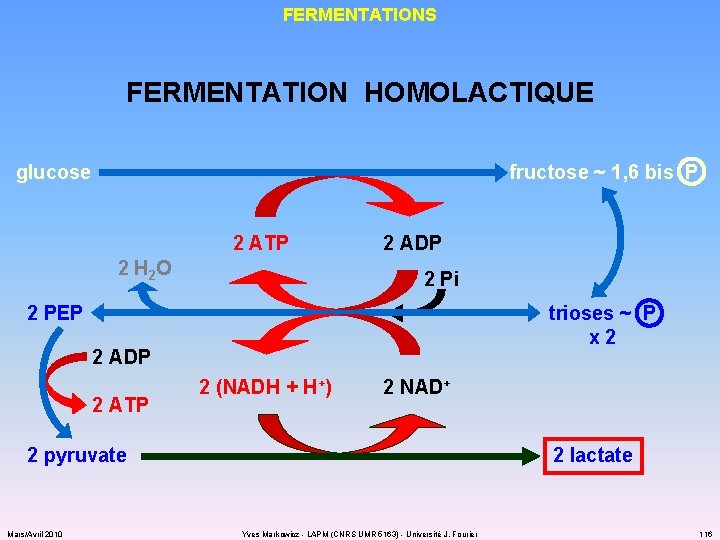
FERMENTATIONS FERMENTATION HOMOLACTIQUE glucose fructose ~ 1, 6 bis P 2 ATP 2 H 2 O 2 ADP 2 Pi 2 PEP trioses ~ P x 2 2 ADP 2 ATP 2 (NADH + H+) 2 NAD+ 2 pyruvate Mars/Avril 2010 2 lactate Yves Markowicz - LAPM (CNRS UMR 5163) - Université J. Fourier 116
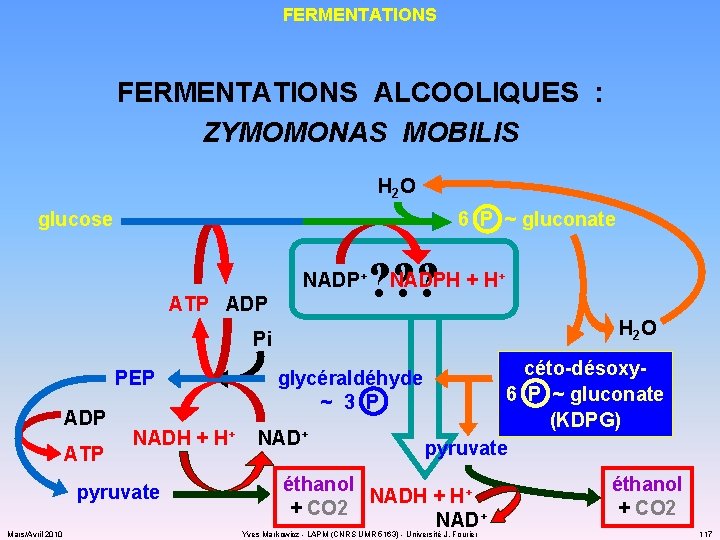
FERMENTATIONS ALCOOLIQUES : ZYMOMONAS MOBILIS H 2 O 6 P ~ gluconate glucose ? ? ? NADP+ NADPH + H+ ATP ADP H 2 O Pi PEP ADP ATP NADH + H+ NAD+ pyruvate Mars/Avril 2010 glycéraldéhyde ~ 3 P céto-désoxy 6 P ~ gluconate (KDPG) pyruvate éthanol NADH + H+ + CO 2 NAD+ Yves Markowicz - LAPM (CNRS UMR 5163) - Université J. Fourier éthanol + CO 2 117
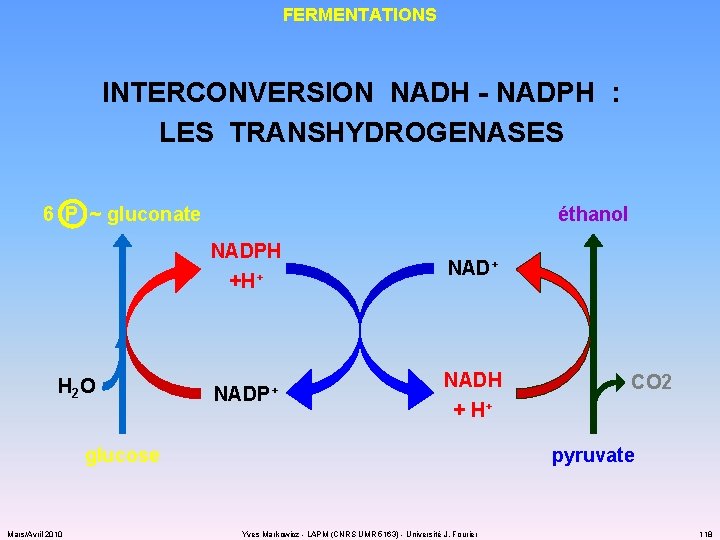
FERMENTATIONS INTERCONVERSION NADH - NADPH : LES TRANSHYDROGENASES éthanol 6 P ~ gluconate H 2 O NADPH +H+ NADP+ NADH + H+ glucose Mars/Avril 2010 CO 2 pyruvate Yves Markowicz - LAPM (CNRS UMR 5163) - Université J. Fourier 118
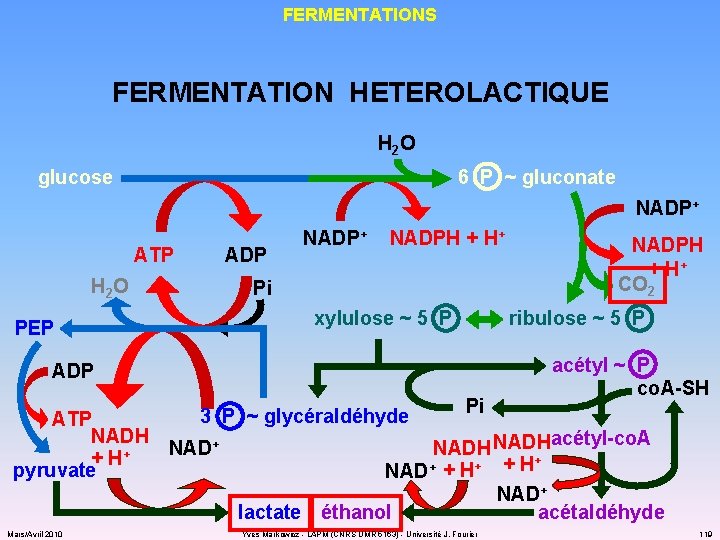
FERMENTATIONS FERMENTATION HETEROLACTIQUE H 2 O glucose 6 P ~ gluconate NADP+ ATP H 2 O PEP ADP NADP+ NADPH + H+ Pi xylulose ~ 5 P NADPH + H+ CO 2 ribulose ~ 5 P acétyl ~ P co. A-SH ADP Pi 3 P ~ glycéraldéhyde ATP NADHacétyl-co. A NAD+ + + H + pyruvate NAD+ + H NAD+ acétaldéhyde lactate éthanol Mars/Avril 2010 Yves Markowicz - LAPM (CNRS UMR 5163) - Université J. Fourier 119

FERMENTATIONS D’AUTRES FERMENTATIONS. . . ü fermentation du diacétyle Lactococcus lactis 3 citrate lactate + 3 acétate + diacétyle + 5 CO 2 ü fermentation propionique Propionibacterium 3 lactate 2 propionate + acétate + CO 2 ü fermentation butyrique Clostridium butyricum glucose butyrate + 2 CO 2 + 2 H 2 ü fermentation acéto-butanolique Clostridium acetobutylicum glucose acétone + butanol + 5 CO 2 + 4 H 2 Mars/Avril 2010 Yves Markowicz - LAPM (CNRS UMR 5163) - Université J. Fourier 120

FERMENTATIONS … ET LA FERMENTATION ACETIQUE ! (CLOSTRIDIUM - ACETOBACTERIUM) glucose + 4 ADP + 4 Pi 3 acétate + 4 ATP glucose + 2 ADP + 2 Pi 2 pyruvate + 2 ATP + 2 (NADH + H+) 2 pyruvate + 2 co. A-SH + 2 Fd 2 acétyl-co. A + 2 CO 2 + 2 Fd. H 2 2 acétyl-co. A + 2 ADP + 2 Pi 2 acétate + 2 co. A-SH + 2 ATP CO 2 + XH 2 formate + X CO 2 + XH 2 [CO] + X + H 2 O formate + ATP + THF 10 -formyl-THF + ADP + Pi 10 -formyl-THF 5, 10 -méthényl-THF + H 2 O 5, 10 -méthényl-THF + NADH + H+ 5, 10 -méthylène-THF + NAD+ 5, 10 -méthylène-THF + Fd. H 2 5 -méthyl-THF + Fd 5 -méthyl-THF + E-B 12 5 -méthyl-E-B 12 + THF 5 -méthyl-E-B 12 + [CO] + co. A-SH acétyl-co. A Mars/Avril 2010 acétyl-co. A + ADP + Pi acétate + co. A-SH + ATP Yves Markowicz - LAPM (CNRS UMR 5163) - Université J. Fourier 121
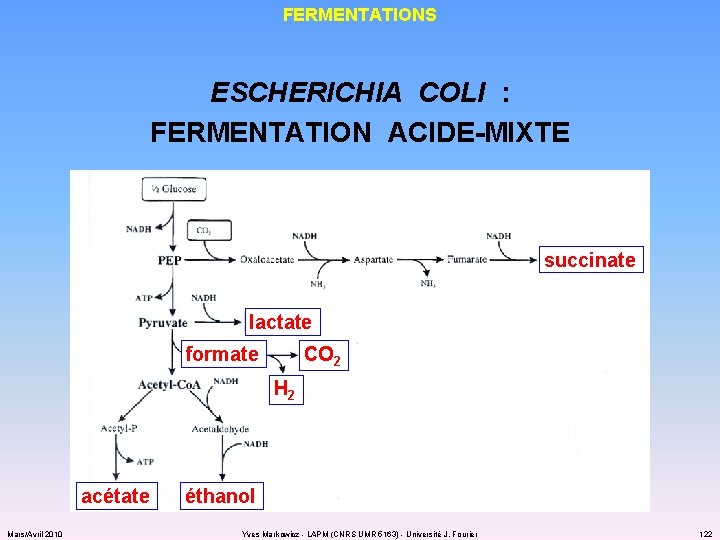
FERMENTATIONS ESCHERICHIA COLI : FERMENTATION ACIDE-MIXTE succinate lactate formate CO 2 H 2 acétate Mars/Avril 2010 éthanol Yves Markowicz - LAPM (CNRS UMR 5163) - Université J. Fourier 122
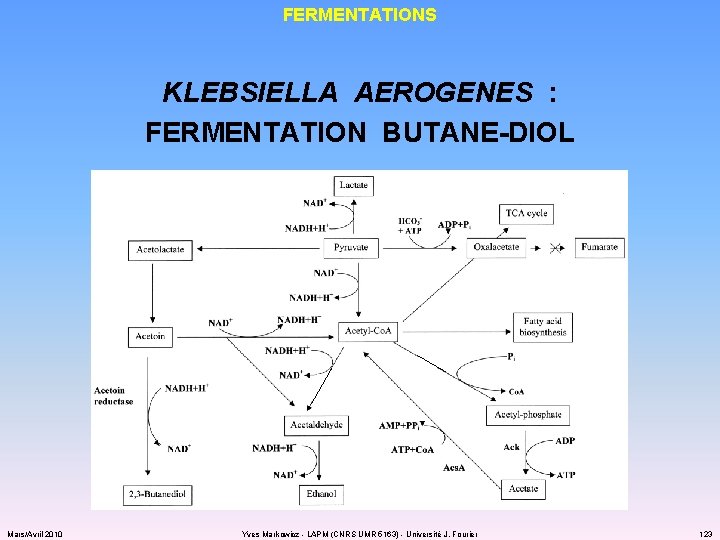
FERMENTATIONS KLEBSIELLA AEROGENES : FERMENTATION BUTANE-DIOL Mars/Avril 2010 Yves Markowicz - LAPM (CNRS UMR 5163) - Université J. Fourier 123

FERMENTATIONS ENCORE LES POTENTIELS REDOX… forme oxydée NAD(P)+ acétaldéhyde pyruvate fumarate Mars/Avril 2010 - 190 - 320 - (- 320) = - 190 + 130 forme réduite E’ 0 (m. V) NAD(P)H + H+ - 320 éthanol lactate succinate - 200 - 190 + 31 Yves Markowicz - LAPM (CNRS UMR 5163) - Université J. Fourier 124
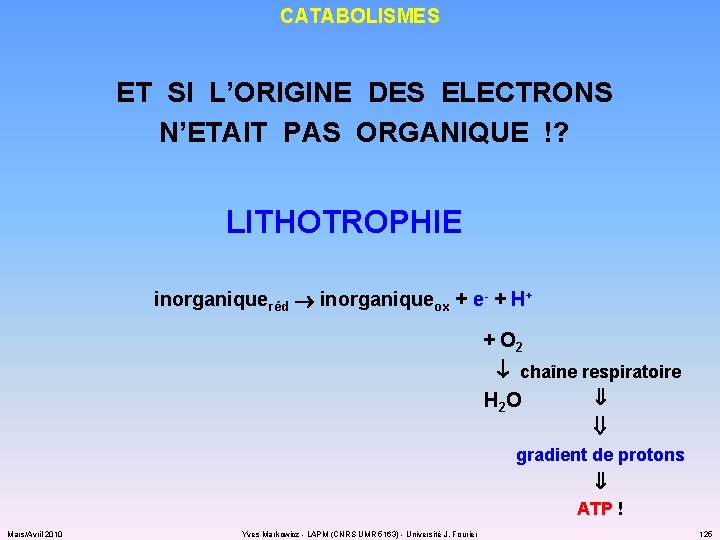
CATABOLISMES ET SI L’ORIGINE DES ELECTRONS N’ETAIT PAS ORGANIQUE !? LITHOTROPHIE inorganiqueréd inorganiqueox + e- + H+ + O 2 chaîne respiratoire H 2 O gradient de protons ATP ! Mars/Avril 2010 Yves Markowicz - LAPM (CNRS UMR 5163) - Université J. Fourier 125

LITHOTROPHIE SOURCES D’ELECTRONS INORGANIQUES ü H 2 2 H+ + 2 e- + ½ O 2 H 2 O Pseudomonas saccharophila Ralstonia eutropha ü CO + H 2 O CO 2 + 2 H+ + 2 e- + ½ O 2 H 2 O Pseudomonas carboxydovorans ü 2 Fe 2+ 2 Fe 3+ + 2 e 2 H+ + 2 e- + ½ O 2 H 2 O Thiobacillus ferrooxidans ü nitrification ü oxydation du soufre Mars/Avril 2010 Yves Markowicz - LAPM (CNRS UMR 5163) - Université J. Fourier 126
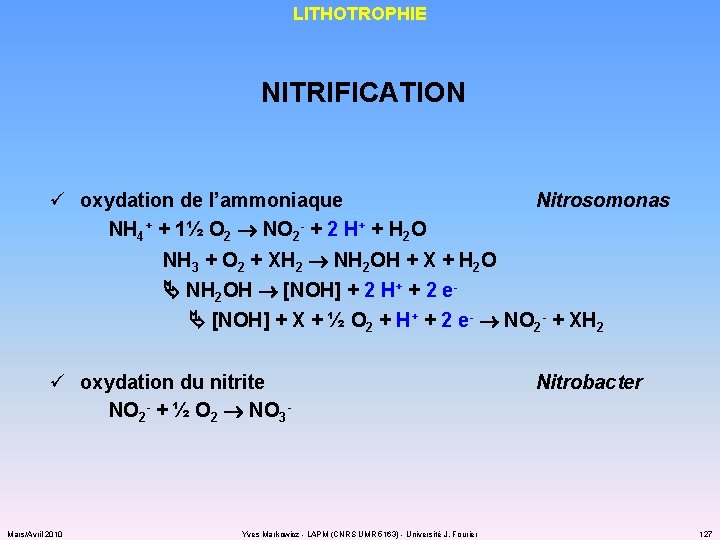
LITHOTROPHIE NITRIFICATION ü oxydation de l’ammoniaque NH 4+ + 1½ O 2 NO 2 - + 2 H+ + H 2 O Nitrosomonas NH 3 + O 2 + XH 2 NH 2 OH + X + H 2 O NH 2 OH [NOH] + 2 H+ + 2 e [NOH] + X + ½ O 2 + H + + 2 e- NO - + XH 2 2 ü oxydation du nitrite NO 2 - + ½ O 2 NO 3 - Mars/Avril 2010 Yves Markowicz - LAPM (CNRS UMR 5163) - Université J. Fourier Nitrobacter 127

LITHOTROPHIE OXYDATION DU SOUFRE ü S 2 - + 2 O 2 SO 42 S 2 - + 4 H 2 O SO 42 - + 8 H+ + 8 e- Thiobacillus S 2 - [S] + 2 e [S] + 3 H 2 O SO 32 - + 6 H+ + 4 e SO 32 - + H 2 O SO 42 - + 2 H+ + 2 e 8 H+ + 8 e- + 2 O 2 4 H 2 O ü S 0 + H 2 O + 1½ O 2 H 2 SO 4 (S 0 [S]) S 0 + 4 H 2 O SO 42 - + 8 H+ + 6 e 6 H+ + 6 e- + 1½ O 2 3 H 2 O Thiobacillus ü S 2 O 32 - + H 2 O + 2 O 2 H 2 SO 4 + SO 42 S 2 O 32 - + 5 H 2 O 2 SO 42 - + 10 H+ + 8 e 8 H+ + 8 e- + 2 O 2 4 H 2 O Thiobacillus Mars/Avril 2010 Yves Markowicz - LAPM (CNRS UMR 5163) - Université J. Fourier 128

LITHOTROPHIE OXYDATION DU SOUFRE ET PHOSPHORYLATION AU NIVEAU DU SUBTRAT S 2 - + 3 H 2 O + AMP + Pi SO 42 - + ADP + 6 H+ + 8 e. S 2 - [S] + 2 e [S] + 3 H 2 O SO 32 - + 6 H+ + 4 e SO 32 - + AMP APS + 2 e APS + Pi SO 42 - + ADP SO 42 - + 1½ O 2 3 H 2 O S 2 - + 1½ O 2 + AMP + Pi SO 42 - + ADP + 2 e. Mars/Avril 2010 Yves Markowicz - LAPM (CNRS UMR 5163) - Université J. Fourier 129

LITHOTROPHIE L’OXYDATION DU SOUFRE ET DU FER, BASE DE LA LIXIVIATION ü 2 Fe. S 2 + 7½ O 2 + H 2 O Fe 2(SO 4)3 + H 2 SO 4 ü 2 Cu. Fe. S 2 + 8½ O 2 + H 2 SO 4 Fe 2(SO 4)3 + 2 Cu. SO 4 + H 2 O ü UO 2 + Fe 2(SO 4)3 (UO 2)SO 4 + 2 Fe. SO 4 BIOX® : la lixiviation au service de l’extraction d’or (bioleaching) Mars/Avril 2010 Yves Markowicz - LAPM (CNRS UMR 5163) - Université J. Fourier 130

LITHOTROPHIE POTENTIELS REDOX : GROS PROBLEME !!! forme oxydée forme réduite E’ 0 (m. V) SO 42 - SO 32 - + H 2 O - 516 H 2 NAD(P)H + H+ FADH 2 S 0 NH 4+ NO 2 Fe 2+ H 2 O - 410 - 320 - 220 - 38 + 440 + 421 + 771 + 815 2 H+ NAD(P)+ FAD SO 32 NO 3 Fe 3+ ½ O 2 Mars/Avril 2010 - 320 - 421 -320 = - 741 815 + 421 - 421 = +815 394 Yves Markowicz - LAPM (CNRS UMR 5163) - Université J. Fourier 131

LITHOTROPHIE AUTOTROPHIE : « FIXER » LE CARBONE ü pour transformer CO 2 en carbone organique (trioses), il faut : énergie pouvoir réducteur (réduire CO 2) enzymes : cycle de Calvin OU… cycle TCA inversé ! ü l’énergie mise en jeu peut être d’origine chimique (chimiolithotrophes autotrophes) lumineuse (photolithotrophes autotrophes, photohétérotrophes organotrophes) ü le pouvoir réducteur est d’origine minérale (chimio- et photolithotrophes autotrophes) organique (photohétérotrophes organotrophes) Mars/Avril 2010 Yves Markowicz - LAPM (CNRS UMR 5163) - Université J. Fourier 132

CATABOLISMES UTILISATION DE L’ENERGIE LUMINEUSE : LES PHOTOSYNTHESES DEUX PHASES DISTINCTES lumineuse ! captage de l’énergie lumineuse (photons) par une antenne collectrice (spectre variable) + conversion de l’énergie lumineuse (photons) en énergie chimique (ATP, NADH + H+) obscure !? utilisation de l’énergie produite pour réduire (fixer) CO 2 (ou autre source de carbone) et synthétiser les constituants cellulaires Mars/Avril 2010 Yves Markowicz - LAPM (CNRS UMR 5163) - Université J. Fourier 133
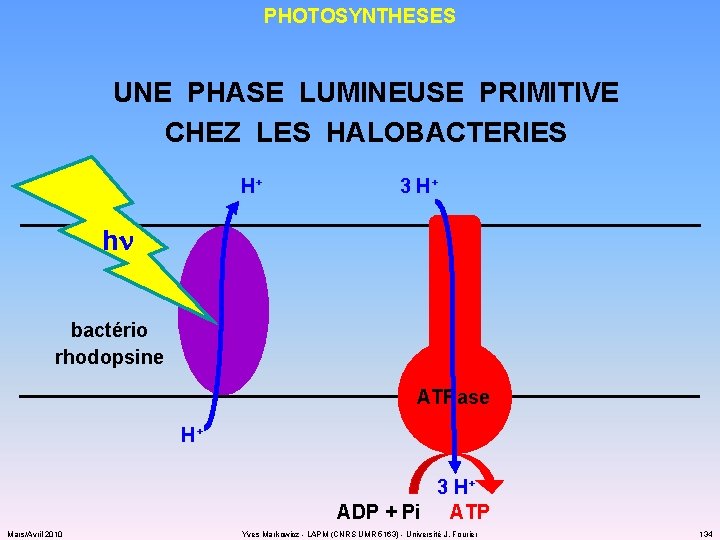
PHOTOSYNTHESES UNE PHASE LUMINEUSE PRIMITIVE CHEZ LES HALOBACTERIES H+ 3 H+ hn bactério rhodopsine ATPase H+ 3 H+ ADP + Pi ATP Mars/Avril 2010 Yves Markowicz - LAPM (CNRS UMR 5163) - Université J. Fourier 134

PHOTOSYNTHESES DES BACTERIES FRANCHEMENT ROUGES Mars/Avril 2010 Yves Markowicz - LAPM (CNRS UMR 5163) - Université J. Fourier 135

PHOTOSYNTHESES LA PHASE LUMINEUSE CHEZ LES BACTERIES PHOTOSYNTHETIQUES : PRINCIPES GENERAUX ü l’ATP est généré presque exclusivement par photophosphorylation ü le pouvoir réducteur provient de sources d’électrons variables bactéries sulfureuses bactéries non sulfureuses cyanobactéries (H 2 O) Mars/Avril 2010 Yves Markowicz - LAPM (CNRS UMR 5163) - Université J. Fourier 136

PHOTOSYNTHESES LA PHASE LUMINEUSE CHEZ LES BACTERIES PHOTOSYNTHETIQUES : PRINCIPES GENERAUX ü localisation des photosystèmes : membrane plasmique, éventuellement invaginée, voire structures membranaires intracytoplasmiques bactéries pourpres : « tubes » invaginés bactéries vertes : chlorosomes cyanobactéries : phycobilisomes (+ pseudo-thylacoïdes) Mars/Avril 2010 Yves Markowicz - LAPM (CNRS UMR 5163) - Université J. Fourier 137

PHOTOSYNTHESES PHOTOPHOSPHORYLATIONS CYCLIQUE ET NON-CYCLIQUE ü Après excitation du photosystème par les photons, les électrons activés sont injectés dans le STE, ce qui entraîne le pompage de protons vers le périplasme (alternance transporteurs d’électrons / transporteurs de protons et d’électrons) ü A la sortie du STE, les électrons sont dirigés vers un accepteur : photophosphorylation non-cyclique (photosynthèse oxygénique uniquement) ü A la sortie du STE, les électrons sont réinjectés dans le STE : photophosphorylation cyclique (le donneur primaire d’électrons est également l’accepteur final… les électrons tournent en rond !) Mars/Avril 2010 Yves Markowicz - LAPM (CNRS UMR 5163) - Université J. Fourier 138

PHOTOSYNTHESES LA PHASE LUMINEUSE CHEZ LES BACTERIES POURPRES : PHOTOSYSTEME II ü antenne collectrice : caroténoïdes bactériochlorophylle a ou bactériochlorophylle b 400/550 nm 850/910 nm 1020/1035 nm ü centre réactionnel : 2 x 2 bactériochlorophylles P 870 2 x bactériophéophytine ü STE : complexe fer-quinone cytochromes b et c 1 (centre Fe/S) cytochrome c 2 + ubiquinone Mars/Avril 2010 Yves Markowicz - LAPM (CNRS UMR 5163) - Université J. Fourier 139
PHOTOSYNTHESES LA PHASE LUMINEUSE CHEZ LES BACTERIES POURPRES Mars/Avril 2010 Yves Markowicz - LAPM (CNRS UMR 5163) - Université J. Fourier 140
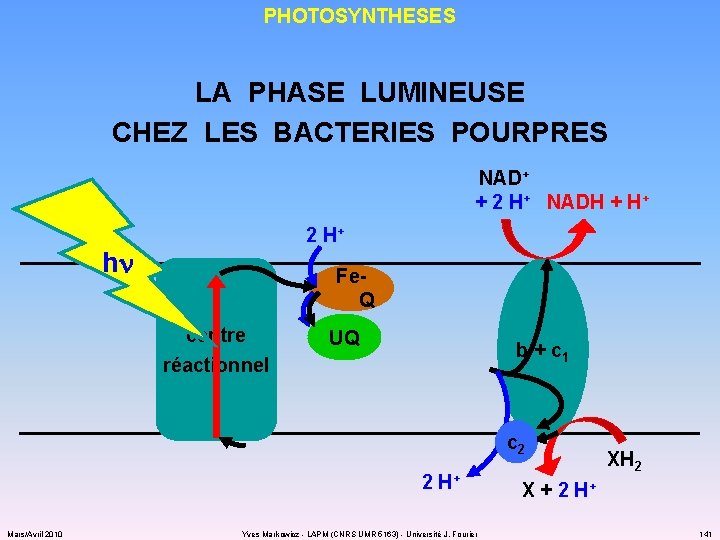
PHOTOSYNTHESES LA PHASE LUMINEUSE CHEZ LES BACTERIES POURPRES NAD+ + 2 H+ NADH + H+ 2 H+ hn Fe. Q centre réactionnel UQ b + c 1 c 2 2 H+ Mars/Avril 2010 Yves Markowicz - LAPM (CNRS UMR 5163) - Université J. Fourier XH 2 X + 2 H+ 141

PHOTOSYNTHESES LA PHASE LUMINEUSE CHEZ LES BACTERIES POURPRES : SOURCES D’ELECTRONS ü bactéries pourpres sulfureuses Thiocapsa, Chromatium XH 2 = H 2 2 H+ + 2 e. H 2 S 2 H+ + S 2 S 0 (accumulation intracellulaire) composés organiques (AA, sucres, acides, …) … ü bactéries pourpres non sulfureuses Rhodopseudomonas XH 2 = H 2 (H 2 S) composés organiques (AA, sucres, acides, …) … Mars/Avril 2010 Yves Markowicz - LAPM (CNRS UMR 5163) - Université J. Fourier 142
PHOTOSYNTHESES LES BACTERIES POURPRES SONT AUSSI CHIMIOTROPHES Mars/Avril 2010 Yves Markowicz - LAPM (CNRS UMR 5163) - Université J. Fourier 143
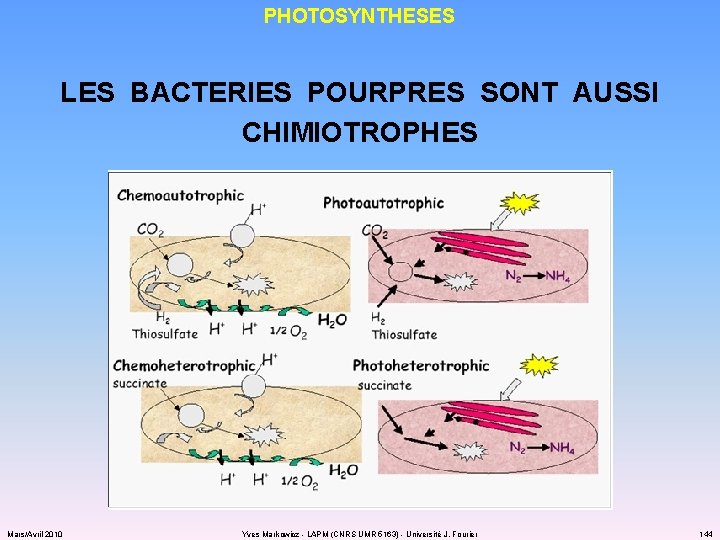
PHOTOSYNTHESES LES BACTERIES POURPRES SONT AUSSI CHIMIOTROPHES Mars/Avril 2010 Yves Markowicz - LAPM (CNRS UMR 5163) - Université J. Fourier 144

PHOTOSYNTHESES LA PHASE LUMINEUSE CHEZ LES BACTERIES VERTES : PHOTOSYSTEME I ü antenne collectrice : caroténoïdes bactériochlorophylle a et bactériochlorophylle c ou bactériochlorophylle d ou bactériochlorophylle e ü centre réactionnel : 2 x 2 bactériochlorophylles P 840 2 x protéine Fe/S ü STE : ferrédoxine cytochromes b + protéine Fe/S cytochrome c 553 + ménaquinone Mars/Avril 2010 Yves Markowicz - LAPM (CNRS UMR 5163) - Université J. Fourier 400/550 nm 805/810 nm 745/760 nm 725/745 nm 715/725 nm 145
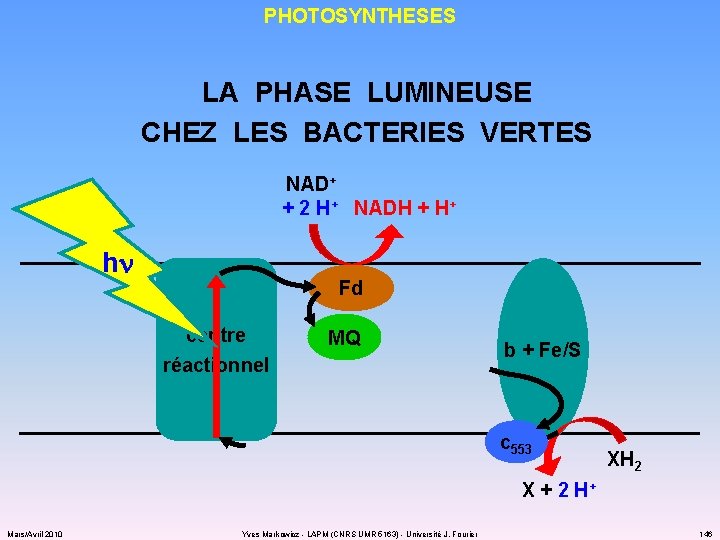
PHOTOSYNTHESES LA PHASE LUMINEUSE CHEZ LES BACTERIES VERTES NAD+ + 2 H+ NADH + H+ hn Fd centre réactionnel MQ b + Fe/S c 553 XH 2 X + 2 H+ Mars/Avril 2010 Yves Markowicz - LAPM (CNRS UMR 5163) - Université J. Fourier 146
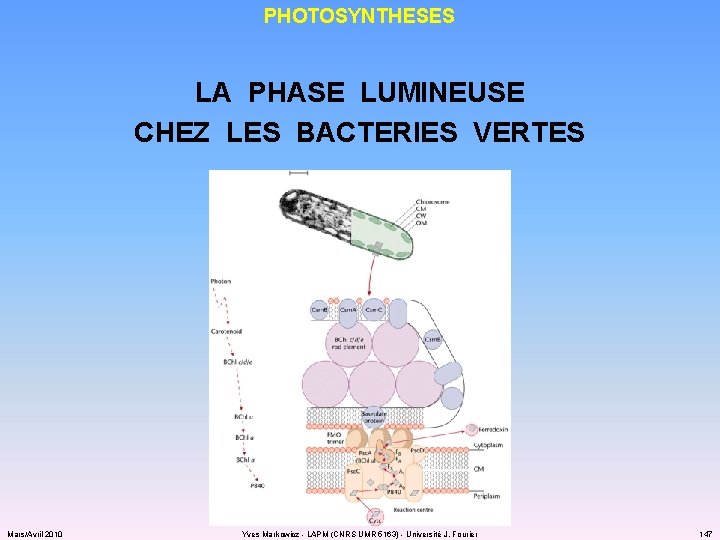
PHOTOSYNTHESES LA PHASE LUMINEUSE CHEZ LES BACTERIES VERTES Mars/Avril 2010 Yves Markowicz - LAPM (CNRS UMR 5163) - Université J. Fourier 147

PHOTOSYNTHESES LA PHASE LUMINEUSE CHEZ LES BACTERIES VERTES Mars/Avril 2010 Yves Markowicz - LAPM (CNRS UMR 5163) - Université J. Fourier 148

PHOTOSYNTHESES LA PHASE LUMINEUSE CHEZ LES BACTERIES VERTES : SOURCES D’ELECTRONS ü bactéries vertes sulfureuses XH 2 = H 2 S 2 H+ + S 2 S 0 (accumulation extracellulaire) … Chlorobium ü bactéries vertes non sulfureuses Chloroflexus XH 2 = H 2 (H 2 S) composé organique (AA, sucre, acide, …) Mars/Avril 2010 Yves Markowicz - LAPM (CNRS UMR 5163) - Université J. Fourier 149

PHOTOSYNTHESES LA PHASE LUMINEUSE CHEZ LES CYANOBACTERIES : PHOTOSYSTEMES I ET II ü antenne collectrice : caroténoïdes 400/550 nm chlorophylle a 665 (+ 430) nm phycobilines = phycoérythrine 550 nm = phycocyanine 620/640 nm ü centres réactionnels : PSII chlorophylle P 680 PSI chlorophylle P 700 ü STE : Mars/Avril 2010 plastoquinone cytochromes b 6 et f plastocyanine Yves Markowicz - LAPM (CNRS UMR 5163) - Université J. Fourier 150
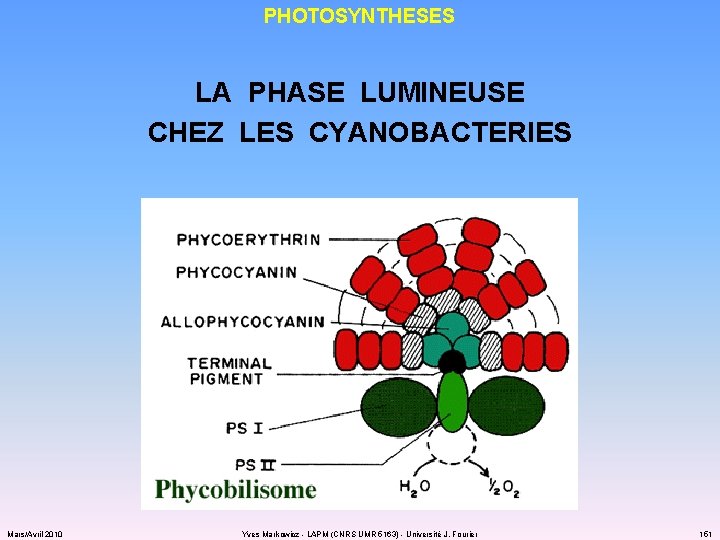
PHOTOSYNTHESES LA PHASE LUMINEUSE CHEZ LES CYANOBACTERIES Mars/Avril 2010 Yves Markowicz - LAPM (CNRS UMR 5163) - Université J. Fourier 151

PHOTOSYNTHESES LA PHASE LUMINEUSE CHEZ LES CYANOBACTERIES Mars/Avril 2010 Yves Markowicz - LAPM (CNRS UMR 5163) - Université J. Fourier 152

PHOTOSYNTHESES LA PHASE LUMINEUSE CHEZ LES CYANOBACTERIES Mars/Avril 2010 Yves Markowicz - LAPM (CNRS UMR 5163) - Université J. Fourier 153

PHOTOSYNTHESES PHASE OBSCURE CHEZ LES CYANOBACTERIES ET LES BACTERIES POURPRES ü réduction du CO 2 via le cycle de Benson et Calvin (rôle essentiel de la Rubis. CO) ü nécessite CO 2, ATP et NADPH + H+ Mars/Avril 2010 Yves Markowicz - LAPM (CNRS UMR 5163) - Université J. Fourier 154
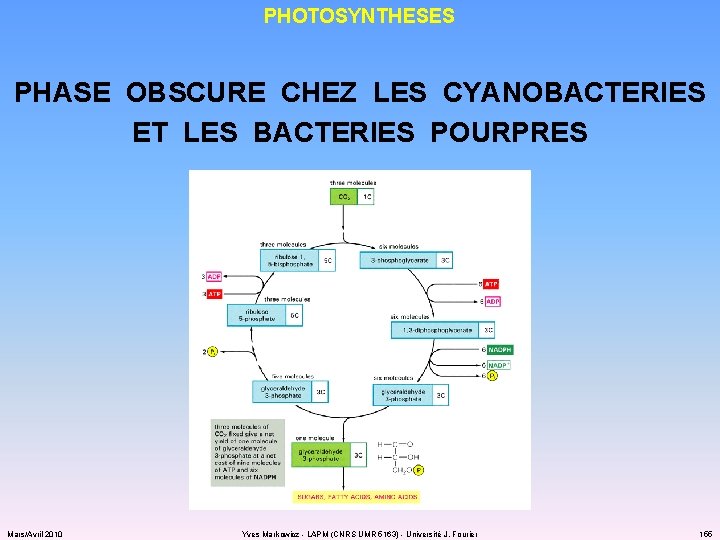
PHOTOSYNTHESES PHASE OBSCURE CHEZ LES CYANOBACTERIES ET LES BACTERIES POURPRES Mars/Avril 2010 Yves Markowicz - LAPM (CNRS UMR 5163) - Université J. Fourier 155

PHOTOSYNTHESES PHASE OBSCURE CHEZ LES BACTERIES VERTES ü la réduction du CO 2 fait intervenir le cycle de l’acide citrique… qui tourne à l’envers ! cycle réducteur des acides tricarboxyliques ü nécessite CO 2 et ferrédoxine réduite Mars/Avril 2010 Yves Markowicz - LAPM (CNRS UMR 5163) - Université J. Fourier 156
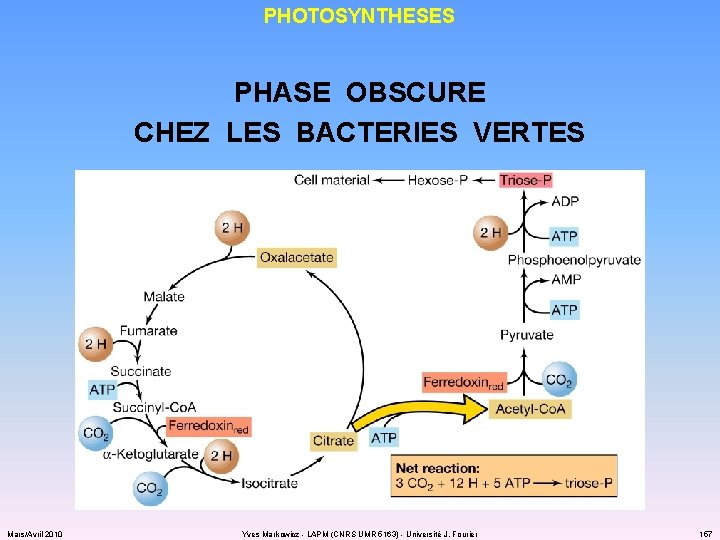
PHOTOSYNTHESES PHASE OBSCURE CHEZ LES BACTERIES VERTES Mars/Avril 2010 Yves Markowicz - LAPM (CNRS UMR 5163) - Université J. Fourier 157
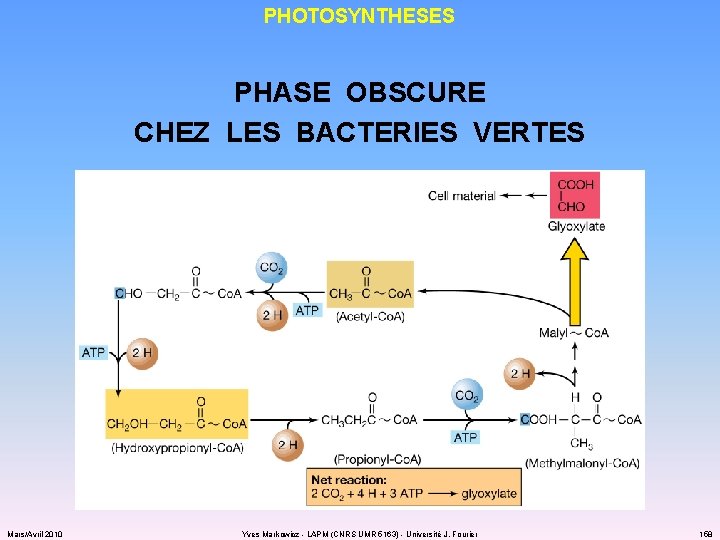
PHOTOSYNTHESES PHASE OBSCURE CHEZ LES BACTERIES VERTES Mars/Avril 2010 Yves Markowicz - LAPM (CNRS UMR 5163) - Université J. Fourier 158
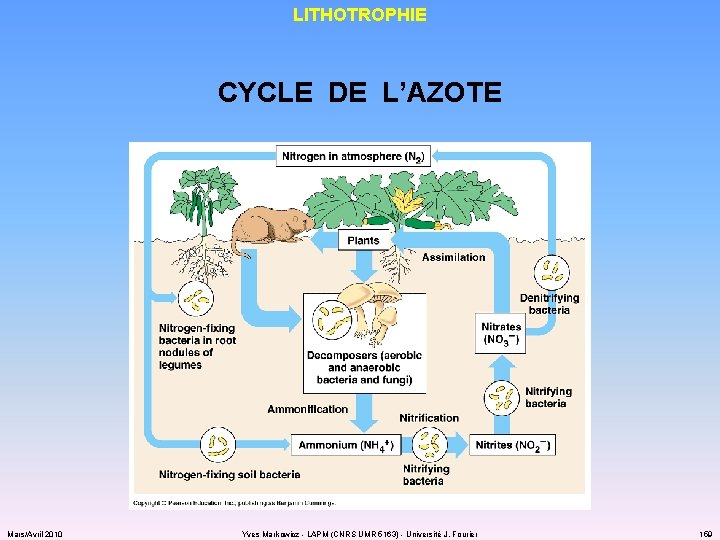
LITHOTROPHIE CYCLE DE L’AZOTE Mars/Avril 2010 Yves Markowicz - LAPM (CNRS UMR 5163) - Université J. Fourier 159
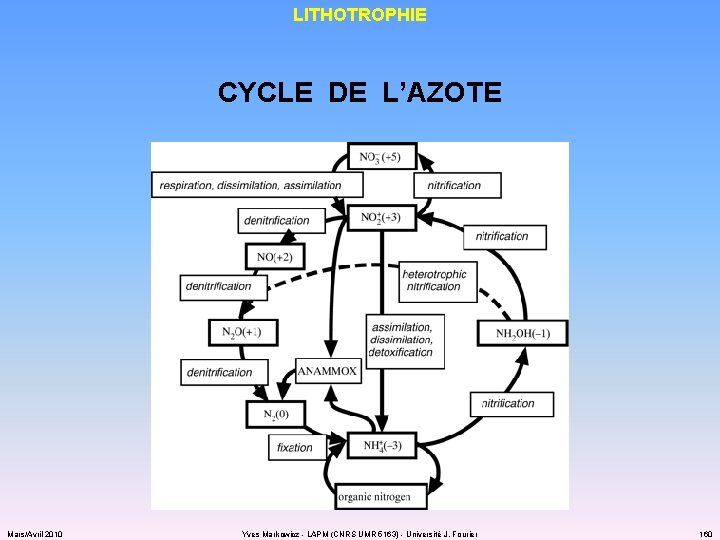
LITHOTROPHIE CYCLE DE L’AZOTE Mars/Avril 2010 Yves Markowicz - LAPM (CNRS UMR 5163) - Université J. Fourier 160
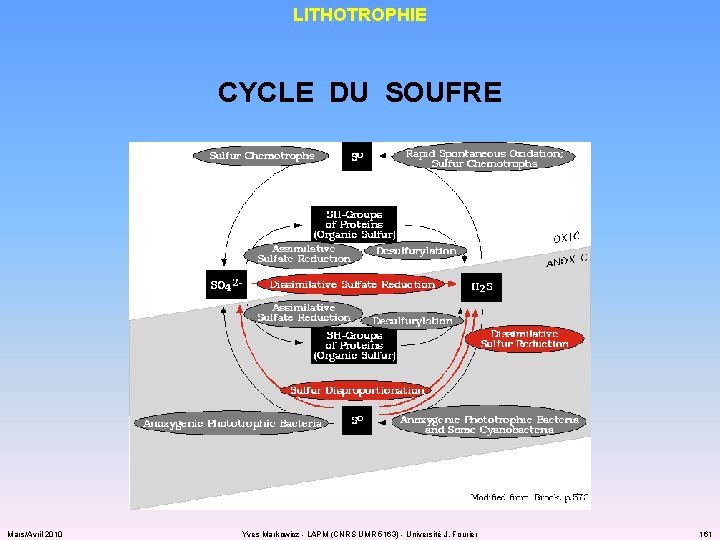
LITHOTROPHIE CYCLE DU SOUFRE Mars/Avril 2010 Yves Markowicz - LAPM (CNRS UMR 5163) - Université J. Fourier 161
- Slides: 161