YEN NESL DZLEME Company name NGStarihe nsan genom














































- Slides: 57

YENİ NESİL DİZİLEME Company name

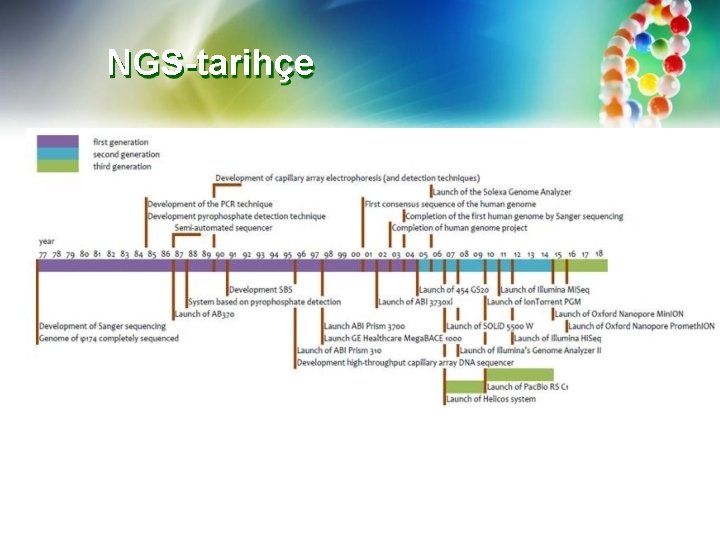
NGS-tarihçe

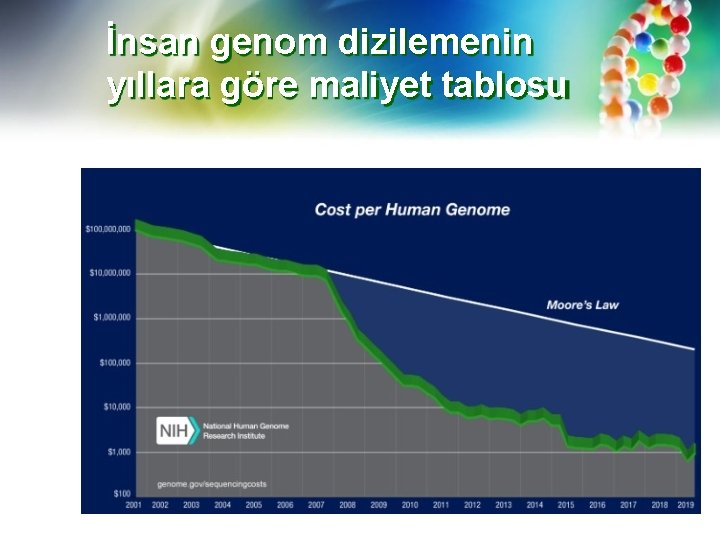
İnsan genom dizilemenin yıllara göre maliyet tablosu

YENİ NESİL DİZİLEME Yüksek verimli DNA dizileme metodolojisi (yeni nesil dizileme; NGS) son 15 -20 yılda hızla gelişmiştir. Yeni yöntemler sürekli olarak ticarileştirilmektedir. Teknoloji geliştikçe, temel ve uygulamalı bilimler için karşılık gelen uygulamaların sayısı da artmaktadır.

Genom dizilemenin kurucu temelleri-1. NESİL DİZİLEME DNA dizilemesinde kurucu yöntemler, Sanger dideoksi sentezi ve Maxam. Gilbert kimyasal bölünme yöntemleriydi. Maxam-Gilbert yöntemi, DNA'nın kimyasal modifikasyonuna ve ardından DNA omurgasının modifiye edilmiş nükleotidlere bitişik bölgelerde bölünmesine dayanır. Sanger dizileme, 3′-OH grubu içermeyen spesifik zincir sonlandırıcı nükleotidler (dideoksi nükleotidler) kullanır. Dolayısıyla, DNA polimeraz tarafından fosfodiester bağı oluşturamaz ve bu pozisyonda büyüyen DNA zincirinin sonlandırılmasına neden olur. dd. NTP'ler, sırasıyla "dizileme" jellerinde veya otomatik dizileme makinelerinde tespit için radyoaktif veya floresan olarak etiketlenir. Orijinal Maxam-Gilbert yönteminin kimyası toksik reaktiflerin ortadan kaldırılmasına yardımcı olmak için değiştirilmiş olsa da, sentez yoluyla Sanger dizileme (SBS) dideoksi yöntemi dizileme standardı haline gelmiştir.

1. NESİL DİZİLEME Sanger dizileme yöntemi 1977'de geliştirilmiştir. Mevcut NGS standartlarına göre nispeten yavaş olmasına rağmen, Sanger zincir sonlandırma metodolojisindeki, otomasyonundaki ve ticarileştirmedeki gelişmeler, birçok mevcut uygulama için en uygun dizileme yöntemi olarak kalmasını sağlamıştır. Spesifik olarak, ultra ince "levha jellerin" çok kanallı kapiler elektroforez ile değiştirilmesi, otomatik yeniden doldurulabilir yeniden kullanılabilir kapillerlerin geliştirilmesi ve "elektrokinetik" numune yüklemesi, Sanger işleminin hızına ve kolaylığına katkıda bulunmuştur.

1. NESİL DİZİLEME Sanger dizilemedeki en önemli yenilikler şunlar olmuştur: (1) flüoresan (sonlandırıcı) boyaların geliştirilmesi, (2) sonlandırıcı boyaları büyüyen DNA ipliklerine verimli ve doğru bir şekilde dahil etmek için gerekli girdi DNA ve termostabil polimeraz miktarını azaltmak için termal döngü diziliminin kullanılması ve (3) dizileri yorumlamak ve analiz etmek için yazılım geliştirmeleri. Otomatik Sanger dizilemede lider, Applied Biosystems'dir (AB) (şimdi Thermo. Fisher'ın bir parçası). Şu anda piyasada bulunan AB sekans cihazlarının tümü, floresan boyaları ve kapiler elektroforezi (CE) kullanır. Makinelerin kapasiteleri, 4 kapiler (Seq. Studio Genetic Analyzer), 8– 24 (3500 Series Genetic Analyzer) ve 48– 96 (3700 Series Genetic Analyzer) arasında DNA dizilemesi veya fragmant analiz protokolleri bakımından farklılık gösterir. Bu dizileyicilerin tümü 600 -1000 bazlık doğru dizi oluşturur. Yıllar içinde Licor, Amersham, Milli. Gen, Perkin Elmer ve Dupont'tan aletler de dahil olmak üzere çeşitli Sanger dizileme tabanlı dizileme makineleri piyasaya sürülmüş olsa da, AB makineleri hariç tümü durdurulmuştur.

1. NESİL DİZİLEME Sanger dizileme teknolojisi, yüksek verimin gerekli olmadığı uygulamalar için çok yararlı olmaya devam etmektedir. Pek çok DNA dizileme temel tesisi ve kâr amaçlı dizileme şirketi Sanger dizileme hizmetleri sağlar. En yaygın kullanımlar, örneğin plazmit yapılarını veya PCR ürünlerini doğrulamak için, spesifik bir şablon üzerinde spesifik bir DNA primeri kullanan ayrı sekanslama reaksiyonları içindir. Artık DNA saflaştırması için moleküler biyoloji kitleri ve reaktifleri ve nispeten ucuz yüksek kaliteli sentetik primerler birçok satıcıdan temin edilebildiğine göre, nispeten büyük Sanger dizileme projeleri bile makul bir zaman çerçevesi ve maliyetle tamamlanabilir.

1. NESİL DİZİLEME DNA'nın dizilenmesine ek olarak, AB makinelerinde Kılcal (kapiller) elektroforez (CE), farklı floresan etiketleri kullanılarak tek bir reaksiyonda birden çok substratı, ürünü ve / veya reaksiyon ara maddesini eşzamanlı olarak analiz etmek için de kullanılabilir. Örneğin CE, DNA polimeraz ve DNA ligaz kinetiği ve Okazaki parça işleme ve ribonükleotid eksizyon onarımı dahil olmak üzere bağlanmış enzim yollarının yüksek verimli çalışmalarında kullanılmıştır. AB CE, floresan olarak etiketlenmiş glikanların analizi için glikobiyolojide de yararlıdır.

İKİNCİ NESİL DİZİLEME METODLARI "Yeni nesil" terimi, DNA dizileme teknolojisinin geliştirilmesinde bir sonraki adımı ima etmektedir. Bunun için İkinci nesil, üçüncü nesil vb. terimini kullanmayı tercih ediyoruz. Bu adlandırma kuralı göz önüne alındığında, büyük genomların daha düşük maliyetle daha yüksek iş hacimli dizileme ihtiyacı, otomatikleştirilmiş Sanger dizilemesine ek olarak çeşitli yaratıcı metodolojiler kullanan birçok ikinci nesil veya "Nextgen" teknolojisinin geliştirilmesini tetiklemiştir. Otomatik Sanger dizilemesinin ticarileştirilmesinde olduğu gibi, bu teknolojilerin çoğu artık kullanılmamaktadır (örneğin, Solid ™, Polinator ™). Peki bu "ikinci" nesil dizileme teknolojileri ve ilgili yöntemler nasıl çalışmaktaydı?

İKİNCİ NESİL DİZİLEME METODLARI İkinci nesil dizileme yöntemleri, 1. hibridizasyon yoluyla dizileme, ve 2. Sentez yoluyla dizileme (SBS) olmak üzere iki ana kategoriye ayrılabilir.

İKİNCİ NESİL DİZİLEME METODLARI Maliyetler hakkında bir not: Dizileme maliyetleri birçok değişkeni kapsar ve bunlardan bazıları genellikle yaygın olarak sunulan “baz başına maliyet” tahminlerinin dışında bırakılır. Reaktif maliyetleri genellikle sipariş edilen hacme bağlıdır ve genellikle satıcıyla görüşülür. Örneğin, daha büyük miktarlarda sipariş veren çekirdek tesisler ve dizileme merkezleri indirimli fiyatlandırma elde edebilir. Maliyetler genellikle işçiliği ve sürecin sonundaki biyoinformatik akış hattını içermez. Bununla birlikte, "1000 $ insan genomu" veya "baz başına maliyeti" düşürmek gibi hedefler, dizileme teknolojisi ve araştırma topluluğu tarafından karşılanması gereken altın standartlardır.

İKİNCİ NESİL DİZİLEME METODLARI-hibridizasyon yoluyla dizileme Bu yöntem ilk olarak 1980'lerde, dizilenecek DNA'nın etiketli fragmanlarına hibridize edilmiş filtreler üzerindeki dizili DNA oligonükleotidleri kullanılarak geliştirilmiştir. İstenmeyen hibridize olmayan DNA'yı tekrar hibritleyerek ve yıkayarak, hibritleme etiketli fragmanların filtre üzerindeki DNA problarının dizisine uyup uymadığını belirlemek mümkün olmuştur. Böylelikle, prob hibridizasyon noktalarından gelen üste binen bilgilere dayalı olarak daha büyük bitişik sekans bilgisi oluşturmak mümkün olmuştur. Hibridizasyon yoluyla dizileme, büyük ölçüde, belirli genlerdeki hastalıkla ilgili SNPS'yi (tek nükleotid polimorfizmleri) veya büyük kromozom anormalliklerini (yeniden düzenlemeler, silmeler, kopyalar) tanımlamaya yönelik tanısal uygulamalarda olduğu gibi, dizileri sorgulamak için belirli probların kullanılmasına dayanan teknolojilere indirgenmiştir.

İKİNCİ NESİL DİZİLEME METODLARI-sentez yoluyla dizileme Sentez yoluyla dizileme (SBS) yöntemleri birkaç farklı yaklaşım benimsemiştir. "İkinci nesil" yöntemler genellikle dizileme reaksiyonlarının meydana geldiği mikrokanallar veya kuyular içeren katı bir destek kullanır. Genel olarak, bu yeni SBS yöntemlerinin çoğu, bazı teknolojilerde "tersine çevrilebilir" sonlandırıcılar kullanılmasına rağmen, dideoksi sonlandırıcılar kullanmaz. "Tersine çevrilebilir" sonlandırıcılar, dahil edilen nükleotitleri görüntülerken nükleotit birleştirme reaksiyonlarının normal şekilde ilerlemesine izin verir ve daha sonra, sıraya bir sonraki bazın dahil edilmesine izin vermek için etiketlenmiş nükleotitler üzerindeki sentez bloke edici parçaları çıkarır.

İKİNCİ NESİL DİZİLEME METODLARI-sentez yoluyla dizileme Mevcut SBS yöntemleri, çok daha kısa okumalara (şu anda yaklaşık 300 -500 baza kadar) dayandıkları için orijinal Sanger dizileme yaklaşımından farklıdır. Genellikle, Sanger dizilemesine göre doğal olarak daha yüksek bir hata oranına sahiptirler. Ayrıca, bir konsensüs dizisinin tanımlanmasına dayalı doğru bir dizi elde etmek amacıyla, milyonlarca ila milyarlarca kısa DNA dizisi okumasının (50 -300 nükleotit) yüksek dizi kapsamına ("büyük ölçüde paralel dizileme") güvenirler.

İKİNCİ NESİL DİZİLEME METODLARI-sentez yoluyla dizileme Bununla birlikte, bazı teknolojiler için, dizi bağlama hataları meydana gelir ve her zaman okuma sayısı artırılarak düzeltilemez. Örneğin, DNA, AAAAA gibi aynı bazın ardışık katlarını içerdiğinde (homopolimer dizileri) bu hata ortaya çıkar. Bu durumda, dizileme platformları, ardışık bazların sayısının doğru bir şekilde belirlenmesinde yetersiz kalabilir. Her platform kendi benzersiz potansiyel dizi bağlama hataları kümesini oluşturur ve kullanıcıların bu sınırlamalardan haberdar olması gerekir. Farklı teknolojilere sahip birkaç platform kullanmak, genellikle bu sorunları aşmak için kullanılır.

İKİNCİ NESİL DİZİLEME METODLARI-sentez yoluyla dizileme "Daha uzun okuma uzunlukları" ndan "kısa okuma" teknolojilerine geçiş, şimdi, teknolojinin "büyük ölçüde paralel" doğasını korurken, daha uzun birincil okuma uzunlukları üreten teknolojiler geliştirmeye doğru gitmektedir. Bu, açıklayacağımız "üçüncü" ve özellikle "dördüncü" nesil teknolojilerde meydana gelmektedir. Kısmen reaksiyon başına maliyet ve kısmen, tekrarlanan DNA öğeleri gibi dizi bağlamı sorunlarını aşmak için olabildiğince fazla birincil dizi okuma bilgisi elde etme amacıyla bu yönde gelişmeler söz konusudur.

İKİNCİ NESİL DİZİLEME METODLARI-sentez yoluyla dizileme Çoğu SBS teknolojisi, dizilenecek DNA moleküllerinin tek milyonlarca ayrı kuyuya veya bölmeye dağıtıldığı veya katı bir substrat üzerindeki belirli konumlara bağlandığı bir yöntem kullanır. PCR veya "yuvarlanan daire" amplifikasyon yöntemleriyle amplifiye edilen DNA molekülleri, daha sonra, etiketlenmiş nükleotitlerin veya belirli bir nükleotidin dahil edilmesine dayanan kimyasal reaksiyonların görüntülenebileceği veya başka şekilde tespit edilebileceği DNA sentez reaksiyonlarına tabi tutulur. Milyonlarca DNA dizisi okumasının tek bir dizi çalışmasında üretilmesini sağlamak için birçok yaratıcı teknoloji geliştirilmiştir. Dizileme çalışmaları, üretilen iş hacmine bağlı olarak saatler veya

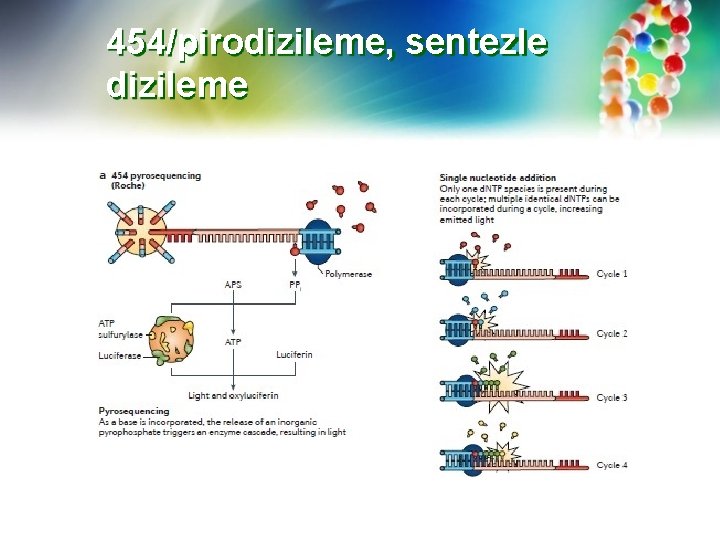
454 -pirodizileme 454 pyrosequencing — Sonlandırılmış olmasına rağmen, piyasaya çıkan ve yeni bir yaklaşım kullanan ilk "ikinci" nesil dizileme yöntemlerinin bir örneğidir. Bu yaklaşım, belirli bir bazın büyüyen bir DNA zincirine dahil edilip edilmediğini bildirmek için nükleotid birleşmesinin bir yan ürünü olan pirofosfatı tespit eder. 400 -700 bp uzunluğundaki bağımsız DNA fragmanları, adaptörlere bağlanır ve ayrı bir emülsiyon "boncuk" (em. PCR) reaksiyonunda PCR ile amplifiye edilir. Boncuklar üzerindeki DNA dizileri, adaptörler üzerindeki dizileri tamamlayıcı niteliktedir ve DNA parçalarının doğrudan boncuklara, ideal olarak her bir taneye bir parça bağlanmasına izin verir.

454 -pirodizileme DNA sentezi ve ardından DNA sentezi reaksiyonlarının kimyasal tespiti, pirofosfat salımının ölçüldüğü pikolitre boyutlu bir odada gerçekleşir. Odaların ardışık olarak 4 nükleotidden birini içeren dizileme reaktifleri ile doldurulmasıyla, sentezlenen ipliğe doğru nükleotid eklendiğinde, pirofosfat salımı, bir ışık üreten reaksiyon kullanılarak ölçülür. Işık yoğunluğu, aynı nükleotidin daha büyük yollarında zorluklarla karşılaşılmasına rağmen, dizideki nükleotidlerin homopolimer "akışları" ile ilgili bilgi sağlar.

454 -pirodizileme Pyrosequencing, İsveç'te Pyrosequencing AB tarafından geliştirildi ve daha sonra Roche tarafından satın alınmadan önce 454 Life Sciences'a lisans veren Qiagen tarafından satın alındı. 454 sekans cihazı 2013 yılında üretimden kaldırılmıştır, ancak reaktifler hala birkaç tedarikçiden temin edilebilir. "454 dizileme" teknolojisi, tipik olarak elde edilen uzun okuma uzunlukları (600 -800 nt'ye kadar) ve nispeten yüksek verim (25 milyon baz, % 99'da veya daha iyi, bir 4 saatlik çalışma), genom montajını kolaylaştırır.

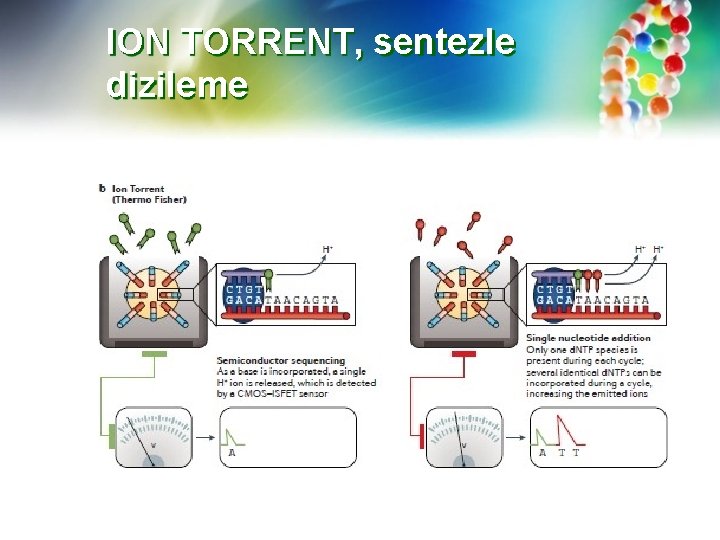
Ion Torrent (https: //www. youtube. com/watch? v=WYBzbx. Ifu. Ks)—Ion Torrent ™ teknolojisi, nükleotid dizisini doğrudan bir yarı iletken çip üzerindeki dijital bilgiye dönüştürür. Bir DNA sentez reaksiyonunda, doğru bir nükleotid, büyüyen bir DNA zincirindeki tamamlayıcı bazının karşısına eklendiğinde, bir hidrojen iyonu salınır. Bu, bir iyon sensörü tarafından voltaj değişikliği olarak kaydedilir. Hiçbir nükleotid dahil edilmemişse, voltaj yükselmesi meydana gelmez. Bir seferde 4 nükleotidden yalnızca birini içeren sekanslama reaktifleri ile bir "sekanslama odasını" sırayla doldurarak ve yıkayarak, uygun nükleotid dahil edildiğinde voltaj değişiklikleri meydana gelir. İki bitişik nükleotid aynı nükleotidi birleştirdiğinde, iki hidrojen salınır ve voltaj ikiye katlanır. Böylece tek bir nükleotidin "akışı" da belirlenebilir. Bununla birlikte, aynı nükleotidin büyük homopolimer dizilerini ayırt etmek bazen zordur.

Ion Torrent dizileme reaksiyonları, kimyasal bilgileri dizileme bilgisine dönüştüren milyonlarca piksel içeren bir yarı iletken çipe sahip milyonlarca kuyuda meydana gelir. İşleme başlamak için DNA, adaptörlere bağlanan 200 -1500 bazlık parçalara bölünür ve adaptörlere bağlanır. DNA fragmanları, boncuklar ve adaptörler üzerindeki tamamlayıcı sekanslarla bir boncuğa eklenir ve daha sonra, boncuk üzerinde emülsiyon PCR (em. PCR) ile amplifiye edilir. Bu işlem, milyonlarca boncuk’un her birinin bir DNA dizisinin birden çok kopyasına sahip olmasını sağlar.

Ion Torrent Boncuklar daha sonra tek bir kuyuya yalnızca bir tane boncuk girebilecek şekilde oyukları içeren çip boyunca akıtılır. Sekanslama reaktifleri daha sonra kuyucuklar boyunca aktığında, uygun nükleotid dahil edildiğinde, bir hidrojen iyonu verilir ve sinyal kaydedilir. Sistemin önemli bir avantajı, kamera, ışık kaynağı veya tarayıcıya ihtiyaç duyulmamasıdır; nükleotid birleşmesi doğrudan, doğrudan kaydedilen voltaja dönüştürülerek süreci büyük ölçüde hızlandırır.

Ion Torrent sistemi Thermo-Fisher tarafından satılmaktadır ve platformun her biri farklı çıkış özelliklerine sahip Ion Personal Genome Machine ™ (PGM ™) System, Ion Proton ™ System, Ion S 5 system ve ION S 5 XL system dahil olmak üzere çeşitli versiyonları mevcuttur. (bkz. https: //www. thermofisher. com/us/en/home/lifescience/sequencing/nextgeneration-sequencing. html). Otomatik bir kütüphane ve şablon hazırlama sistemi de mevcuttur (Ion Chef ™). Hedefli ve de novo DNA ve RNA dizileme, transkriptom dizileme, mikrobiyal dizileme, kopya sayısı varyasyon tespiti, küçük RNA ve mi. RNA dizileme ve CHIP-seq (kromatin immünopresipitasyon dizileme dahil) çok sayıda uygulama desteklenmektedir.

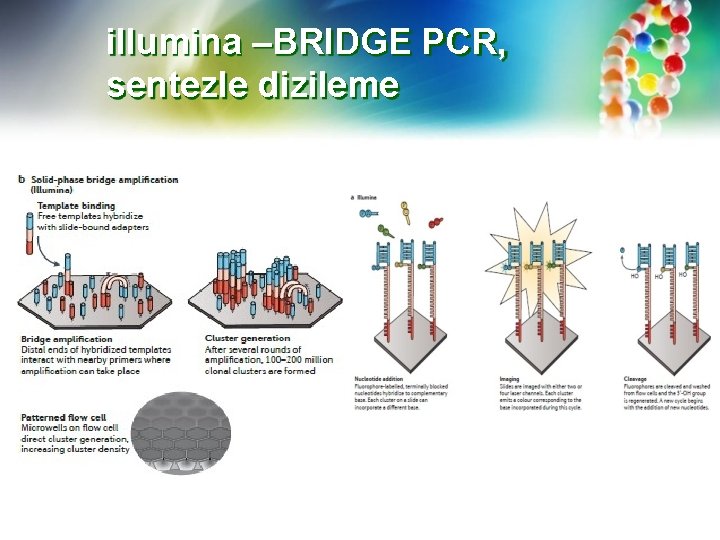
Illumina teknolojisi — İkinci nesil dizileme alanındaki en büyük oyuncu, ilk olarak Solexa ve Lynx Therapeutics tarafından geliştirilen teknolojiyi kullanan Illumina'dır. Illumina dizileme, "köprü amplifikasyonu" olarak bilinen bir tekniğe dayanır; burada her bir uca bağlanmış uygun adaptörlere sahip DNA molekülleri (yaklaşık 500 bç), bağlanmış bir adaptöre tamamlayıcı oligonükleotid dizileri içeren katı bir destek (cam slayt) üzerinde tekrarlanan amplifikasyon sentez reaksiyonları için substratlar olarak kullanılır (Bkz. Www. youtube. com/watch? v=wom. Kfik. Wlx. M). Cam slayttaki oligonükleotidler, işlemlerin devamında DNA tekrarlanan amplifikasyon turlarına tabi tutulacağından, her bir oligonükleotid parçasının yaklaşık 1000 kopyasından oluşan klonal "kümeler" oluşturacak şekilde aralıklı yerleştirilmiştir.

Illumina Her bir cam slayt, milyonlarca paralel küme reaksiyonunu destekleyebilir. Sentez reaksiyonları sırasında, her biri farklı bir floresan etikete sahip olan dört bazın her birine karşılık gelen tescilli modifiye edilmiş nükleotidler dahil edilir ve daha sonra tespit edilir. Nükleotidler ayrıca her reaksiyon için sentezin sonlandırıcıları olarak görev yapar ve bunlar bir sonraki sentez turu için saptandıktan sonra blokasyon kalkar. Reaksiyonlar 300 veya daha fazla tur tekrarlanır. Floresan algılamanın kullanılması, kamera tabanlı görüntülemenin aksine, doğrudan görüntülemeye bağlı algılama hızını artırır.

Illumina dizileme; genomik dizileme, ekzom ve hedefli dizileme, metagenomik, RNA dizileme, CHIP-dizileme ve metilom yöntemleri dahil olmak üzere çeşitli protokolleri destekler. Farklı iş hacim seviyelerine sahip çeşitli Illumina dizileme cihazları (Mini. Seq, Mi. Seq, Next. Seq, Nova. Seq ve Hi. Seq modelleri vb. ) mevcuttur. Mini. Seq, 2 X 150 bp okumalarda 25 milyon okuma / çalıştırma ile 7, 5 Gb sağlar. Mi. Seq, 2 X 300 bp okuma, 15 Gb çıktı için 25 milyon okuma gerçekleştirebilir. Next. Seq, 2 X 150 bp okuma uzunluğunda 400 milyon okuma ile 120 Gb sağlayabilir. Her cihazın ayrıntıları ve belirli dizileme projelerine ilişkin yetenekleri https: //www. illumina. com/systems/ adresinde bulunabilir. sequencing -platforms. html ve https: //www. illumina. com/systems/sequencingplatforms. html. bulunabilir.

Illumina dizileme ile ortaya çıkabilecek bir sorun, bir kümenin bireysel üyeleri arasındaki sentez reaksiyonlarında eşzamanlılık eksikliğidir, bu da doğru bir konsensüs dizisinin oluşturulmasına müdahale eder ve gerçekleştirilebilecek döngü sayısını azaltır. Ayrıca, diziye yüklenen şablon DNA miktarının doğru bir şekilde ölçülmesini gerektiren desteğin "fazla kümelenmemesine" özen gösterilmelidir. Üretilen büyük miktarda veri nedeniyle, dizileme sürecinden üretilen dizileme hatalarının analizi de incelenebilir ve protokol kaynaklı yapaylıklara karşı "gerçek" dizi varyantlarının tanımlanmasına yardımcı olur.

İkinci nesil genom dizileme teknolojileri – Hibridizasyon ile dizileme • SOLi. D – Sentezle dizileme • 454/pirosekanslama • Ion Torrent • Illumina/Solexa

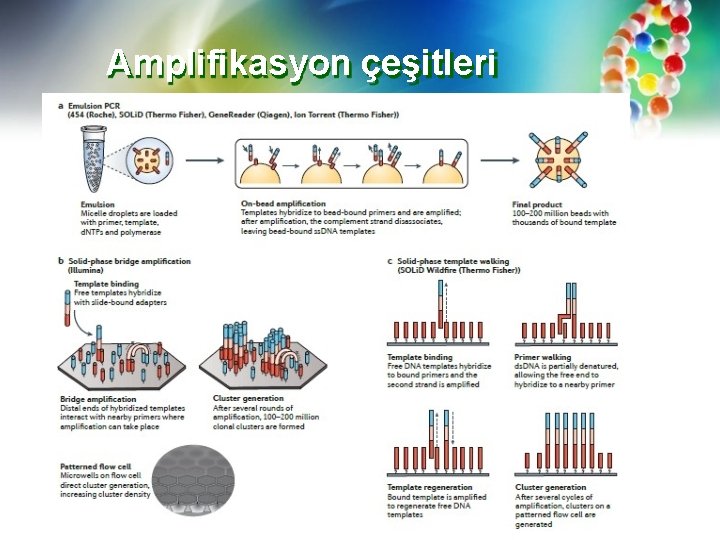
Amplifikasyon çeşitleri

454/pirodizileme özet şema

454/pirodizileme, sentezle dizileme

ION TORRENT, sentezle dizileme

illumina –BRIDGE PCR, sentezle dizileme

Üçüncü Nesil Dizileme • Pac. Bio • Heliscope • İkinci nesil dizileme yöntemlerinin aksine, üçüncü nesil dizileme yöntemleri uzun DNA (ve RNA) moleküllerini sekanslamayı amaçlamaktadır.

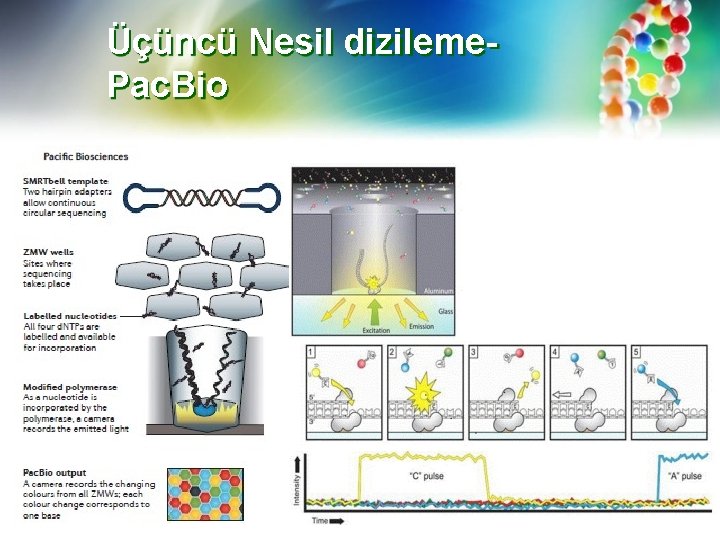
Üçüncü Nesil dizileme. Pac. Bio • İkinci nesil dizileme yöntemlerinin aksine, üçüncü nesil dizileme yöntemleri uzun DNA (ve RNA) moleküllerini dizmeyi amaçlamaktadır. Bu alandaki şu anda ticarileştirilmiş teknoloji lideri Pacific Biosciences'dır (Pac. Bio) (https: //www. youtube. com/watch? v = v 8 p 4 ph 2 MAv. I), iki sekanslama sistemini ticarileştirmiştir: orijinal RSII modeli ve daha yakın zamanda Sequel ™ (bkz. http: //www. pacb. com/products-and-services/pacbio-systems/). • SMRT (Tek Molekül Gerçek Zamanlı) dizileme olarak da anılan Pac. Bio dizileme, çok uzun fragmanların 30– 50 kb'ye kadar veya daha uzun bir şekilde dizilenmesini sağlar. • SMRT yöntemi, dizilenecek bağlı DNA ile tasarlanmış bir DNA polimerazın bir kuyunun dibine (bir SMRT akış hücresinde sıfır modlu dalga kılavuzu (ZMW)) bağlanmasını içerir (bkz. Http: //www. pacb. com/ smrt-science / smrt-sequencing/).

Üçüncü Nesil dizileme. Pac. Bio Bir ZMW, ışık enerjisini, aydınlatıcı ışığın dalga boyuna göre boyutları küçük olan bir alana yönlendiren küçük bir odadır. ZMW tasarımı ve kullanılan ışığın dalga boyu nedeniyle görüntüleme, yalnızca ZMW'nin altında, DNA'ya bağlanan DNA polimerazın büyüyen bir zincirdeki her bir bazı ile birleştiği yerde gerçekleşir. Dört nükleotid, diferansiyel tespit için farklı fosfo-bağlı floroforlarla etiketlenmiştir. Büyüyen zincire bir nükleotid eklendiğinde, doğru floresan etiketli nükleotid bağlandıkça, milisaniye ölçeğinde görüntüleme gerçekleşir. Dahil edildikten sonra, ZMW'nin tabanından "uzaklaşan" ve artık tespit edilemeyen fosfat bağlı floresan kısım serbest bırakılır. Bir sonraki nükleotid daha sonra dahil edilebilir. Görüntüleme, nükleotid birleşme hızı ile zamanlanır, böylece her baz, büyüyen DNA zincirine dahil edilirken tanımlanır. Bu eşzamanlı olarak, SMRT hücreleri içindeki tek bir yongada bulunan bir milyona kadar zeptolitre ZMW'de paralel olarak gerçekleşir.

Üçüncü Nesil dizileme. Pac. Bio Şablon hazırlama, şablon üzerinde DNA sentezini başlatmak için kullanılan primerleri tamamlayan bilinen bir adaptör sekansına sahip dairesel bir çift sarmallı DNA molekülü olan "SMRTbell" in üretimini içerdiğinden Pac. Bio işleminde benzersizdir. Bu, polimerazın bir konsensüs sekansı (CCS, dairesel konsensüs sekansı) oluşturmak için polimeraz durana kadar her ZMW'deki dairesel molekülü geçerek büyük şablonları defalarca okumasını sağlar. İnsert’ün her iki tarafına bağlanan adaptörlerin her biri DNA sentezi hazırlama bölgelerine sahip olduğundan, sekanslama polimerazı, ds "SMRTbell" in her iki ipliğinden tamamlayıcı bilgiler sağlayarak DNA zincirlerinden herhangi birinde 5 ′ -> 3 yönünde dairesel SMRTbell'i geçebilir.

Üçüncü Nesil Dizileme: Pac. Bio gerçek zamanlı dizileme görüntüleme ve saptama işleminin önemli bir avantajı, sentez sırasında her bir nükleotid ilavesinin oranının (darbeler arası süre=IPD) ölçülebilmesidir. Bazı adenin ve sitozin metilasyonları gibi baz modifikasyonlu birçok (ancak hepsi değil) nükleotid, IPD'yi değiştirir ve böylece modifiye edilmiş bir baz olarak tanımlanabilir (bkz. Https: //s 3. amazonaws. com/files. pacb. com/png /basemod_benefits_lg. png). Epigenetik çalışmalar için birçok farklı modifikasyon tespit edilebilir ve kataloglanabilir.

Üçüncü Nesil Dizileme: Pac. Bio SMRT sıralaması, önceki yöntemlere göre çeşitli avantajlar sunar. Genom toplulukları için uzun okumalar sağlamanın yanı sıra epigenetik çalışmalar için metilasyon alanlarının hızlı bir şekilde tanımlanmasını sağlar. Örneğin, Pac. Bio teknolojisi kullanıldığında, göreceli olarak sadece birkaç SMRT hücresi kullanarak tam bir bakteri genom dizisini bir araya getirmek ve içindeki metilasyon modellerini belirlemek kolaydır. Çoğu zaman, Pac. Bio düzenekleri, artan doğruluk için Illumina dizileme gibi diğer yöntemlerle birleştirilir.

Verim açısından, Pac. Bio RS II (2013), optimize edildiğinde SMRT hücresi başına 350 megabaza kadar sekans üretebilen 150. 000 ZMW'ye sahip çipler kullanır. Optimizasyon, bir Poisson dağılımı kullanılarak gerçekleştirilir, böylece yalnızca bir polimeraz bağlanır. DNA molekülü her kuyucukta bulunmalıdır. En son Pac. Bio enstrümanı olan Sequel, 1 milyon ZMW'ye sahiptir ve ortalama 1015 kb (7, 6 Gb çıktı) okuma ile ~ 365. 000 okuma üretebilir. Kimya ve teknolojinin sürekli ilerlemesi ("manyetik boncuk ve yükleme» ) ve Pac. Bio dizilemesi için büyük DNA fragmanlarını izole etmek için SAGE Pippin kullanımı; daha fazla, daha uzun ve daha doğru okumalar sağlamak için tasarlanmıştır.

Üçüncü Nesil dizileme. Pac. Bio

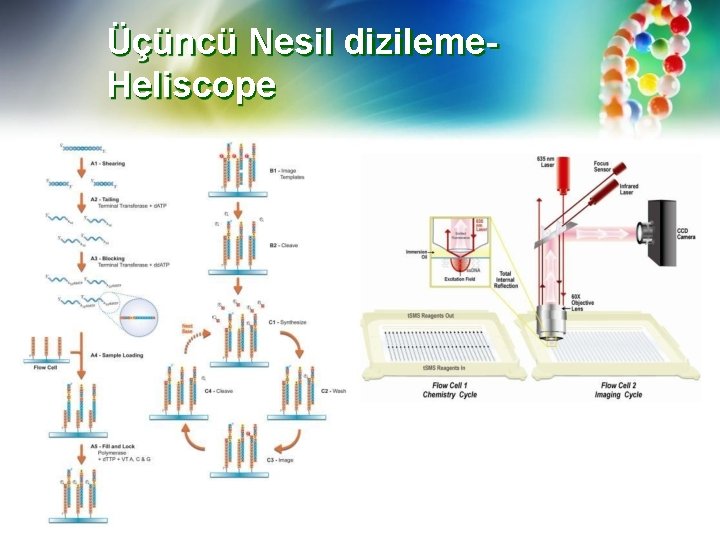
Üçüncü Nesil dizileme. Heliscope • Helicos ™ Tek Molekül Sekanslama (SMS), hücresel nükleik asitlerin doğrudan sekanslanması yoluyla, hem doğru kantitasyon hem de sekans bilgileri sağlayarak, genom biyolojisinin eşsiz bir görünümünü sağlar. • Numune hazırlama, ligasyon veya PCR amplifikasyonu gerektirmez, diğer teknolojilerde gözlemlenen GC içeriğinden ve boyut sapmasından kaçınır. • DNA basitçe kesilir, poli A ile kuyruklanır ve milyarlarca molekülün paralel olarak sentezlenmesi için oligo-d. T içeren bir akış hücresi yüzeyine hibritlenir.

Üçüncü Nesil dizileme. Heliscope • Sekanslama için hedeflenen DNA molekülleri, tek kullanımlık cam akış hücreleri üzerinde yerinde hibridize edilir. • Numuneler, sıcaklığın optimal hibridizasyon için ayarlanabildiği Helicos Sample Loader kullanılarak akış hücrelerine yüklenir. • Akış hücreleri (25 kanallı) uygun şekilde yerleştirildikten sonra, sentez ve görüntüleme yoluyla sekanslama için gerekli tüm reaktiflerle birlikte Heli. Scope ™ Sekanslama Sistemine yerleştirilir. • Sekanslama Sisteminde, görüntüler Helicsope ™ Analiz Motoru tarafından gerçek zamanlı olarak işlenmesiyle gerektiği kadar sekanslanma sağlanır. • Analiz Motoru her fiziksel konumdan görüntüleri işler ve bu görüntülerden dizi okumaları oluşturur. • İşlem tamamlandığında, görüntüler işlenir ve zincir oluşumu tamamlanır; gerektiğinde referans hizalama veya montaj için kullanılmak üzere veriler indirilir.

Üçüncü Nesil dizileme. Heliscope

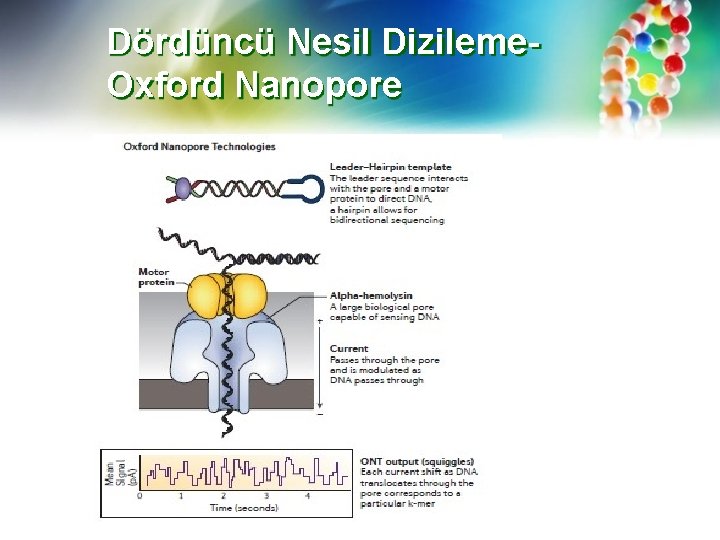
Dördüncü Nesil Dizileme. Oxford Nanopore • 4 G platformları, 3 G'nin tek molekül dizilimini ve nanopore teknolojisini entegre ederek hızlı bir şekilde gelişmiştir. Nanopor teknikleri, amplifikasyon gerektirmeden sekanslama, tekrarlanan döngüler olmadan gerçek zamanlı sekanslama ve sentezin ortadan kaldırılmasıyla elde edilir ve bu nedenle 4 G sekanslama teknikleri olarak sınıflandırılır. • Uzun DNA moleküllerini küçük çaplı “deliklerden” geçirmek ve her bir nükleotit bağlantılı bir detektörden geçerken farklı akımları ölçmek mümkündür. bkz. (https: //www. youtube. com/watch? v=GUb 1 TZv. MWsw). Teorik olarak, nanoporlardan yüz kb'den fazla DNA geçirilebilir ve birçok kanalda, nispeten düşük bir maliyetle onlarca ila yüzlerce Gb sekans elde edilebilir.

Dördüncü Nesil Dizileme. Oxford Nanopore DNA dizilemesi için iki tür nanogözenek (nanopore) sistemi geliştirilmektedir; 1. biyolojik membran sistemleri ve 2. katı hal sensör teknolojisi. Biyolojik nano-gözenek dizilimi, gözenekleri oluşturmak için bir lipid membrana gömülü transmembran proteinlerin kullanımına dayanır. Gözenek oluşturmak için kullanılan iki protein kapsamlı bir şekilde incelenmiştir: alfa hemolizin ve Mycobacterium smegmatis porin A (Msp. A).

Dördüncü Nesil Dizileme. Oxford Nanopore Gözeneklerden DNA geçiş hızı, nükleotid ilavesinden sonra DNA'yı yakalayan oldukça işleyici bir DNA polimeraz (phi 29) gibi motor proteinlerin eklenmesiyle düzenlenir. DNA helikaz, eksonükleaz I gibi diğer yardımcı proteinler ya da DNA sarmallarını bağlamak için oligonükleotidler, saptama için nanopor yoluyla DNA nükleotidlerinin çözülmesini ve "kilitlenmesini" mümkün kılar. On binlerce nükleotid uzunluğundaki DNA, gözeneklerden sabit bir hızda hareket ettirilebilir. Katı hal sensör teknolojisi, DNA veya RNA'nın geçmesine izin veren nanometre boyutlu gözeneklere sahip çeşitli metal veya metal alaşımlı substratlar kullanır.

Dördüncü Nesil Dizileme. Oxford Nanopore Nanogözenek tabanlı DNA dizileme ilk olarak 1990'ların sonunda önerildi ve son zamanlarda taşınabilir bir Min. ION (512 nanogözenek akış hücresi kanalı), tezgah üstü Grid. ION (tek bir modülde 5 taklit) ve yüksek bir yüksek verim Prometh. ION (geliştirme aşamasında, 48 akış hücresi Her biri 3000 nanopor) (bkz. Https: //nanoporetech. com/applications/dna-nanopore-sequencing ve https: //nanoporetech. com/how-it-works). Oxford nanopore teknolojileri tarafından ticarileştirildi. Bu dizileyiciler, her bir nükleotid detektörden geçerken karakteristik akım değişikliklerinin meydana geldiği elektriksel olarak dirençli bir polimer membranda protein nano-gözeneklerini kullanır.

Dördüncü Nesil Dizileme. Oxford Nanopore Uzun ds. DNA molekülleri ilk önce phi 29 polimeraz gibi işleyici bir enzime bağlanır. Kompleks (DNA –polimeraz kompleksi) bir nano-gözenekle karşılaştığında, bir DNA ipliği nanogözene girer ve gözenek içerisindeki translokasyon hızı, DNA polimeraz sentezi ve translokasyonu ile düzenlenir. İşleyici enzim, DNA'nın sürekli ve işlemsel bir şekilde onun içinden "taşınmasını" sağlar. Bir nükleotid gözenekten geçerken, nanogözeneklere uygulanan bir akımı bozar. Her nükleotid, güncel bir bozulma olayı olarak kaydedilen karakteristik bir elektronik sinyal sağlar. Kayıt gerçek zamanlı olarak yapılır ve 10 kb'lik okumalar artık makul bir çıktı iken, teoride 100 kb DNA her bir nanogözenekten geçebilir ve tespit edilebilir. DNA bir nanogözenekten ayrıldığında, gözenek farklı bir DNA

Dördüncü Nesil Dizileme. Oxford Nanopore Küçük, el tipi boyutu nedeniyle Min. ION, taşınabilirliğin ve / veya alan gereksinimlerinin önemli olduğu birçok uygulama için avantajlıdır. Şu anda hata oranı nispeten yüksektir, ancak diğer yüksek verimli dizileme yöntemlerinde olduğu gibi, bu, dizilenebilen çok sayıda molekül elde edilerek hata engellenebilir. Nanopore teknolojisi, çevresel ve metagenomik örnekleri dizilemek için kullanılmıştır, şu anda uzay istasyonundadır ve bakteri suşu tanımlaması için kullanılmaktadır. Viral genomlar, çevresel gözetim ve haplotipleme, Min. ION kullanılarak gerçekleştirildi. Nanopore teknolojisi, Pac. Bio teknolojisine benzer şekilde baz modifikasyonlarını da belirleyebilir ve epigenetik olayların kolayca tanımlanmasını sağlar. Nanogözenek dizileme, doğrudan RNA dizilemesinin yanı sıra PCR içermeyen c. DNA dizilimi de sunar. Bu nedenle, nanogözenek dizileme, nispeten düşük maliyetli DNA ve RNA dizileme, çevresel izleme ve genotipleme sunma potansiyeline sahiptir.

Dördüncü Nesil Dizileme. Oxford Nanopore


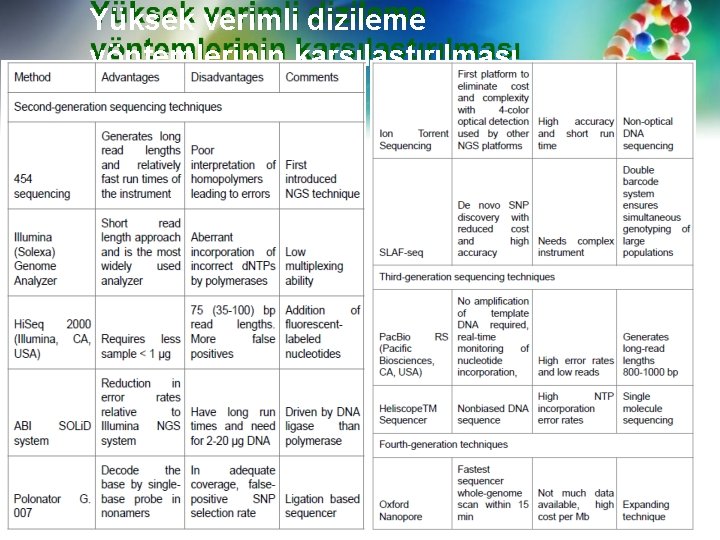
Yüksek verimli dizileme yöntemlerinin karşılaştırılması

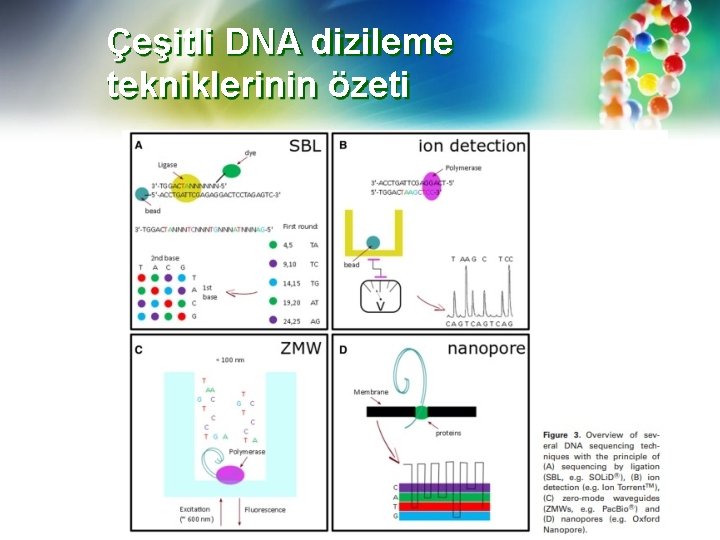
Çeşitli DNA dizileme tekniklerinin özeti

Kaynakça • • • Brigitte Bruijns, Roald Tiggelaar, Han Gardeniers. 2018. Massively parallel sequencing techniques forensics: A review. Electrophoresis 2018, 0, 1– 13 1 Barton E. Slatko, Andrew F. Gardner, and Frederick M. Ausubel. 2018. Overview of Next Generation Sequencing Technologies. Curr Protoc Mol Biol. 2018 April ; 122(1): e 59. doi: 10. 1002/cpmb. 59 Srilakshmi Srinivasan and Jyotsna Batra. Four Generations of Sequencing- Is it ready for the Clinic Yet? Journal of Next Generation Sequencing & Applications. DOI: 10. 4172/24699853. 1000107 Sara Goodwin, John D. Mc. Pherson and W. Richard Mc. Combie. Coming of age: ten years of next-generation sequencing Technologies. NATURE REVIEWS, VOLUME 17 | JUNE 2016 | Thompson, J. F. , & Steinmann, K. E. (2010). Single molecule sequencing with a Heli. Scope genetic analysis system. Current protocols in molecular biology, Chapter 7, Unit 7. 10. https: //doi. org/10. 1002/0471142727. mb 0710 s 92 Yanxiao Feng, Yuechuan Zhang, Cuifeng Ying, Deqiang Wang, Chunlei Du, Nanoporebased Fourth-generation DNA Sequencing Technology, Genomics, Proteomics & Bioinformatics, Volume 13, Issue 1, 2015, 4 -16 https: //doi. org/10. 1016/j. gpb. 2015. 01. 009.
 Nesl - request to authenticate the debt
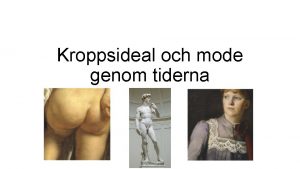
Nesl - request to authenticate the debt Skönhetsideal genom tiderna
Skönhetsideal genom tiderna Nils holgerssons underbara resa genom sverige
Nils holgerssons underbara resa genom sverige Värmeflöde
Värmeflöde Delen genom det hela
Delen genom det hela Genom
Genom Türkiye genom projesi
Türkiye genom projesi Blodets väg genom hjärtat
Blodets väg genom hjärtat Name of presentation company name
Name of presentation company name Name of presentation company name
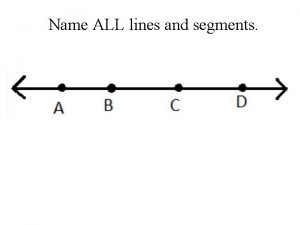
Name of presentation company name Name all the lines
Name all the lines Damien ah yen
Damien ah yen Kg hg dag g
Kg hg dag g Anne laure wu tiu yen
Anne laure wu tiu yen Bệnh bazodo
Bệnh bazodo Contoh ukara atur pangapura
Contoh ukara atur pangapura Yen's algorithm python
Yen's algorithm python Ngadeg ngapurancang
Ngadeg ngapurancang Luke yen
Luke yen Prepare a service blueprint for commuter cleaning
Prepare a service blueprint for commuter cleaning Apa jejibahane pambiwara yaiku
Apa jejibahane pambiwara yaiku Em khao khát ước mơ khắp nơi bình yên
Em khao khát ước mơ khắp nơi bình yên New service development in service marketing
New service development in service marketing Wangsalan, yaiku
Wangsalan, yaiku Ian yen
Ian yen Yen-jie lee
Yen-jie lee Private company vs public company
Private company vs public company Winding up of a company
Winding up of a company Holding company and subsidiary company
Holding company and subsidiary company Multinational vs international company
Multinational vs international company What type of company was the virginia company
What type of company was the virginia company Client company name
Client company name Place stamp here
Place stamp here Company name (optional
Company name (optional Company slogan here
Company slogan here David cook company
David cook company Company name logo tagline
Company name logo tagline Arti company name
Arti company name Enter your company name
Enter your company name Underlying magic slide
Underlying magic slide Kfc history and background
Kfc history and background Insert company name
Insert company name Apa arti company name
Apa arti company name Logo www
Logo www French east india company logo
French east india company logo Tsql
Tsql Disaster recovery plan for manufacturing company
Disaster recovery plan for manufacturing company Company name title
Company name title Slogan here
Slogan here Slogan shadow
Slogan shadow Get kanban game
Get kanban game Tesla advertising campaign
Tesla advertising campaign Solutions company name
Solutions company name Name of company
Name of company Company name (optional
Company name (optional Company name your slogan here
Company name your slogan here First name and last name example
First name and last name example Name above every other name
Name above every other name