xidos cidos INTEGRANTES Camila Poma Ticona Jos Zavala









- Slides: 12

Óxidos ácidos INTEGRANTES: - Camila Poma Ticona - José Zavala Porta - Steven Carpio Tipismana - Gonzalo Sotelo Mauri

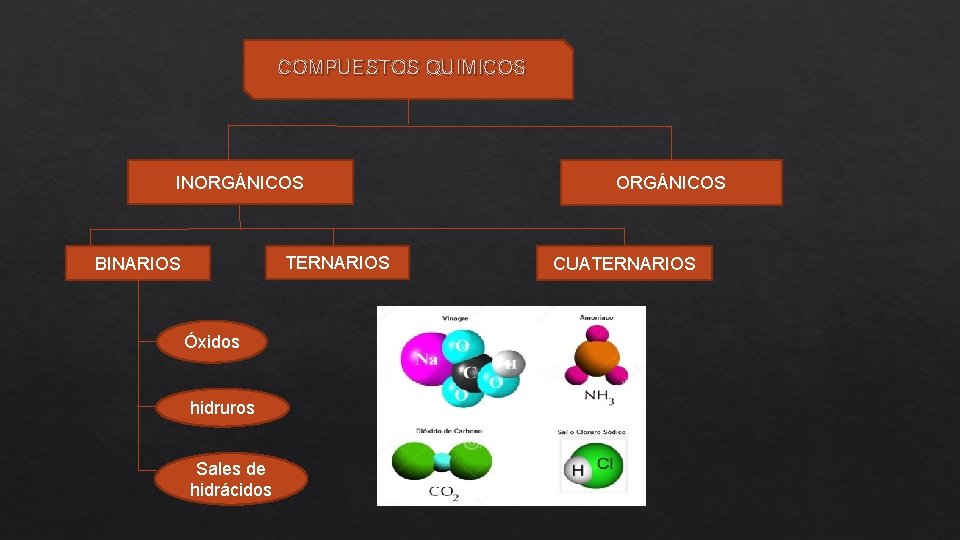
COMPUESTOS QUIMICOS INORGÁNICOS TERNARIOS BINARIOS Óxidos hidruros Sales de hidrácidos ORGÁNICOS CUATERNARIOS

Óxidos: Compuestos binarios formados por oxígenos y un elemento químico. ÓXIDO BASICO ÓXIDO ÁCIDO

Óxidos Ácidos: Compuestos binarios formados por oxigeno y un no metal. Óxidos Básicos: Compuestos binarios formados por oxigeno y un metal.

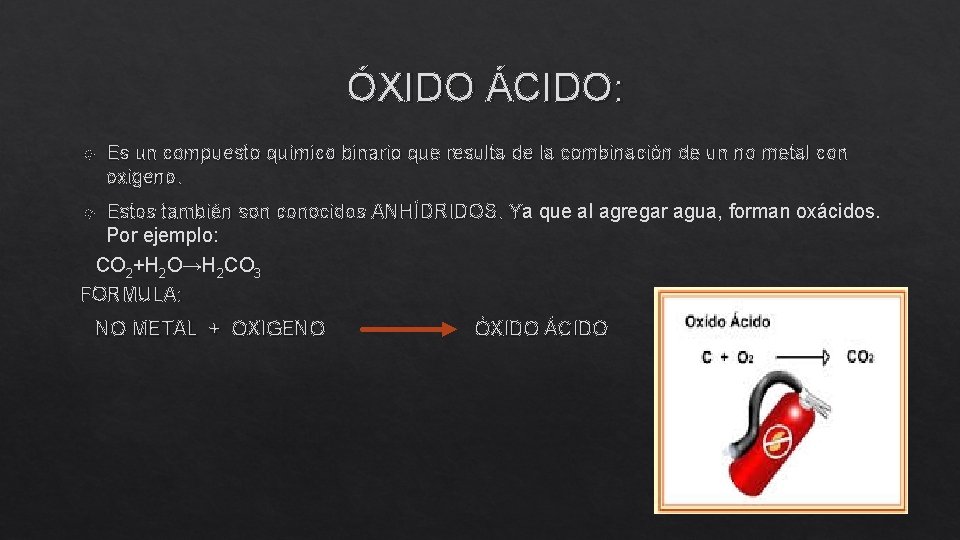
ÓXIDO ÁCIDO: Es un compuesto químico binario que resulta de la combinación de un no metal con oxigeno. Estos también son conocidos ANHÍDRIDOS. Ya que al agregar agua, forman oxácidos. Por ejemplo: CO 2+H 2 O→H 2 CO 3 FORMULA: NO METAL + OXIGENO ÓXIDO ÁCIDO

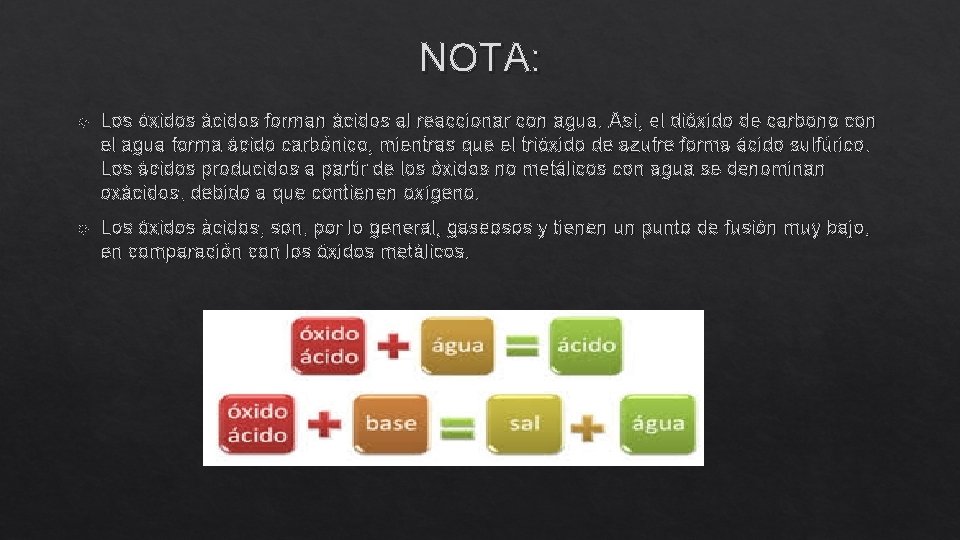
NOTA: Los óxidos ácidos forman ácidos al reaccionar con agua. Así, el dióxido de carbono con el agua forma ácido carbónico, mientras que el trióxido de azufre forma ácido sulfúrico. Los ácidos producidos a partir de los óxidos no metálicos con agua se denominan oxácidos, debido a que contienen oxígeno. Los óxidos ácidos, son, por lo general, gaseosos y tienen un punto de fusión muy bajo, en comparación con los óxidos metálicos.

NOMENCLATURA La nomenclatura química es el conjunto de reglas que se usan para nombrar a las combinaciones existentes entre los elementos y los compuestos químicos. Al igual que en el caso de la nomenclatura biológica, existe una autoridad internacional encargada de establecer estas reglas.

NOMENCLATURA TRADICIONAL Primero se escribe el nombre genérico que en este caso es "anhídrido". El resto del nombre dependerá de la cantidad de estados de oxidación que presente dicho elemento. Si presenta un estado de oxidación, continúa el nombre del no metal. Ej: B 2 O 3 = Anhídrido de Boro. Si presenta dos estados de oxidación, el nombre del no metal puede terminar en «oso» (si es el menor) o en «ico» (si es el mayor). Ej. El carbono presenta dos estados de oxidación, +2 y +4, en el primer caso: CO = Anhídrido Carbonoso; y en el segundo CO 2 = Anhídrido Carbónico. Si presenta tres estados de oxidación, el nombre del no metal puede verse modificado de la siguiente manera: . . . oso para el menor; . . . ico y per. . . ico para el mayor. Ej. : cuando el manganeso actúa como no metal, tiene tres estados de oxidación: +4, +6 y +7, las fórmulas moleculares y nomenclaturas correspondientes son: Mn. O 2 = Anhidro Manganoso Mn. O 3 = Anhidro Mangánico Mn 2 O 7 = Anhidro Permangánico

Si presenta cuatro estados de oxidación, el nombre del no metal puede modificarse de la siguiente manera: hipo. . . oso para el menor; . . . oso; . . . ico y per. . . ico para el mayor. Ej: el cloro presenta cuatro estados de oxidación: +1, +3, +5 y +7, las fórmulas moleculares y nomenclaturas correspondientes son: Cl 2 O = Anhídrido hipocloroso. Cl 2 O 3 = Anhídrido cloroso. Cl 2 O 5 = Anhídrido clórico. Cl 2 O 7 = Anhídrido perclórico.

Nomenclatura Estequiométrica o Sistémica (por atomicidad): Los óxidos ácidos se nombrarán en función de la cantidad de átomos que presenta el compuesto en su fórmula molecular. Primero se hará referencia al oxígeno y luego al no metal. Para ello se usarán prefijos: -mono (para uno, sólo se utiliza para el oxígeno), di (para dos), tri (para tres), etc. Ej. Cl 2 O = Monóxido de dicloro. Cl 2 O 3 = Trióxido de dicloro. Cl 2 O 5 = Pentóxido de dicloro. Cl 2 O 7 = Heptóxido de dicloro.

Nomenclatura de Stock: Se utiliza el nombre genérico "óxido", luego se indica el nombre del elemento y finalmente se coloca entre paréntesis y en números romanos el estado de oxidación correspondiente. Ej: También el Boro puede ser usado como ejemplo. Cl 2 O = Óxido de cloro (I). Cl 2 O 3 = Óxido de cloro (III). Cl 2 O 5 = Óxido de cloro (V). Cl 2 O 7 = Óxido de cloro (VII).

BIBLIOGRAFIA: http: //tareassbuenass. blogspot. pe/2012/02/oxidos-basicos-y-oxidos-acidos. html http: //definicion. de/nomenclatura/






















