Wyjcie mysich oocytw z II metafazy wymaga nienaruszonego














- Slides: 20

Wyjście mysich oocytów z II metafazy wymaga nienaruszonego wrzeciona podziałowego podczas wewnątrzkomórkowego wzrostu stężenia wapnia Nicola J. Winston, Orla Mc. Guinness, Martin H. Johnson, Bernard Maro – 1995 rok, journal of cell science Irma Otrębska

Co wiemy do tej pory? �Dojrzałe, owulowane oocyty zatrzymują się w II metafazie dopóki nie zostaną aktywowane lub zapłodnione �Pociąga to za sobą serię oscylacyjnych zmian stężenia jonów wapnia �Wzrost stężenia wapnia powoduje inaktywacje MPF �Cyklina jest regulatorowym substratem MPF i jej destrukcja jest wymagana do wyjścia z metafazy �Do degradacji cykliny B niezbędna jest obecność nienaruszonego wrzeciona podziałowego, ponieważ w obecności nokodazolu poziom degradacji cykliny spada.

Nokodazol �Działa depolimeryzująco na mikrotubule komórek �Wejście w interfazę może być opóźnione jeżeli oocyty zostaną zapłodnione w obecności nokodazolu �Wrzeciono podziałowe ulega degradacji, a chromosomy ulegają rozproszeniu �Usunięcie nokodazolu powoduje gromadzenie się wokół grup chromosomów skupisk mikrotubul �Każde powstałe wrzeciono kończy podział i odłączanych jest wiele ciałek kierunkowych �Oocyt przechodzi w interfazę �W przypadku aktywacji, np. etanolem oocyty nie kontynuują mejozy samoistnie

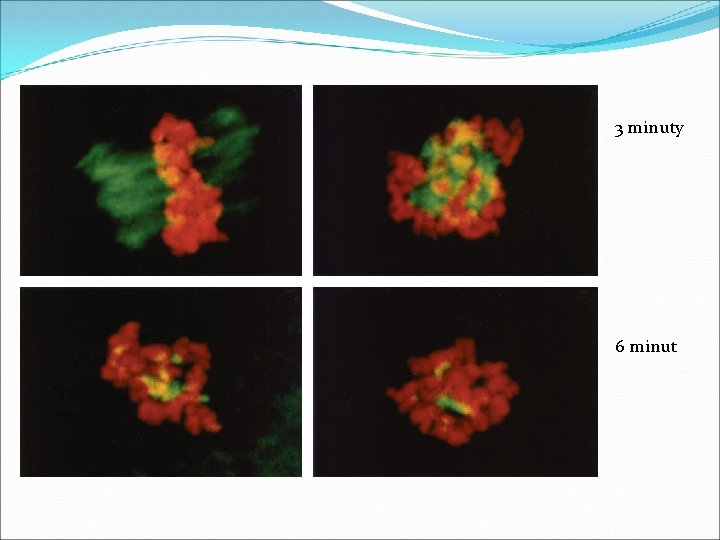
kontrola 1 minuta

3 minuty 6 minut

Materiały i metody � od sześcio- do dziesięcio- tygodniowe samice �Dootrzewna iniekcja PMSG 48 h przed sekcją �h. CG 13 godzin przed sekcją �Komórki pęcherzykowe usunięte przez hialuronidazę �Osłonki przejrzyste usunięte przez Tyrode �Hodowane in vitro w pożywce M 2+BSA �Barwienia immunocytochemiczne �Badanie aktywności kinazy histonu H 1 �Badanie poziomu wapnia wewnątrz komórki fura-2 (barwnik fluoroscencyjny wiążący się w wolnymi jonami wapnia)

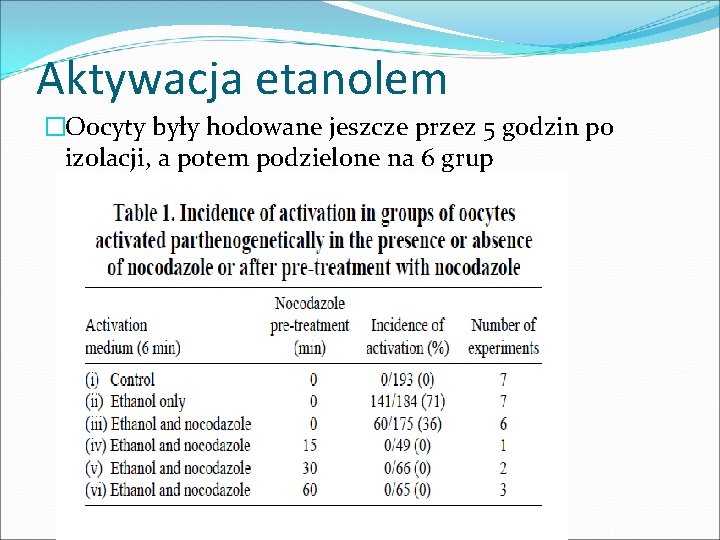
Aktywacja etanolem �Oocyty były hodowane jeszcze przez 5 godzin po izolacji, a potem podzielone na 6 grup

�Brak aktywacji w grupie kontrolnej i u tych oocytów które wcześniej były poddane działaniu nokodazolu �O połowę zmalał poziom aktywacji między aktywowanych etanolem, a etanolem z dodatkiem nokodazolu kontrola Po 60 minutach

�Oocyty pozostawiono w M 2+BSA na godzinę i znowu poddano aktywacji �Zaobserwowano drugie uwolnienie wapnia �Oocyty zostały aktywowane i wyrzuciły II ciałka kierunkowe, co zostało potwierdzone po wybarwieniu preparatów (oocyty były w telofazie)

Aktywność kinazy histonu H 1 Kinaza odpowiadająca za kondensację chromatyny Wysoka aktywność w nieaktywnych oocytach Spada gwałtownie po aktywacji Oocyty po inkubacji z nokodazolem nie wykazują spadku aktywności Po godzinnej inkubacji w zwykłej pożywce, i po kolejnej aktywacji etanolem, aktywność kinazy spada

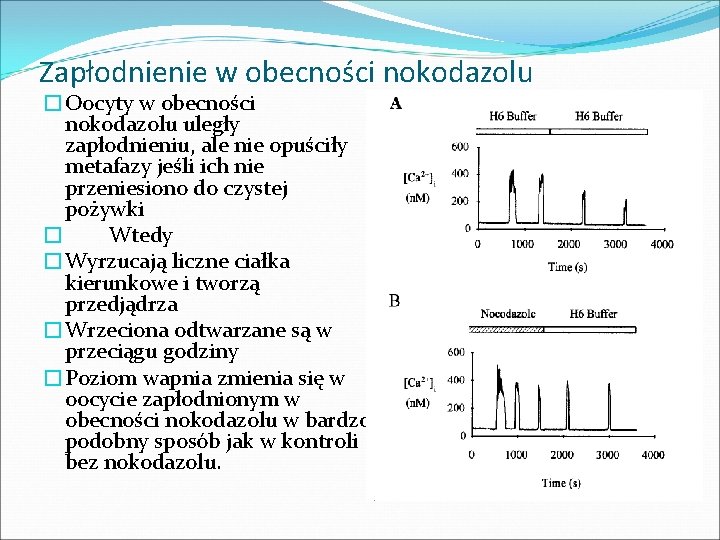
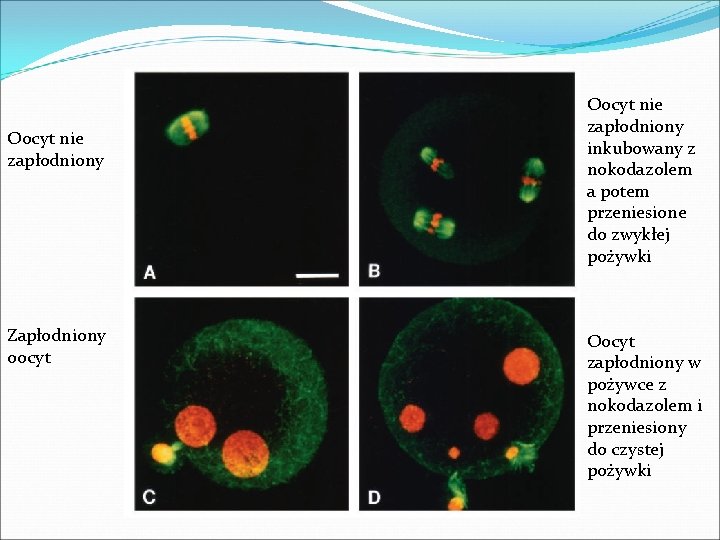
Zapłodnienie w obecności nokodazolu �Oocyty w obecności nokodazolu uległy zapłodnieniu, ale nie opuściły metafazy jeśli ich nie przeniesiono do czystej pożywki � Wtedy �Wyrzucają liczne ciałka kierunkowe i tworzą przedjądrza �Wrzeciona odtwarzane są w przeciągu godziny �Poziom wapnia zmienia się w oocycie zapłodnionym w obecności nokodazolu w bardzo podobny sposób jak w kontroli bez nokodazolu.

Oocyt nie zapłodniony Zapłodniony oocyt Oocyt nie zapłodniony inkubowany z nokodazolem a potem przeniesione do zwykłej pożywki Oocyt zapłodniony w pożywce z nokodazolem i przeniesiony do czystej pożywki

Zablokowanie wzrostu stężenia wolnych jonów wapnia �Oocyty zostały podzielone na dwie grupy � 1 - przeniesione bezpośrednio po zapłodnieniu do pożywki zawierającej BAPTA-AM (bufor zapobiegający zmianom stężenia wapnia) � 2 - najpierw przeniesione do pożywki z nokodazolem, bez wapnia (by wyczerpać wewnątrzkomórkowe zasoby tego pierwiastka). Potem do pożywki bez wapnia.

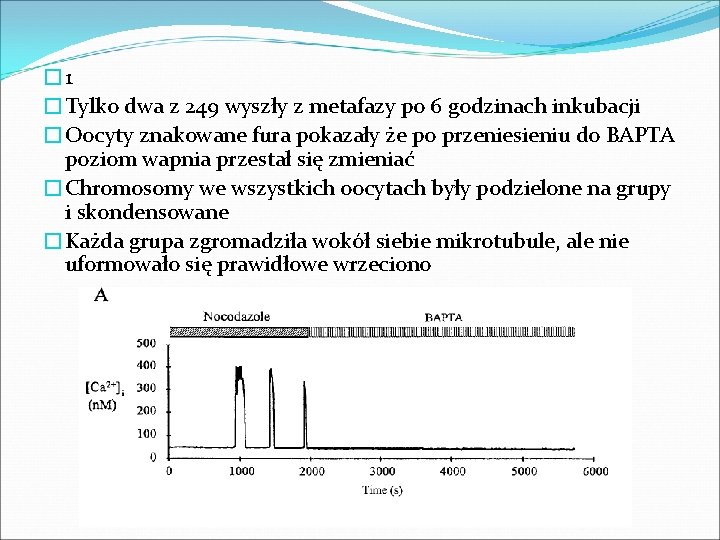
� 1 �Tylko dwa z 249 wyszły z metafazy po 6 godzinach inkubacji �Oocyty znakowane fura pokazały że po przeniesieniu do BAPTA poziom wapnia przestał się zmieniać �Chromosomy we wszystkich oocytach były podzielone na grupy i skondensowane �Każda grupa zgromadziła wokół siebie mikrotubule, ale nie uformowało się prawidłowe wrzeciono

�Ten sam eksperyment powtórzono z dodatkiem cytochalazyny D podczas inseminacji (zapobiega rozejściu się chromosomów) �Powstało wrzeciono podziałowe ale w lekko nieprawidłowym kształcie �Tylko 1% oocytów wyszło z metafazy na 186 w porównaniu z kontrolą 51/196 (26%) +BAPTA +cytochalazyna D

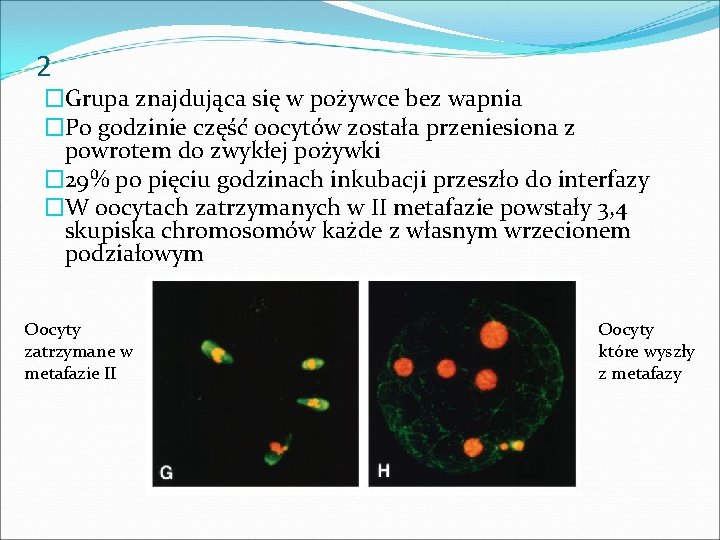
2 �Grupa znajdująca się w pożywce bez wapnia �Po godzinie część oocytów została przeniesiona z powrotem do zwykłej pożywki � 29% po pięciu godzinach inkubacji przeszło do interfazy �W oocytach zatrzymanych w II metafazie powstały 3, 4 skupiska chromosomów każde z własnym wrzecionem podziałowym Oocyty zatrzymane w metafazie II Oocyty które wyszły z metafazy

Znakowanie fura Przeniesienie oocytów z powrotem do pożywki z wapniem spowodowało powrót zmian stężenia wapnia (8/10) Dwa z nich wyrzuciły drugie ciałka kierunkowe

Wnioski � Oocyty inseminowane w obecności nokodazolu, czyli takie które nie utworzyły wrzeciona podziałowego, nie wychodzą z metafazy II � Nie wytwarzanie wrzeciona nie działa hamująco na zmiany stężenia wapnia � Usunięcie z nokodazolu powoduje możliwość wznowienia cyklu mejotycznego � W oocytach inseminowanych cały czas po przeniesieniu trwają zmiany stężenia wapnia i nie potrzebują żadnego dodatkowego bodźca do przejścia do interfazy � Oocyty wcześniej aktywowane etanolem, żeby kontynuować podział, muszą być aktywowane jeszcze raz � Przy braku wapnia i usunięciu nokodazolu, wrzeciona podziałowe zostały odnowione, ale mejoza nie była kontynuowana � Po przeniesieniu do pożywki z wapniem oocyty przechodzą do mejozy

Wnioski 2 �Do wyjścia z metafazy wymagana jest degradacja cykliny i dezaktywację MPF �Degradacja cykliny B wymaga obecności wrzeciona i jest kontynuowana podczas trwania metafazy II na podobnym poziomie, i jest rekompensowana jednoczesną syntezą �Wapń nie rozpoczyna degradacji cykliny, a raczej podnosi jej poziom �Inseminowane oocyty „ pamiętają o aktywacji”. Cały czas obserwowane są skoki stężenia wapnia �Aktywacja mechanizmu degradacji cykliny zachodzi tylko podczas podwyższonego stężenia wapnia

Dziękuje za uwagę!