Wrmelehre Erster Hauptsatz und Zustandsnderungen Inhalt Die Temperatur













- Slides: 24

Wärmelehre Erster Hauptsatz und Zustandsänderungen

Inhalt • Die Temperatur • Energiezufuhr in Form von Wärme – Spezifische Wärme • Erster Hauptsatz der Wärmelehre • Wirkung der Temperatur auf physikalische Eigenschaften: Thermische Ausdehnung • Zweiter Hauptsatz der Wärmelehre • Die Entropie: – Definition nach Clausius: Maß für die Möglichkeit, einen Vorgang mit möglichst wenig Energiezufuhr umzukehren („Reversible Prozesse“) – Definition nach Boltzmann: Maß für die Gleichverteilung von Orten und Impulsen der Teilchen

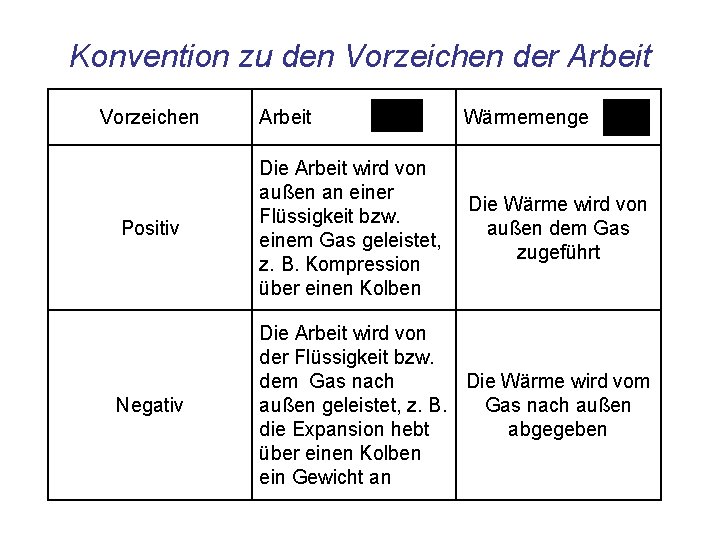
Konvention zu den Vorzeichen der Arbeit Vorzeichen Arbeit Wärmemenge Positiv Die Arbeit wird von außen an einer Flüssigkeit bzw. einem Gas geleistet, z. B. Kompression über einen Kolben Die Wärme wird von außen dem Gas zugeführt Negativ Die Arbeit wird von der Flüssigkeit bzw. Die Wärme wird vom dem Gas nach außen geleistet, z. B. die Expansion hebt abgegeben über einen Kolben ein Gewicht an

Möglichkeiten der Energiezufuhr am Beispiel eines Gases , Mechanische Arbeit erhöht die Geschwindigkeit der Teilchen zunächst in eine Richtung, aber bald darauf verteilt sich die Energie auf alle Richtungen Wärmezufuhr durch Kontakt der Teilchen mit der heissen Wand erhöht auch die Geschwindigkeit der Teilchen, aber in alle Richtungen

Gleichverteilung in der Thermodynamik • Unabhängig von der Ursache – Arbeitszufuhr durch mechanische Arbeit, z. B. mit gerichteter Bewegung eines Kolbens, – Energiezufuhr durch Erwärmung • wird in einem thermodynamischen System die Energie - nach kurzer Zeit - auf alle Freiheitsgrade gleichverteilt

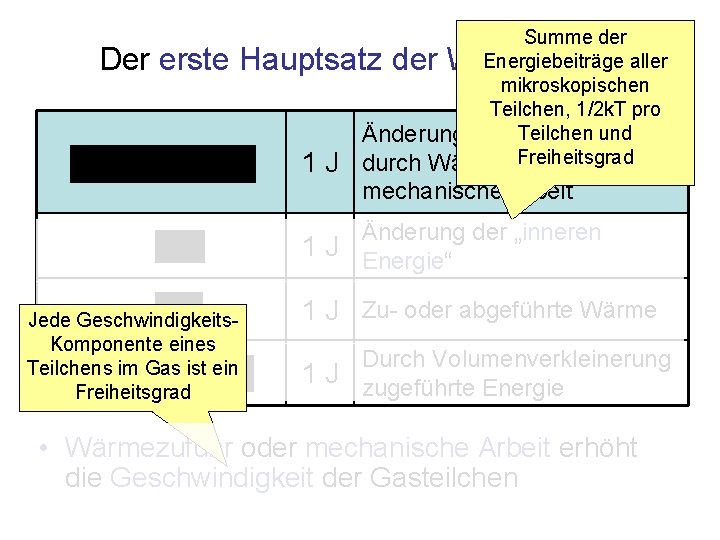
Summe der Energiebeiträge aller mikroskopischen Teilchen, 1/2 k. T pro Teilchen und Änderung der inneren Energie Freiheitsgrad durch Wärme oder Der erste Hauptsatz der Wärmelehre 1 J mechanische Arbeit Änderung der „inneren 1 J Energie“ Jede Geschwindigkeits. Komponente eines Teilchens im Gas ist ein Freiheitsgrad 1 J Zu- oder abgeführte Wärme Durch Volumenverkleinerung 1 J zugeführte Energie • Wärmezufuhr oder mechanische Arbeit erhöht die Geschwindigkeit der Gasteilchen

Speziell: Ideales Gas Änderung der inneren Energie 1 J durch Wärme oder mechanische Arbeit Änderung der „inneren 1 J Energie“ beim idealen Gas 1 J Zu- oder abgeführte Wärme Durch Volumenverkleinerung 1 J zugeführte Energie • Wärmezufuhr oder mechanische Arbeit erhöht die Geschwindigkeit der Gasteilchen

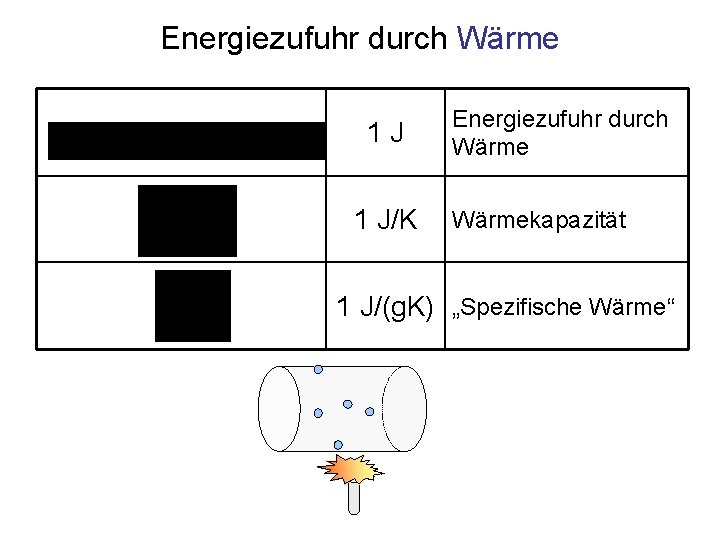
Energiezufuhr durch Wärme 1 J 1 J/K Energiezufuhr durch Wärmekapazität 1 J/(g. K) „Spezifische Wärme“

Versuch zur spezifischen Wärme • Erwärmung eines Liter Wassers in einem elektrischen Wasserkocher • Leistung nach Typenschild • Berechnung der Energie zur Erwärmung bis um Siedepunkt • Abschätzung der Aufheiz-Zeit bis zum Sieden

Energiezufuhr am idealen Gas durch mechanische Arbeit 1 J Temperaturerhöhung – bei konstantem Druck - durch mechanische Arbeit

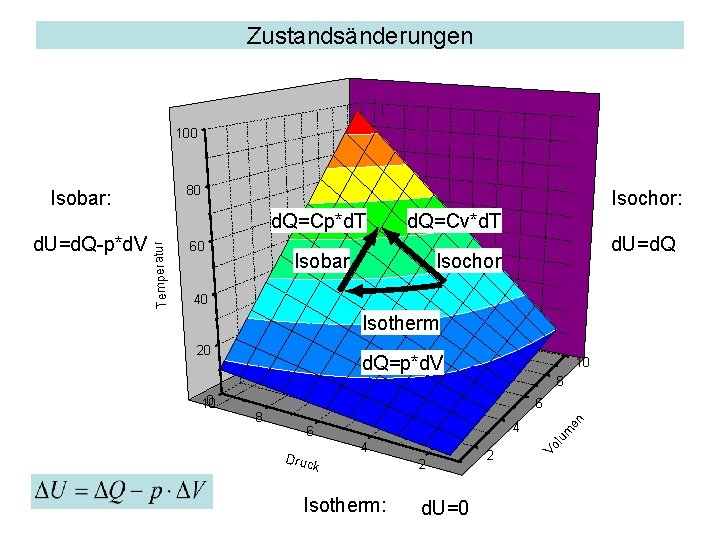
Zustandsänderungen Bei allen Zustandsänderungen eines idealen Gases gilt • Die allgemeine Gasgleichung • Der 1. Hauptsatz der Wärmelehre Man unterscheidet folgende Zustandsänderungen: • Isochor: d. V=0, keine mechanische Arbeit • Isobar: Konstanter Druck • Isotherm: d. T=0, konstante innere Energie • Adiabatisch: d. Q=0, keine Energiezufuhr durch Wärme

Zustandsänderungen 100 80 Isochor: 60 d. Q=Cv*d. T Isobar d. U=d. Q Isochor 40 Isotherm 20 d. Q=p*d. V 10 8 4 6 Druc k 4 Isotherm: en 6 8 m 0 10 lu d. U=d. Q-p*d. V Temperatur d. Q=Cp*d. T 2 d. U=0 2 Vo Isobar:

Isochore Zustandsänderung Allg. Gasgleichung 1. Hauptsatz Beide Gleichungen müssen immer erfüllt sein 1 J Isochor, konstantes Volumen d. V=0 1 J Die zugeführte Wärme leistet keine Arbeit, sie erhöht nur die innere Energie und damit die Temperatur

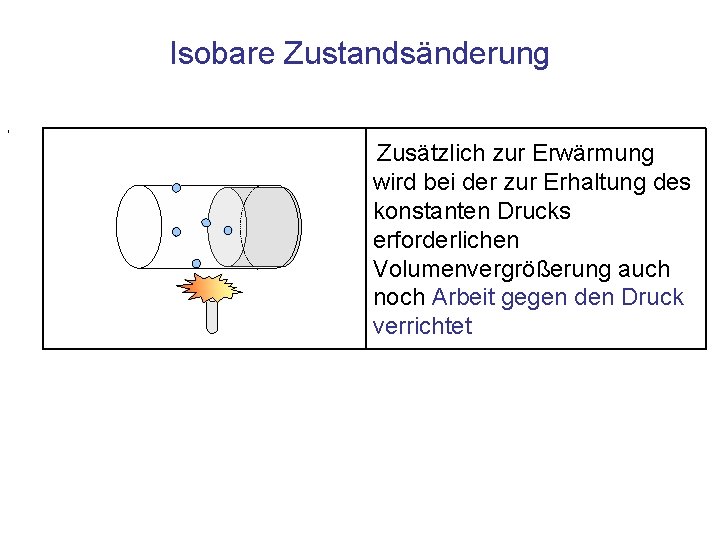
Isobare Zustandsänderung , Zusätzlich zur Erwärmung wird bei der zur Erhaltung des konstanten Drucks erforderlichen Volumenvergrößerung auch noch Arbeit gegen den Druck verrichtet

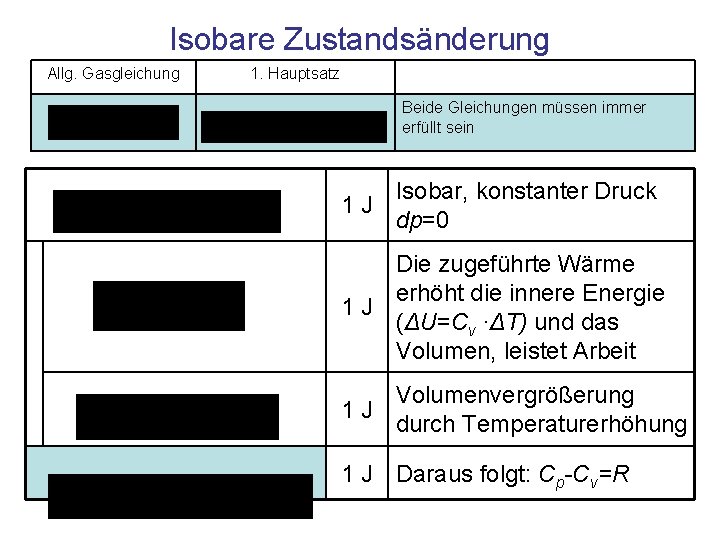
Isobare Zustandsänderung Allg. Gasgleichung 1. Hauptsatz Beide Gleichungen müssen immer erfüllt sein Isobar, konstanter Druck 1 J dp=0 Die zugeführte Wärme erhöht die innere Energie 1 J (ΔU=Cv ·ΔT) und das Volumen, leistet Arbeit Volumenvergrößerung 1 J durch Temperaturerhöhung 1 J Daraus folgt: Cp-Cv=R

Spezifische Wärmen Cp-Cv=R • Die spezifische Wärme bei konstantem Druck ist immer höher als die bei konstantem Volumen – Zusätzlich zur Erwärmung wird bei der zur Erhaltung des konstanten Drucks erforderlichen Volumenvergrößerung auch noch Arbeit gegen den Druck verrichtet • In Festkörpern ist die spezifische Wärme durch die Zahl der Atome gegeben, unabhängig von der Art des Elements (Dulong-Petit Regel) – Jeder Freiheitsgrad beansprucht cv=k/2, in einem mol cv, m=R/2

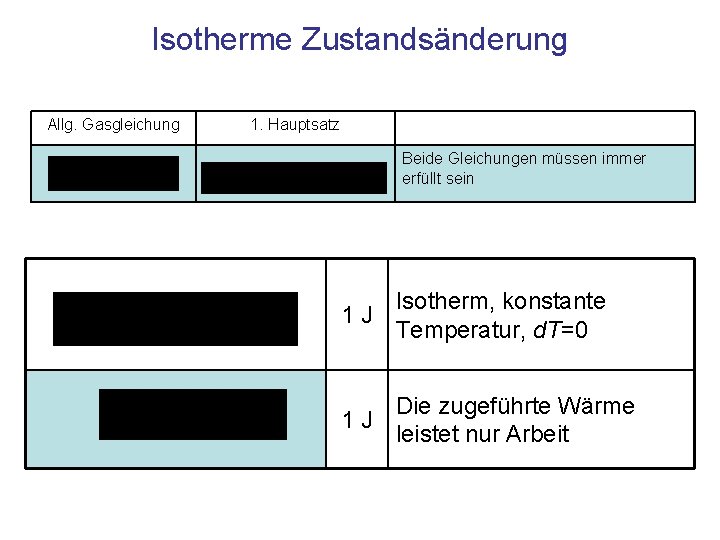
Isotherme Zustandsänderung Allg. Gasgleichung 1. Hauptsatz Beide Gleichungen müssen immer erfüllt sein 1 J Isotherm, konstante Temperatur, d. T=0 Die zugeführte Wärme 1 J leistet nur Arbeit

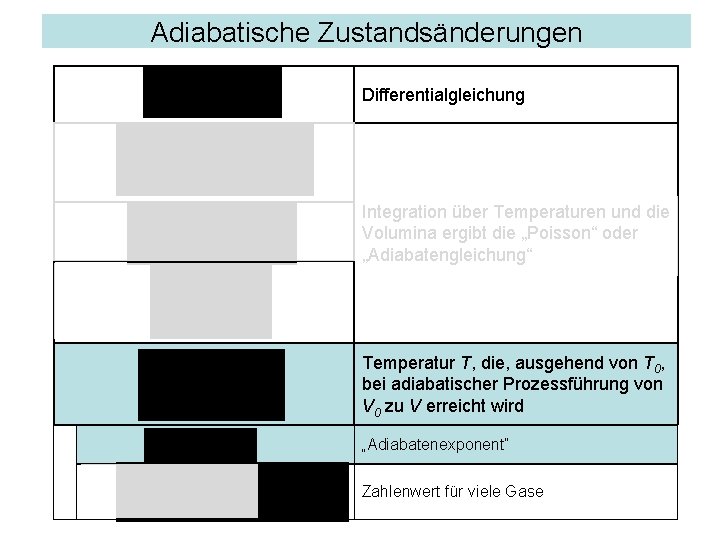
Adiabatische Zustandsänderungen Allg. Gasgleichung 1. Hauptsatz Beide Gleichungen müssen immer erfüllt sein Adiabatisch, ohne Wärmezufuhr: Die zugeführte Arbeit ändert die innere Energie Im idealen Gas ist die Änderung der inneren Energie gleich der Änderung der Translations-Energie, sie ist proportional zur Temperaturerhöhung. p durch V, T aus der allgemeinen Gasgleichung ersetzt: Differentialgleichung für T, V

Adiabatische Zustandsänderungen Differentialgleichung Integration über Temperaturen und die Volumina ergibt die „Poisson“ oder „Adiabatengleichung“ Temperatur T, die, ausgehend von T 0, bei adiabatischer Prozessführung von V 0 zu V erreicht wird „Adiabatenexponent“ Zahlenwert für viele Gase

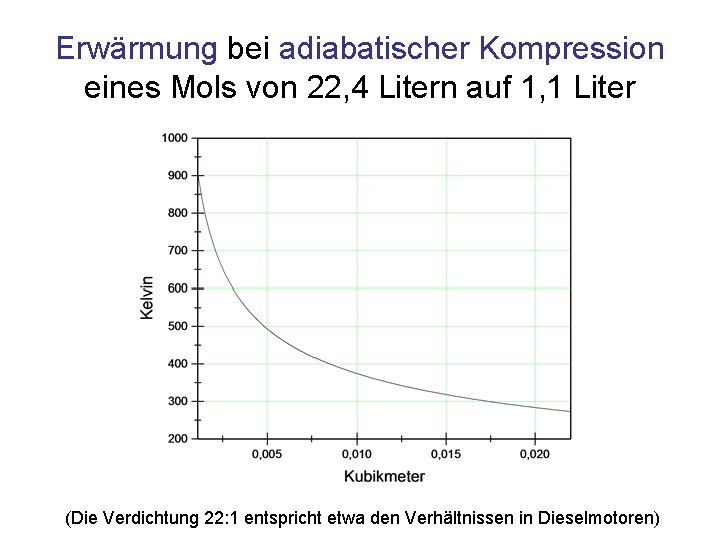
Erwärmung bei adiabatischer Kompression eines Mols von 22, 4 Litern auf 1, 1 Liter (Die Verdichtung 22: 1 entspricht etwa den Verhältnissen in Dieselmotoren)

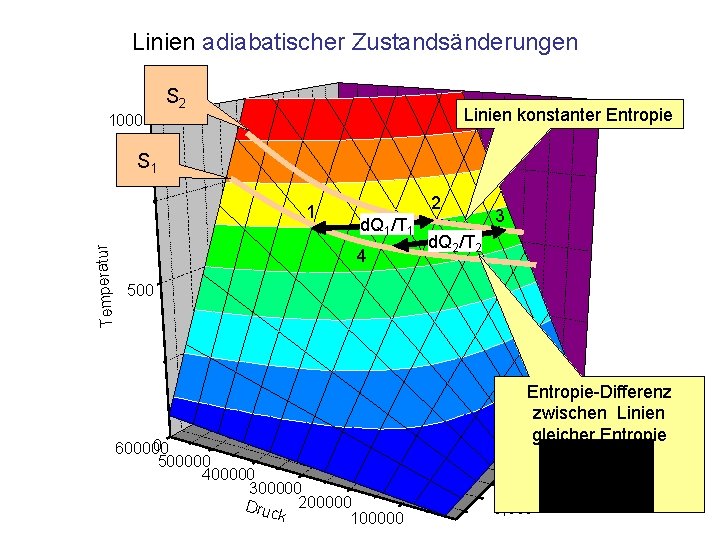
Linien adiabatischer Zustandsänderungen S 2 Linien konstanter Entropie 1000 S 1 2 d. Q 1/T 1 4 3 d. Q 2/T 2 500 en 0, 015 0, 010 lu m 0 600000 500000 400000 300000 Druc 200000 k 100000 Entropie-Differenz 0, 030 zwischen 0, 025 Linien gleicher 0, 020 Entropie 0, 005 Vo Temperatur 1

Versuch adiabatische Kompression • Adiabatische Kompression / Expansion eines Luftvolumens. Ein Thermoelement misst die Temperaturerhöhung / Erniedrigung

Zusammenfassung Bei allen Zustandsänderungen eines idealen Gases gilt • Die allgemeine Gasgleichung • Der 1. Hauptsatz der Wärmelehre Man unterscheidet folgende Zustandsänderungen: • Isochor: d. V=0, keine mechanische Arbeit • Isobar: Konstanter Druck • Isotherm: d. T=0, konstante innere Energie • Adiabatisch: d. Q=0, keine Energiezufuhr durch Wärme • Besonders bevorzugt: Zustandsänderungen ohne Wärmeaustausch (adiabatische Zustandsänderungen) – Linien gleicher Entropie auf der p, V, T Fläche

Finis
 Erster hauptsatz der thermodynamik
Erster hauptsatz der thermodynamik Erster hauptsatz der thermodynamik
Erster hauptsatz der thermodynamik Die unendliche geschichte
Die unendliche geschichte Sprinkaan en die mier
Sprinkaan en die mier 2 hauptsatz der thermodynamik
2 hauptsatz der thermodynamik Hauptsatz relativsatz
Hauptsatz relativsatz Trennbare verben in nebensatz
Trennbare verben in nebensatz Physiologie definition
Physiologie definition 2ter hauptsatz der thermodynamik
2ter hauptsatz der thermodynamik Erste tag der woche
Erste tag der woche Marion erster rose
Marion erster rose Max und moritz hühner
Max und moritz hühner Elternabend herzlich willkommen
Elternabend herzlich willkommen Exponentielle glättung 2 ordnung excel
Exponentielle glättung 2 ordnung excel Mein erster schultag aufsatz
Mein erster schultag aufsatz Management summary inhalt
Management summary inhalt Projektstatusbericht inhalt
Projektstatusbericht inhalt Mario und der zauberer epoche
Mario und der zauberer epoche Der gute mensch von sezuan interpretation
Der gute mensch von sezuan interpretation Hiatus subinguinalis
Hiatus subinguinalis Papa hamlet sekundenstil beispiel
Papa hamlet sekundenstil beispiel Temporalis profunda
Temporalis profunda Hans fallada kleiner mann was nun inhalt
Hans fallada kleiner mann was nun inhalt Projektstatusbericht inhalt
Projektstatusbericht inhalt Ronja räubertochter buch zusammenfassung
Ronja räubertochter buch zusammenfassung