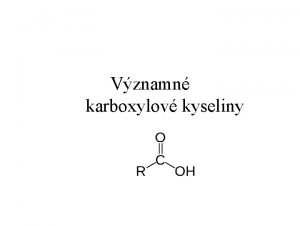Vznamn oxidy Voda Voda systematick nzev oxid vodn
















- Slides: 17

Významné oxidy: Voda • Voda , systematický název oxid vodný nebo též oxidan • Oxid vodný • Voda: Spolu se vzduchem základní podmínka života na Zemi • Za běžných podmínek (20°C, tlak 1 atmosféry = 101 325 Pa) je to čirá bezbarvá kapalina, v silnější vrstvě namodralá • Hustota vody je nejvyšší při 4 °C • 4 °C … 999, 97 g/ml (kg/l) • 20 °C … 998, 205 g/ml (kg/l) • 100 °C … 958, 35 g/ml (kg/l)

Významné oxidy: Voda • Teplota tání (standardní tlak): 0 °C, teplota varu (standardní tlak): 100 °C • Molekula vody

Významné oxidy: Oxid uhličitý • Názvosloví • Jiné názvy: kysličník uhličitý, suchý led (v pevném skupenství) • • • Za běžných podmínek bezbarvý plyn bez chuti a zápachu Při vyšších koncentracích má v ústech slabě nakyslou chuť Sublimuje při -78 °C Jedovatý jen při vysokých koncentracích (smrtelná dávka okolo 10%) https: //www. youtube. com/watch? v=HD 1 u. Vgq. Cb 14

Významné oxidy: Oxid uhelnatý • Názvosloví • Jiné názvy: kysličník uhelnatý Za běžných podmínek bezbarvý plyn bez chuti a zápachu Teplota tání: -205 °C Teplota varu: -192 °C Silně jedovatý: Má 200 x silnější vazbu na hemoglobin než kyslík , což vede k nedostatečnému prokrvení tkání (např. dlouhodobí kuřáci) • Otravy oxidem uhelnatým: Případy nekvalitních kamen • •

Oxidy síry SOX Oxid sirnatý , oxid siřičitý , oxid sírový Oxid sirnatý – velmi nestabilní, častěji dimerní forma Oxid siřičitý – bezbarvý, štiplavě páchnoucí, jedovatý plyn Oxid sírový – bezbarvý, štiplavě páchnoucí, jedovatý plyn – vzniká z oxidu siřičitého, s vodou tvoří kyselinu sírovou • Shrnutí: Kyselé deště vznikají slučováním oxidů síry s vodou • •

Kyselé deště: Krušné hory • Lesy poničené kyselým deštěm v Krušných horách
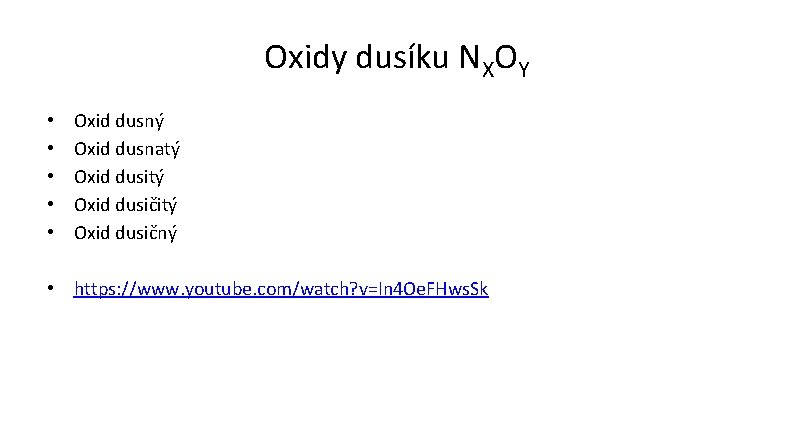
Oxidy dusíku NXOY • • • Oxid dusný Oxid dusnatý Oxid dusičitý Oxid dusičný • https: //www. youtube. com/watch? v=In 4 Oe. FHws. Sk

Oxid dusný N 2 O • Častější název: Rajský plyn (případně: azooxid) • Při vdechování působí stavy veselosti, případně hysterie, při vyšších dávkách útlum a spánek • Dlouhodobé nebo intenzivní vdechování může vést až ke smrti • Uvolňuje se z půdy, dále pak působením hnojiv • Má nepříznivé účinky na ozónovou vrstvu • S ozónem totiž reaguje • Je také skleníkovým plynem: 1 tuna N 2 O má 200 x silnější účinek než 1 tuna CO 2 a 10 x silnější účinek než 1 tuna CH 4 (methanu)

Významné halogenidy: Kuchyňská sůl • Kuchyňská sůl Na. Cl (chlorid sodný, kamenná sůl, halit) • Na. ICl-I • V lidském těle se hromadí ionty draslíku uvnitř buněk a ionty sodíku v mezibuněčném prostoru • Soli (ionty) v těle mají velký význam při transportu bílkovin • Sůl taje při 801 °C a vaří se při 1413 °C

Halogenovodíky (dvouprvkové kyseliny) • • Flurovodík HF Chlorovodík HCl Bromovodík HBr Jodovodík HI

Chlorovodík HCl Bezbarvý plyn Ve vodě tvoří roztok – kyselinu chlorovodíkovou Kyselina chlorovodíková je velmi silná kyselina Jiný název: Kyselina solná Vyskytuje se v žaludku všech savců (s výjimkou mravenečníků), často také u jiných tvorů • Nejúčinnější je v koncentraci 38% • Průmyslové využití: Nejčastěji 31%-ní roztok • • •

Tříprvkové kyseliny • • • Tříprvkové kyseliny: Obsahují vodík H, kyslík O a jeden další prvek Vodík ztrácí elektron, každý jeho atom má náboj HI Kyslík získává elektrony, každý jeho atom má náboj O-II Zbývající prvek má kladný náboj takový, aby součet zůstal nulový Podle náboje zbývajícího prvku pojmenujeme kyselinu

Kyselina dusičná HNO 3 • • Latinský název: aqua fortis = silná voda Velmi nestabilní kyselina, na vzduchu se rychle rozkládá Dříve: Rozklad chilského ledku (Na. NO 3), dnes spalováním amoniaku NH 3 Použití: Výroba dusíkatých hnojiv

Kyselina sírová H 2 SO 4 • Zastaralý název: Vitriol • Hustá olejnatá kapalina, neomezeně mísitelná s vodou • Španělská řeka Rio Tinto s vysokou koncentrací kyseliny sírové

Kyselina sírová H 2 SO 4 • Použití: Výroba průmyslových hnojiv, úprava kolových nápojů, elektrolyt v olověných akumulátorech, výroba syntetických vláken v textilním průmyslu

Lučavka královská • Lučavka královská (latinsky aqua regia = královská voda) je směs kyseliny dusičné a chlorovodíkové v poměru 1: 3 • 3 díly HCl a 1 díl HNO 3 • Tato kyselina rozpustí zlato Au i platinu Pt • Poprvé se objevuje ve spisech muslimského alchymisty Gebera v 8. století

Lučavka královská • Za druhé světové války během německé invaze do Dánska použil lučavku královskou nebývalým způsobem maďarský chemik George de Hevesy • Rozpustil v ní dvě zlaté medaile Nobelových cen pro Maxe von Laue a Jamese Francka, aby je nacisté neukradli • Roztok položil na polici ve své laboratoři v Institutu Nielse Bohra • Po válce se vrátil, našel roztok neporušený a vysrážel z něj zlato zpět. Nobelova společnost pak znovu odlila medaile z původního zlata