VY32INOVACECH 1 20 Elektrolza AUTOR Mgr Jana Krajinov
















- Slides: 21

VY_32_INOVACE_CH 1 – 20 Elektrolýza AUTOR: Mgr. Jana Krajinová VYTVOŘENO: listopad 2011 STRUČNÁ ANOTACE: Praktické činnosti z chemie pro 9. ročník. Téma: elektrolýza roztoku chloridu sodného Časová náročnost: 1 vyučovací hodina v součinnosti s elektronickou verzí učebnice FRAUS Chemie 9 Tento materiál byl vytvořen jako učební dokument projektu inovace výuky v rámci OP Vzdělávání pro konkurenceschopnost

Které látky jsou elektricky vodivé? 1)

Které látky jsou elektricky vodivé? 1) KOVY

Které látky jsou elektricky vodivé? 2)

Které látky jsou elektricky vodivé? 2) Některé nekovy GRAFIT neboli TUHA (C)

Které látky jsou elektricky vodivé? 3)

Které látky jsou elektricky vodivé? 3) ELEKTROLYTY = roztoky nebo taveniny pevných látek, které obsahují volně pohyblivé ionty

Co jsou ionty? IONTY jsou částice ( atomy ), které ………………….

Co jsou ionty? IONTY jsou částice ( atomy ), které nemají stejný počet protonů a elektronů

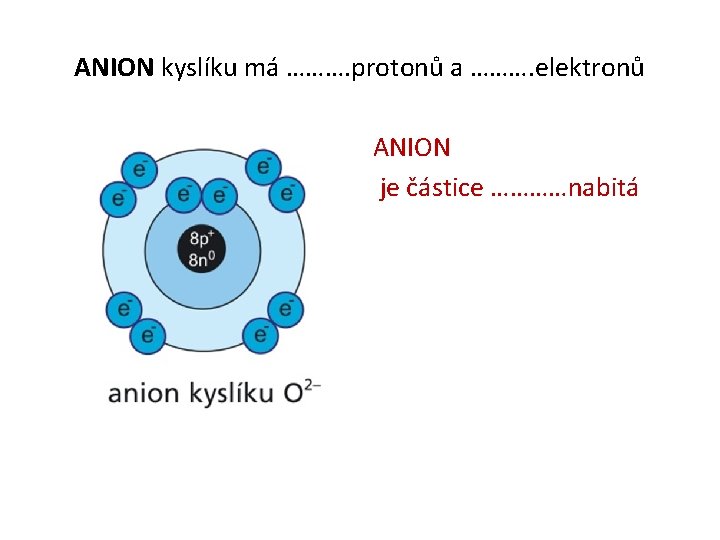
ANION kyslíku má ………. protonů a ………. elektronů ANION je částice …………nabitá

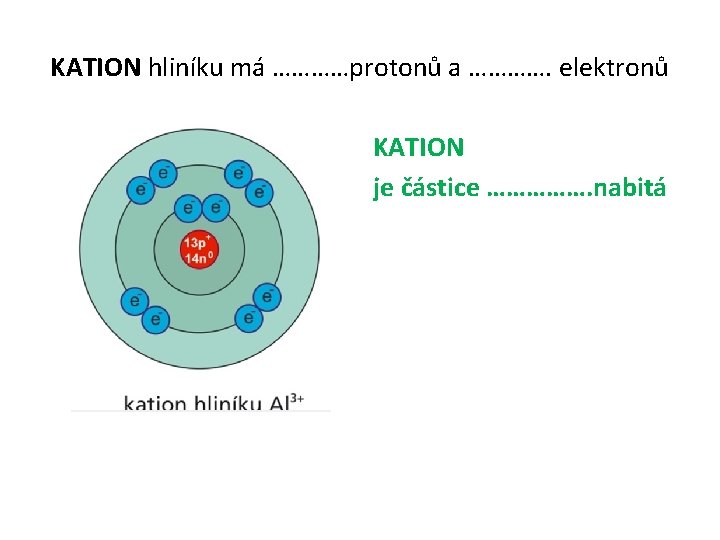
KATION hliníku má …………protonů a …………. elektronů KATION je částice ……………. nabitá

ELEKTROLÝZA zdroj stejnosměrného elektrického proudu Jak se chovají ionty při působení elektrického proudu?

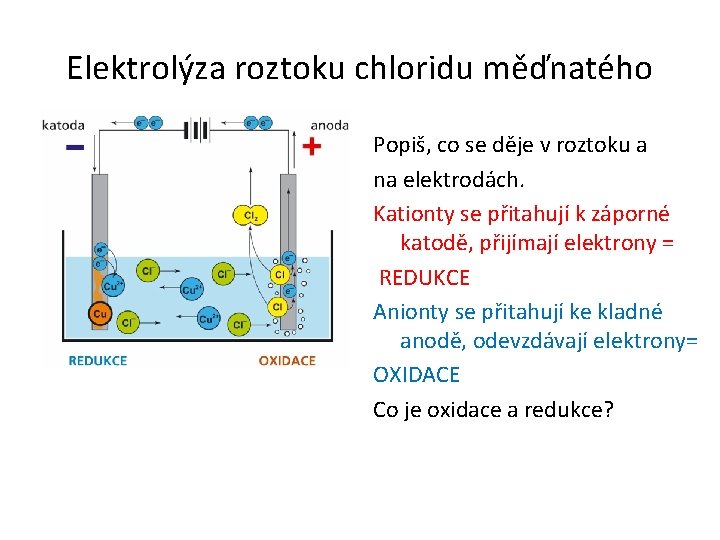
Elektrolýza roztoku chloridu měďnatého Co pozoruješ na elektrodách ?

Elektrolýza roztoku chloridu měďnatého Co pozoruješ na elektrodách ? vlevo je anoda vzniká zde plynný chlor vpravo je katoda vzniká na ní kovová měď ( na schématech je anoda a katoda obráceně než na tomto obr. )

Elektrolýza roztoku chloridu měďnatého Popiš, co se děje v roztoku a na elektrodách. Co je oxidace a redukce?

Elektrolýza roztoku chloridu měďnatého Popiš, co se děje v roztoku a na elektrodách. Kationty se přitahují k záporné katodě, přijímají elektrony = REDUKCE Anionty se přitahují ke kladné anodě, odevzdávají elektrony= OXIDACE Co je oxidace a redukce?

LABORATORNÍ PRÁCE ELEKTROLÝZA ROZTOKU CHLORIDU SODNÉHO

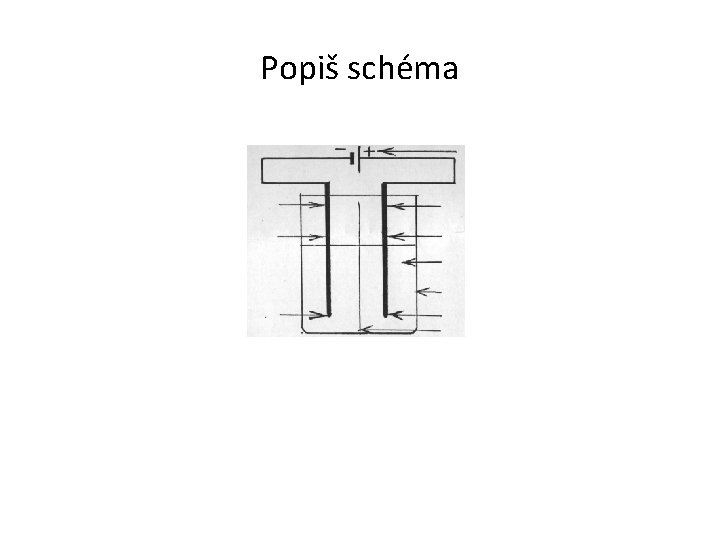
LABORATORNÍ PRÁCE ELEKTROLÝZA ROZTOKU CHLORIDU SODNÉHO 1) Kádinku naplň asi do dvou třetin nasyceným roztokem chloridu sodného a rozděl na dvě části přepážkou z přeloženého filtračního papíru. 2) Do jedné části roztoku vlož železnou elektrodu připojenou k zápornému pólu zdroje stejnosměrného elektrického napětí, do druhé části uhlíkovou elektrodu připojenou ke kladnému pólu. Pozoruj děje v prostoru obou elektrod. 3) Po pěti minutách vlož nad uhlíkovou elektrodu jodidoškrobový papírek ovlhčený vodou. Pozoruj jeho zbarvení. 4) Elektrolýzu ukonči. Elektrody vysuň a do roztoku, kde byla železná elektroda přidej čtyři kapky fenolftaleinu. 5) Popiš schéma, zapiš pozorování, výsledky a závěr.

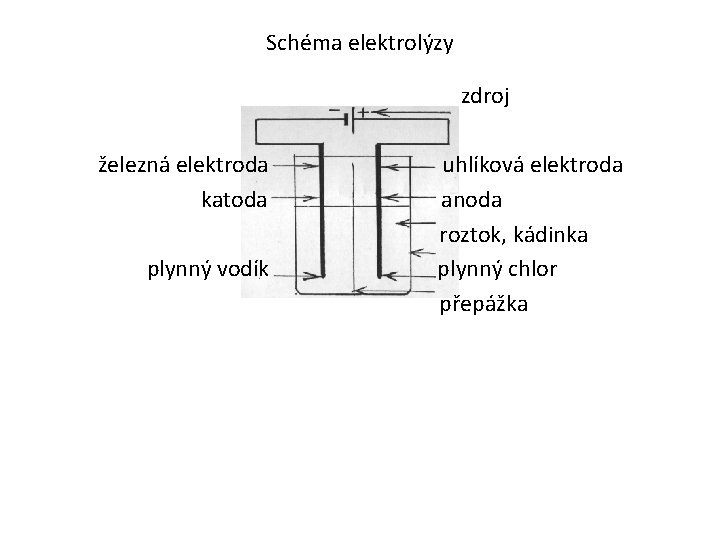
Schéma elektrolýzy zdroj železná elektroda katoda plynný vodík uhlíková elektroda anoda roztok, kádinka plynný chlor přepážka

Popiš schéma

Použité zdroje: • Učebnice Chemie 9 FRAUS
 Ejemplo de cita indirecta o parafrasis
Ejemplo de cita indirecta o parafrasis Citas en apa
Citas en apa Mgr. dalibor kott
Mgr. dalibor kott Mgr krpoun
Mgr krpoun Mgr. pavel pražák
Mgr. pavel pražák Druha punska vojna
Druha punska vojna Krizová intervence
Krizová intervence Ecuación fundamental de la contabilidad
Ecuación fundamental de la contabilidad Mgr
Mgr Mgr. pavol hrvol
Mgr. pavol hrvol Mgr jan kozák
Mgr jan kozák Mgr. veronika fuchsová
Mgr. veronika fuchsová Mgr z kropką czy bez
Mgr z kropką czy bez Petr beck
Petr beck Mgr. milan pilát
Mgr. milan pilát Mgr family tree
Mgr family tree Mgr. petra hovězáková
Mgr. petra hovězáková Mgr luc cyr
Mgr luc cyr Bc mgr ing
Bc mgr ing Jana žuravskaja
Jana žuravskaja Czas powstania ewangelii mateusza
Czas powstania ewangelii mateusza Jana discret
Jana discret