VY32INOVACE05 15 CHEMICK KINETIKA II Faktory ovlivujc reakn









- Slides: 10

VY_32_INOVACE_05 -15 CHEMICKÁ KINETIKA II Faktory ovlivňující reakční rychlost, teorie chemické kinetiky

TEORIE KINETIKY CHEMICKÝCH REAKCÍ teorie aktivovaného komplexu o o o přeměna molekul reaktantů v molekuly produktů se uskutečňuje přes aktivovaný komplex vznik aktivovaného komplexu umožňuje určit i hodnotu aktivační energie dané reakce aktivovaný komplex je stav po srážce dvou molekul reaktantů, kdy staré vazby v reaktantech jsou narušeny a nové vazby v produktech teprve vznikají

TEORIE KINETIKY CHEMICKÝCH REAKCÍ srážková teorie o vychází z kinetické teorie plynů, její platnost je omezena na reakce v plynné fázi o základní předpoklady: o nutnou podmínkou chemické reakce je srážka reagujících částic o k chemické přeměně vede pouze efektivní srážka = srážka, při které má reagující dvojice částic dostatečnou kinetickou energii

VLIV KATALYZÁTORU NA RYCHLOST REAKCE o katalyzátor je látka, která dočasně vytváří chem. vazbu s reaktanty - umožňuje tak přeměnu reaktantů v produkty o katalyzátor může zvyšovat nebo snižovat aktivační energii reaktantů – ovlivňuje tedy reakční rychlost o v průběhu chemické reakce se katalyzátor nespotřebovává, zapisujeme jej nad šipku v rovnici reakce

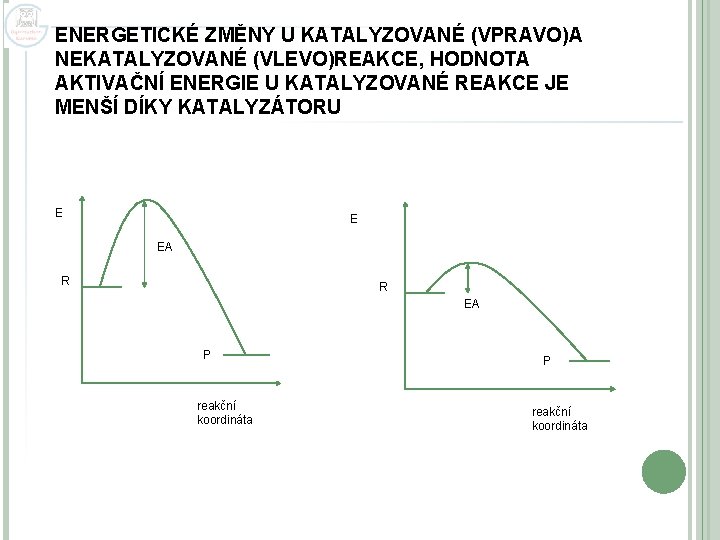
ENERGETICKÉ ZMĚNY U KATALYZOVANÉ (VPRAVO)A NEKATALYZOVANÉ (VLEVO)REAKCE, HODNOTA AKTIVAČNÍ ENERGIE U KATALYZOVANÉ REAKCE JE MENŠÍ DÍKY KATALYZÁTORU E E EA R R EA P reakční koordináta

a) pozitivní katalyzátory- oxid manganičitý, platina, roztok chloridu železitého, roztok chromanu draselného b) negativní katalyzátory (inhibitory)- močovina, těžké kovy - např. : olovo, dusitan sodný

o podle skupenství katalyzátoru máme katalýzu homogenní a katalýzu heterogenní o katalýza homogenní – katalyzátor je ve stejném skupenství jako reaktanty o katalýza heterogenní – katalyzátor je v odlišném skupenství než reaktanty

o autokatalýza – produkt reakce se stává katalyzátorem o enzymová katalýza molekula reaktantu (substrátu) se váže na aktivní centrum v makromolekule enzymu, vazba (klíč – zámek), po přeměně reaktantu v produkt se molekula produktu uvolňuje z aktivního centra o o např. : rozklad peroxidu vodíku účinkem peroxidázy z droždí

VLIV VELIKOSTI POVRCHU REAKTANTŮ NA REAKČNÍ RYCHLOST o platí, že čím větší povrch reaktantů tím je reakční rychlost vyšší o např. : hoření práškového železa a železných pilin

DĚKUJI ZA POZORNOST. Autor DUM: Mgr. Kateřina Kleslová