VY32INOVACE05 13 TERMOCHEMIE Reakn teplo endotermick a exotermick












- Slides: 13

VY_32_INOVACE_05 -13 TERMOCHEMIE Reakční teplo, endotermická a exotermická reakce, standardní reakční enthalpie a její výpočet, termochemické zákony

TERMOCHEMIE zabývá se chemickými reakcemi v jejichž průběhu se uvolňuje nebo spotřebovává teplo, které se uvolní nebo spotřebuje při průběhu chemické reakce, se nazývá reakční teplo Qr, k. J/1 mol pokud se reakční teplo uvolní do okolí, jedná se o reakci exotermickou, pokud se při reakci teplo spotřebuje, jedná se o endotermickou reakci příklady:

ZMĚNA ENTHALPIE PŘI EXOTERMICKÉ REAKCI, H 0 H reaktanty, H 1 energie se uvolňuje produkty, H 2

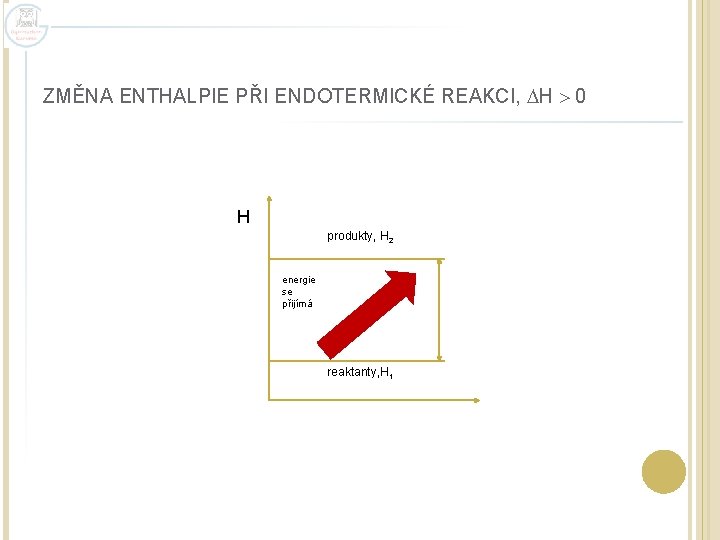
ZMĚNA ENTHALPIE PŘI ENDOTERMICKÉ REAKCI, H 0 H produkty, H 2 energie se přijímá reaktanty, H 1

probíhá-li reakce za konstantního tlaku nahrazujeme reakční teplo reakční enthalpií Hr, k. J/mol hodnota reakčního tepla/ enthalpie závisí na podmínkách, za kterých reakce probíhá

reakční enthalpie reakce, která probíhá za standardních podmínek se nazývá standardní reakční enthalpie H˚r teplota: t = 25 ˚C (T = 298 K) tlak: 101 325 Pa

pro výpočet standardní reakční enthalpie určité chemické reakce lze použít tabulkové hodnoty: a) standardní slučovací enthalpie H ˚sluč je to standardní reakční enthalpie reakce, při které vzniká 1 molekul látky přímo z prvků, standardní slučovací enthalpie prvků jsou nulové př. :

b) standardní spalná enthalpie H ˚spal je to standardní reakční enthalpie reakce, při které se spálí 1 molekul látek za vzniku vody a oxidu uhličitého př. :

vztahy pro výpočet standardní reakční enthalpie reakce: H˚r = ( H ˚sluč) PRODUKTŮ - ( H ˚sluč) REAKTANTŮ H˚r = ( H ˚spal) REAKTANTŮ - ( H ˚spal) PRODUKTŮ hodnota standardní reakční enthalpie reakce závisí na látkovém množství reaktantů, proto jsou vztahována na 1 mol reaktantu

výpočet standardní reakční enthalpie ze standardních slučovacích enthalpií látek výpočet standardní reakční enthalpie ze standardních spalných enthalpií látek výpočet standardní reakční enthalpie z termochemických rovnic (známe standardní reakční enthalpie reakcí zapsaných termochemickými rovnicemi)

HESSŮV ZÁKON standardní reakční enthalpie reakce nezávisí na průběhu reakce, závisí pouze na počátečním a konečném stavu A + B AB H 1 AB + B AB 2 H 2 A + 2 B AB 2 H 3 = H 1 + H 2

LAPLACEŮV, LAVOISIERŮV ZÁKON – DŮSLEDEK HESSOVA ZÁKONA K rozložení sloučeniny na prvky je nutno dodat stejné množství reakční enthalpie, jaké by se uvolnilo při jejím vzniku z chemických prvků.

DĚKUJI ZA POZORNOST. Autor DUM: Mgr. Kateřina Kleslová