VOLUTION DU MODLE ATOMIQUE MODLES ATOMIQUES u Toutes























- Slides: 26

ÉVOLUTION DU MODÈLE ATOMIQUE

MODÈLES ATOMIQUES u « Toutes les expériences du monde ne pourront jamais prouver que j’ai raison; pourtant, une seule peut suffire à prouver que j’ai tort. »

LA MATIÈRE AVANT JÉSUS-CHRIST DÉMOCRITE ARISTOTE

L’évolution du modèle atomique u Démocrite 460 -370 av. J-C, a dit … La matière est formée de petites particules indivisibles appelées atomes.

u Aristote 384 -322 av. J-C. u Les grec ont dit… La matière est continue, pas de vide, pas d’atomes La matière est formée de 4 éléments: L’aire La terre Le feu L’eau

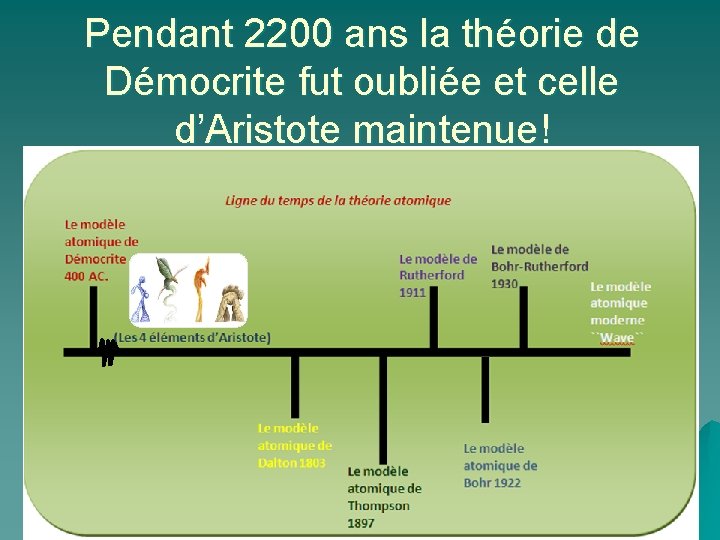
Pendant 2200 ans la théorie de Démocrite fut oubliée et celle d’Aristote maintenue!

Mais qu’est-ce qu’ils ont fait de leur vie? ? ? Boff…. . Pas grand chose! – Les alchimistes n’ont pas vraiment de théorie – Ils expérimentent

LA MATIÈRE APRÈS JÉSUS-CHRIST NEWTON-BOYLE DALTON THOMSON RUTHERFORD BOHR SCHRÖDINGERPLANCKHEISENBERG

MODÈLES ATOMIQUES 1. Modèle d’après Dalton (1766 -1844) – Dalton proposa la théorie suivante : “la matière est constituée d’atomes indivisibles et indestructibles, et un atome d’un élément donné a toujours la même masse. ”

Dalton (1766 -1844) Corps simples formés d’atomes identiques u Corps composés formés d’atomes différents u Les atomes peuvent se combiner pour former des corps composés u L’atome revient u – Dalton met de l’ordre dans les éléments connus. – Il est le premier à proposer une classification basée sur la masse atomique.

MODÈLES ATOMIQUES 2. Modèle d’après Thomson u L’expérience de 1895 (tube cathodique) – But : déterminer le rapport e/m de l’électron.

J. J. Thomson (1856 -1940) u L’électricité existe – Il découvre l’électron L’atome est donc divisible u Modèle du pain aux raisins u On dirait… du Pain au raisins!

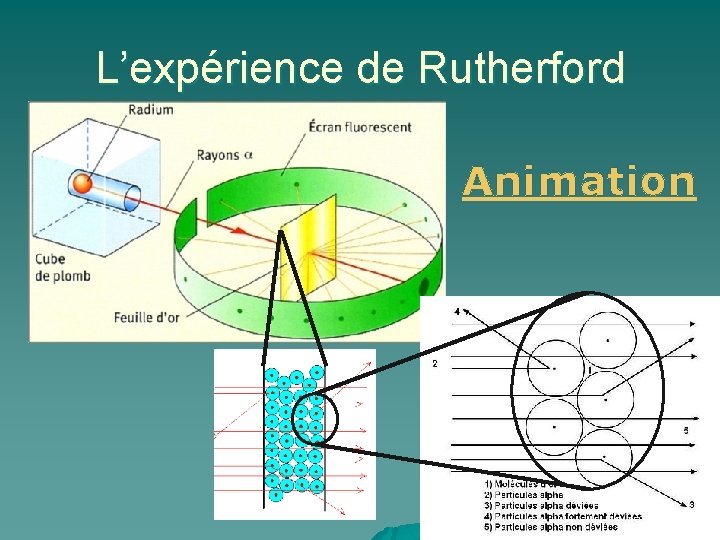
MODÈLES ATOMIQUES u u 3. Modèle d’après Rutherford (1871 -1937) En 1911, Ernest Rutherford effectua des expériences qui consistaient à bombarder une feuille métallique avec un faisceau de particules alpha et à observer la direction prise par les particules qui avaient rebondi sur les atomes rencontrés (Université Mc. Gill, Montréal). Il voulait ainsi vérifier le modèle atomique proposé par Thomson (modèle plein).

L’expérience de Rutherford Animation

Ernest Rutherford (1871 -1937) u Plusieurs découvertes – Photographies – Électricité – Radioactivité u Modèle planétaire

Le modèle de Rutherford • L’atome est composé en majeure partie de vide • La masse de l’atome est concentrée dans le noyau • Les particules de charge positive sont appelées protons et composent le noyau • Les électrons de masse négligeable et orbitent autour du noyau un peu comme des planètes autour du soleil • Leur charge électrique est égale à celle des protons, mais de signe contraire (négatif), ce qui fait que l’atome est globalement neutre 16

Niels Bohr (1885 -1962) Modèle de Bohr u Niveaux d’énergie u – Les électrons sont sur des couches définies Niveau 1 (s) Niveau 2 (p) Niveau 3 (d)

Le modèle de Bohr u Se base sur l’idée de Rutherford u Mais met l’accent sur les électrons – Les électrons ont des niveaux d’énergie précis (n = 1, 2, 3 et 4) – Ils se déplacent à une vitesse constante autour du noyau comme les planètes autour du soleil. – Ils ne changent pas de niveau sans avoir la quantité d’énergie nécessaire.

James Chadwick (1891 -1974) u Neutrons dans le noyau – Ciment nucléaire u Modèle actuel simplifié – Noyau u Protons et neutrons – Couches électroniques

Le modèle de Bohr. Rutherford

Le modèle de Bohr. Rutherford

Aujourd’hui le modèle se perfectionne u Les outils modernes

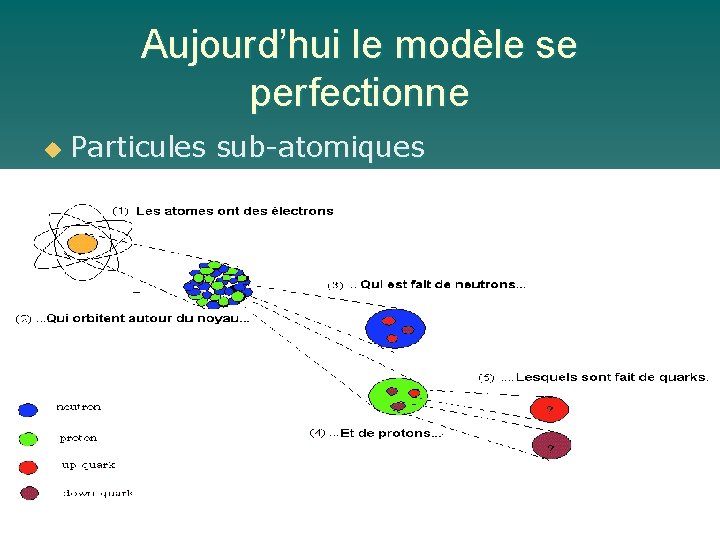
Aujourd’hui le modèle se perfectionne u Particules sub-atomiques

Le modèle de Schrödinger, Heisenberg et Planck u Modèle Quantique L’électron à des propriétés ondulatoires La position de l’électron n’est qu’une probabilité

Le modèle ¨Quantique¨ Mais ça, c’est une toute autre histoire!!!

En résumé JC 5 e 4 e Newton Boyle u u 17 e Dalton Thompson 19 e Rutherford 20 e Bohr S, H et P L’atome est formé d’un noyau très petit Ce noyau est constitué de protons(+) et de neutrons Des électrons(-) tournent autour du noyau sur des couches bien définies La masse de l’atome est concentrée dans le noyau (protons et neutrons) Les électrons sont distribués sur les couches selon des règles précises