VOLUTION DU MODLE ATOMIQUE Dalton 1766 1844 Les








- Slides: 9

ÉVOLUTION DU MODÈLE ATOMIQUE

Dalton (1766 -1844) Les atomes peuvent se combiner pour former des corps composés u L’atome revient u – Dalton met de l’ordre dans les éléments connus. – Il est le premier à proposer une classification basée sur la masse atomique.

J. J. Thomson (1856 -1940) u L’électricité existe – Il découvre l’électron u u L’atome est donc divisible Modèle du pain aux raisins On dirait… du Pain au raisins!

Ernest Rutherford (1871 -1937) u Plusieurs découvertes – Photographies – Électricité – Radioactivité u Modèle planétaire

Le modèle de Rutherford • La masse de l’atome est concentrée dans le noyau • Les particules de charge positive sont appelées protons et composent le noyau • Les électrons de masse négligeable et orbitent autour du noyau un peu comme des planètes autour du soleil. 5

Niels Bohr (1885 -1962) Modèle de Bohr u Niveaux d’énergie u – Les électrons sont sur des couches définies Niveau 1 (s) Niveau 2 (p) Niveau 3 (d)

Le modèle de Bohr u Se base sur l’idée de Rutherford u Mais met l’accent sur les électrons – Les électrons ont des niveaux d’énergie précis (n = 1, 2, 3 et 4) – Ils se déplacent à une vitesse constante autour du noyau comme les planètes autour du soleil. – Ils ne changent pas de niveau sans avoir la quantité d’énergie nécessaire.

Le modèle de Bohr. Rutherford

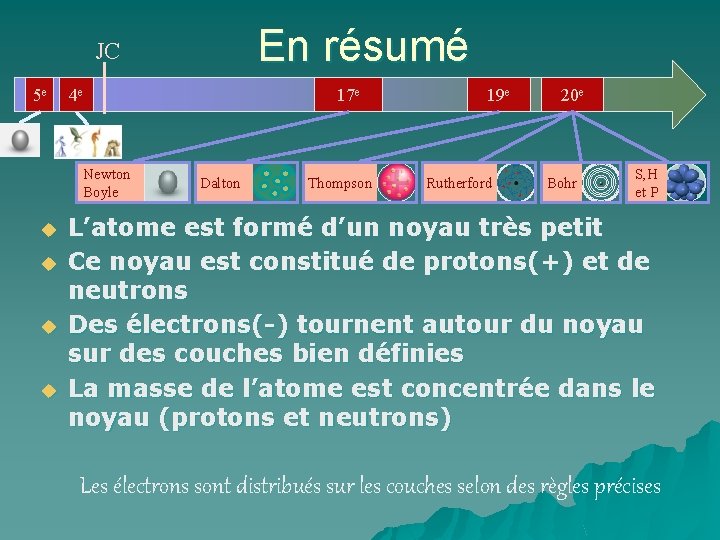
En résumé JC 5 e 4 e Newton Boyle u u 17 e Dalton Thompson 19 e Rutherford 20 e Bohr S, H et P L’atome est formé d’un noyau très petit Ce noyau est constitué de protons(+) et de neutrons Des électrons(-) tournent autour du noyau sur des couches bien définies La masse de l’atome est concentrée dans le noyau (protons et neutrons) Les électrons sont distribués sur les couches selon des règles précises