Vodn roztoky Neutralizcia Opakovanie uiva 8 ronka Vodn







- Slides: 12

Vodné roztoky Neutralizácia Opakovanie učiva 8. ročníka

Vodné roztoky Všetky deje v živých organizmoch sa dejú vo vodných roztokoch Vodné roztoky – rozpúšťadlom je voda

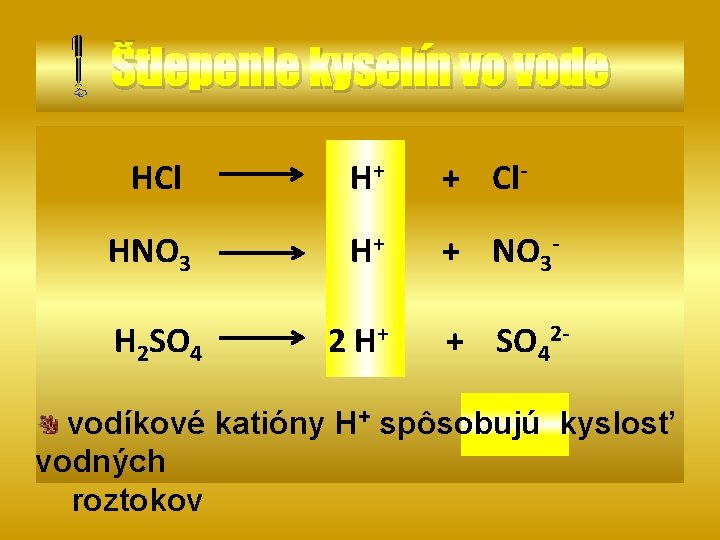
Štiepenie kyselín vo vode HCl H+ + Cl- HNO 3 H+ + NO 3 - H 2 SO 4 2 H+ + SO 42 - vodíkové katióny H+ spôsobujú kyslosť vodných roztokov

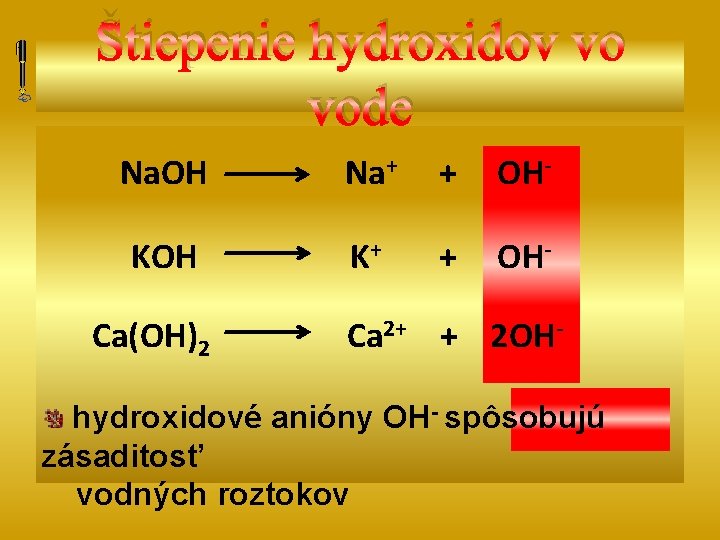
Štiepenie hydroxidov vo vode Na. OH Na+ + OH- KOH K+ + OH- Ca(OH)2 Ca 2+ + 2 OH- hydroxidové anióny OH- spôsobujú zásaditosť vodných roztokov

Indikátory chemické látky, ktoré v kyslom alebo zásaditom prostredí menia svoju farbu ( lakmus, fenolftaleín, červená kapusta) kvety hortenzie menia farbu zo svetloružovej na svetlomodrú podľa toho, či rastú v zásaditej alebo kyslej pôde

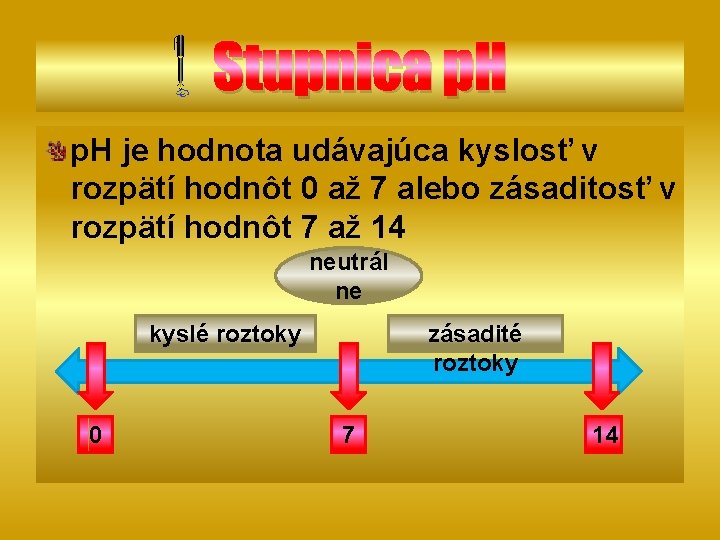
Stupnica p. H je hodnota udávajúca kyslosť v rozpätí hodnôt 0 až 7 alebo zásaditosť v rozpätí hodnôt 7 až 14 neutrál ne kyslé roztoky 0 zásadité roztoky 7 14

Úloha 1: Meraním sa zistilo p. H niektorých roztokov. Určte, ktoré sú kyslé a ktoré zásadité? 3, 1 8, 2 6, 5 Ocot 2, 8 4, 5 7, 2

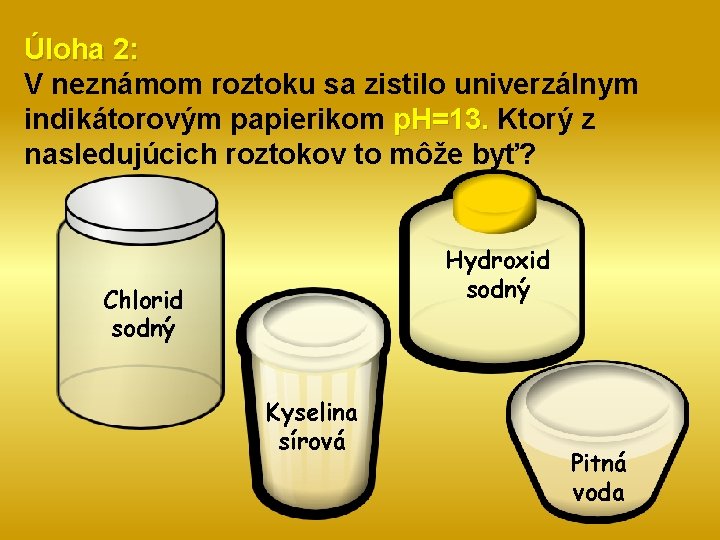
Úloha 2: V neznámom roztoku sa zistilo univerzálnym indikátorovým papierikom p. H=13. Ktorý z nasledujúcich roztokov to môže byť? Hydroxid sodný Chlorid sodný Kyselina sírová Pitná voda

Neutralizácia je vzájomná reakcia katiónov H+ s aniónmi OH-, pričom vznikajú molekuly H 2 O a soľ príslušnej kyseliny kyselina + hydroxid teplo soľ + voda + Všeobecná rovnica: H+ + OH- H 2 O + teplo

Praktické použitie neutralizácie na odstraňovanie kyselín alebo hydroxidov z odpadových vôd na presné určenie množstva kyselín alebo hydroxidov v rozličných látkach, napr. v mlieku a mliečnych výrobkoch,

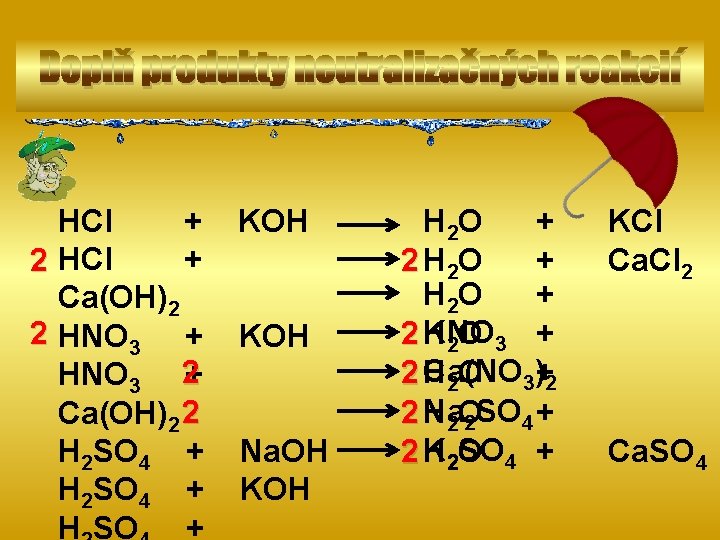
Doplň produkty neutralizačných reakcií HCl + + 2 HCl Ca(OH)2 2 HNO 3 + HNO 3 2+ Ca(OH)2 2 H 2 SO 4 + H SO + KOH Na. OH KOH H 2 O + 2 H 2 O + KNO 2 H 2 O 3 + Ca(NO 2 H 3)+2 2 O Na 2 H 2 SO 4 + 2 O K 2 O SO 4 + 2 H KCl Ca. Cl 2 Ca. SO 4

Ďakujem za pozornosť ! Mgr. Mariana Pavelčáková © 2010