Voda VY32 INOVACECHE120 AUTOR Ing Ladislava Semerdov ANOTACE











- Slides: 13

Voda VY-32 -INOVACE-CHE-120 AUTOR: Ing. Ladislava Semerádová ANOTACE: Výukový materiál je určen pro studenty 1. ročníku SŠ. Může být použit při výkladu vlastností vody. KLÍČOVÁ SLOVA: struktura molekuly vody, vodíkové můstky, struktura ledu, anomálie vody

Voda H 2 O

Výskyt vody • • • Na zemském povrchu 1 miliarda tun 99 % vody je soustředěno v oceánech 0, 7 % podzemní voda 0, 2 % řeky a jezera 0, 001 % je v atmosféře Voda tvoří 2/3 hmotnosti lidského těla a je základním transportním médiem

Struktura molekuly vody • Rozdíl elektronegativit kyslíku a vodíku je větší než 0, 7 = vazba je silně polární • V blízkosti atomu kyslíku je přebytek elektronů – tvoří se záporný pól δ • V olasti vodíku je nedostatek elektronů- tvoří se zde kladný pól δ+

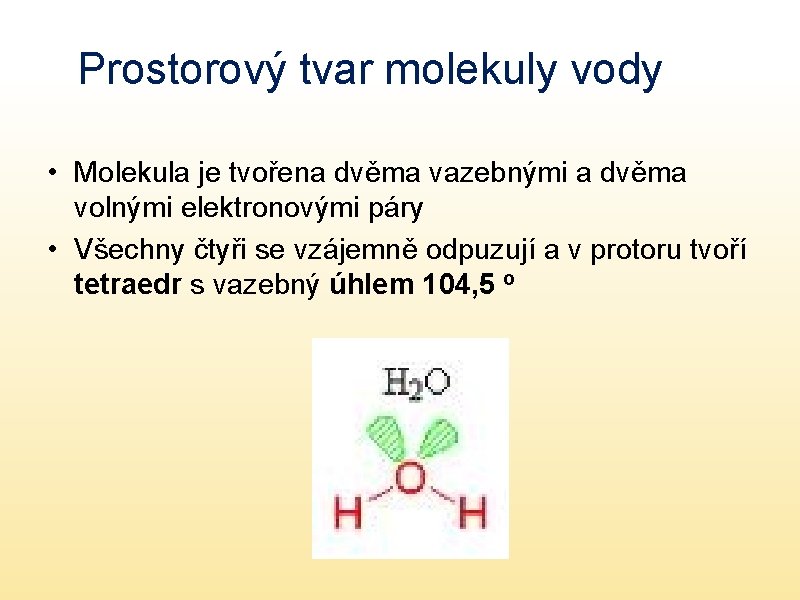
Prostorový tvar molekuly vody • Molekula je tvořena dvěma vazebnými a dvěma volnými elektronovými páry • Všechny čtyři se vzájemně odpuzují a v protoru tvoří tetraedr s vazebný úhlem 104, 5 o

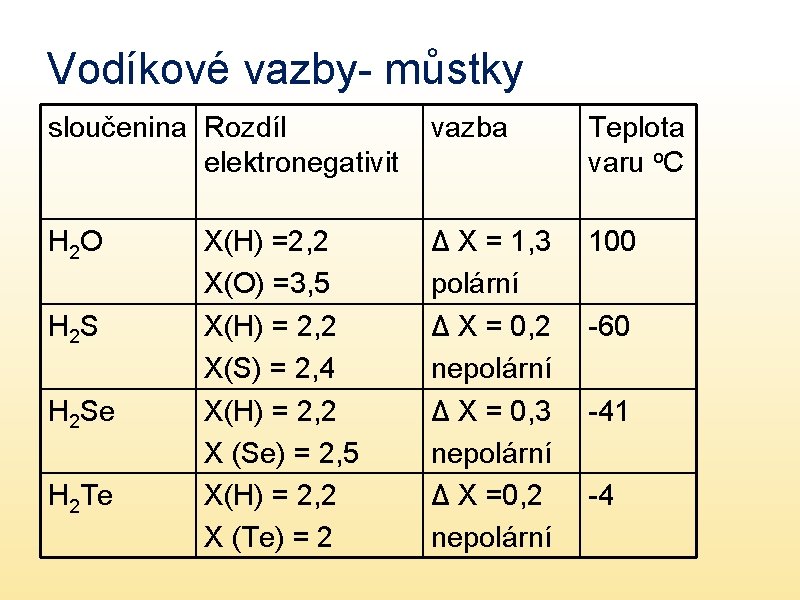
Vodíkové vazby- můstky sloučenina Rozdíl elektronegativit vazba Teplota varu o. C H 2 O Δ X = 1, 3 polární Δ X = 0, 2 nepolární Δ X = 0, 3 nepolární Δ X =0, 2 nepolární 100 H 2 Se H 2 Te X(H) =2, 2 X(O) =3, 5 X(H) = 2, 2 X(S) = 2, 4 X(H) = 2, 2 X (Se) = 2, 5 X(H) = 2, 2 X (Te) = 2 -60 -41 -4

• Voda se velmi liší od látek s podobnou strukturou • Příčina: • Molekuly tvoří dipóly mezi kterými působí síly, které nazýváme vodíkové vazby (můstky) • Nejedná se o chemickou vazbu pouze o interakci – nevzniká nová sloučenina, ale mění se vlastnosti dané látky oproti očekávání

Vazby v kapalné a pevné vodě • A) kovalentní polární vazba uvnitř molekuly mezi H a. O • B) vodíkové vazby mezi molekulami H 2 O

Změna struktury při tání a tuhnutí ledu • Vodíkové vazby můžeme nalézt i v ledu, kde se každá molekula vody pravidelně váže s dalšími čtyřmi molekulami vodíkovými vazbami • vytvářejí se ohromné struktury se šestičlennými kruhy s prázdnými dutinami, které jsou podobné včelí plástvi. •

• Při tuhnutí vzrůstá výsledný objem hustota naopak klesá • Hustota vody je větší než ledu • Hustota kapalné vody při Oo. C = 0, 999 g/cm 3 • Hustota ledu při Oo. C = 0, 917 g/cm 3

Tání ledu • Při tání se část vodíkových můstků rozpadá a uvolněné molekuly zaplňují volné prostory v původní struktuře • Dochází ke zmenšení objemu a růstu hustoty • Maximální hustoty dosáhne voda při 4 OC kdy je 1 g/ cm 3 • Rozdíl hustot mezi 0 o. C a 4 OC umožňuje život přežít rybám zimu v rybnících

• Při teplotě na 4 o. C začne s teplotou hustota vody klesat jako u ostatních látek • Chování vody v rozmezí 0 o. C až 4 o. C se nazývá anomálie vody

POUŽITÉ ZDROJE: DUŠEK, Bohuslav a Vratislav FLEMR. Obecná a anorganická chemie pro gymnázia. SPN, 2007. ISBN 80 -7235 -369 -1. Klouda P. Obecná a anorganická chemie. třetí. Ostrava: Pavel Klouda, Ostrava, 2004. ISBN 8086369 -10 -2. www. glassschool. cz

























