Vizes oldatok kmhatsa A vizes oldatok fontos jellemzjk










- Slides: 20

Vizes oldatok kémhatása

A vizes oldatok fontos jellemzőjük a kémhatás (tapasztalati úton régtől fogva ismert tulajdonság) A kémhatás lehet: Savas, lúgos, vagy semleges Savas kémhatású oldatok: vízben oldott savat tartalmaznak. (Honnan az elnevezés? ) Pl. ecetsav, citromsav, sósav (hidrogén-klorid vizes oldata), foszforsav, hangyasav (szúnyog, csalán, méh, hangya)

Lúgos kémhatású oldatok: ammónia vizes oldata (szalmiákszesz), nátrium-hidroxid (lúgkő, marónátron), mosó- és mosogatószerek, mosószóda, szappan- jó zsíroldók. Szódabikarbóna –gyomorsav megkötő Semleges kémhatású: víz, cukoroldat, sóoldat

Hogyan tudjuk őket megkülönböztetni? Kimutatásuk indikátorokkal. Indikátorok: növényi eredetű anyagok, amik savas, vagy lúgos oldatban színüket megváltoztatják. Pl. tea, lilahagyma, vöröskáposzta, cékla fenolftalein, lakmusz, univerzális indikátor, antociánt tartalmazó színes virágok. Citromsav+ tea

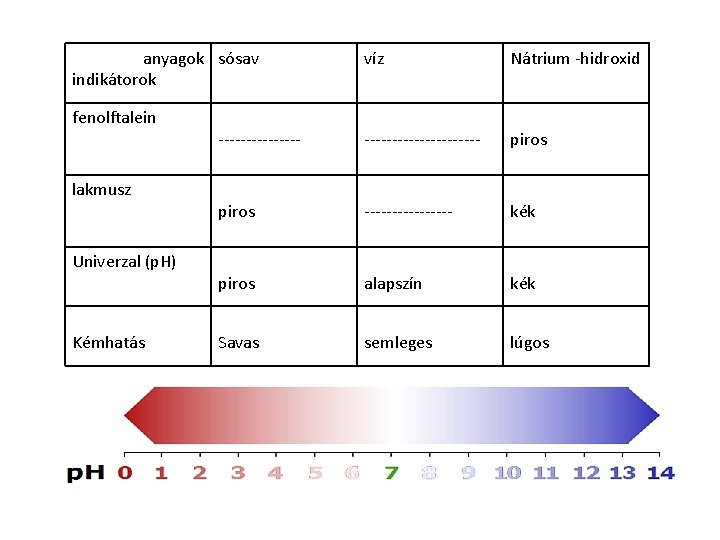
Kísérlet: Vizsgáljuk meg a sósav, a víz, és a nátriumhidroxid kémhatását! Tapasztalat: anyagok sósav indikátorok fenolftalein lakmusz univerzal kémhatás víz Nátrium -hidroxid

anyagok sósav indikátorok fenolftalein lakmusz Univerzal (p. H) Kémhatás víz Nátrium -hidroxid --------------------- piros -------- kék piros alapszín kék Savas semleges lúgos

p. H érték, a savasság és lúgosság mértéke 0 erősen savas, 7 -es semleges, 14 erősen lúgos kémhatást jelent. Megalkotója: Søren Peter Lauritz Sørensen (1868 -1939) dán biokémikus


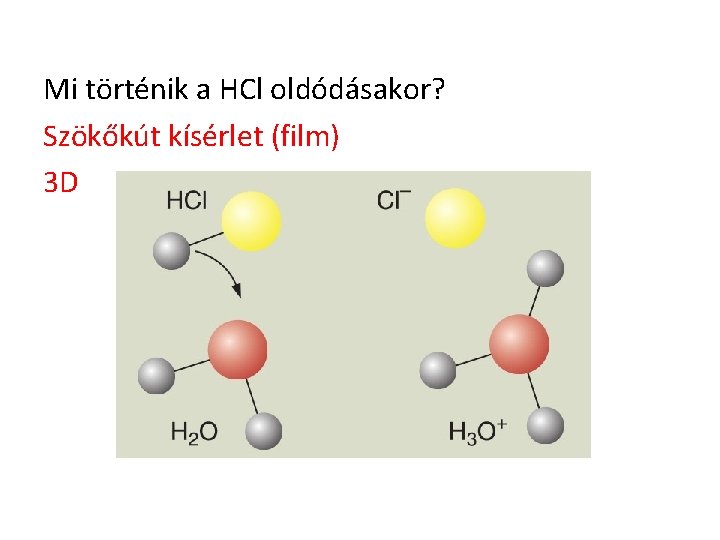
Mi történik a HCl oldódásakor? Szökőkút kísérlet (film) 3 D

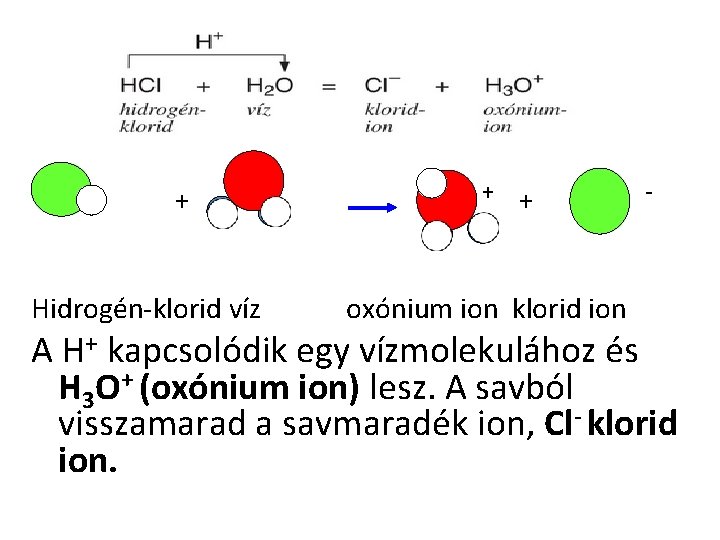
+ Hidrogén-klorid víz + + oxónium ion klorid ion - A H+ kapcsolódik egy vízmolekulához és H 3 O+ (oxónium ion) lesz. A savból visszamarad a savmaradék ion, Cl- klorid ion.

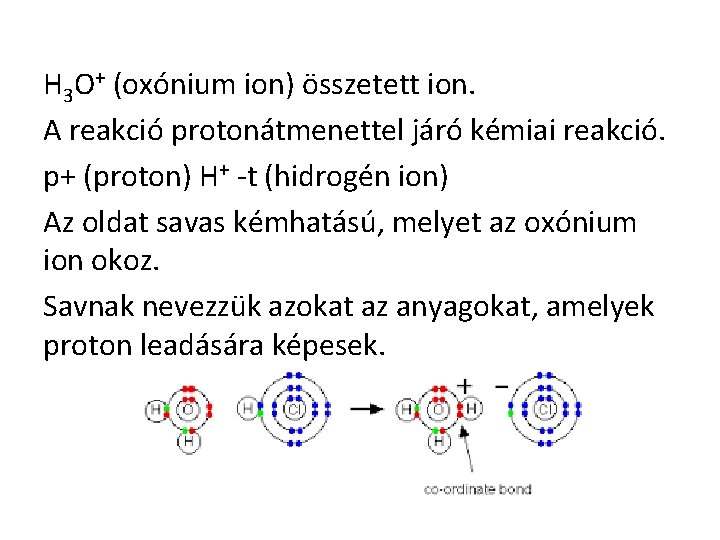
H 3 O+ (oxónium ion) összetett ion. A reakció protonátmenettel járó kémiai reakció. p+ (proton) H+ -t (hidrogén ion) Az oldat savas kémhatású, melyet az oxónium ion okoz. Savnak nevezzük azokat az anyagokat, amelyek proton leadására képesek.

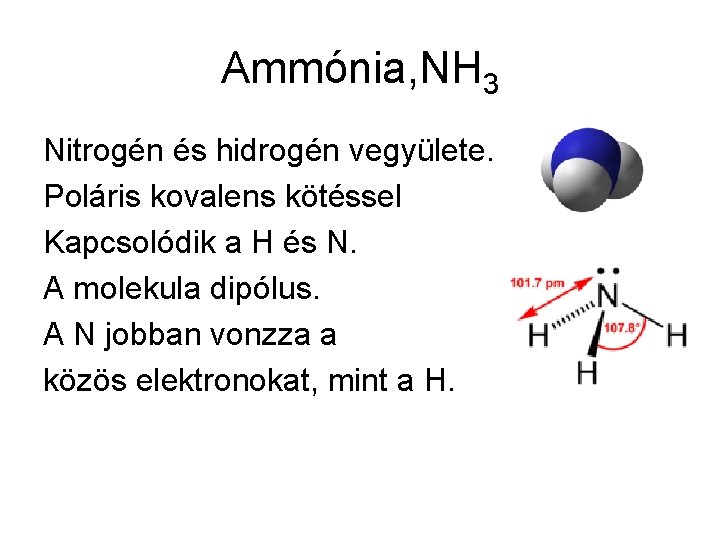
Ammónia, NH 3 Nitrogén és hidrogén vegyülete. Poláris kovalens kötéssel Kapcsolódik a H és N. A molekula dipólus. A N jobban vonzza a közös elektronokat, mint a H.

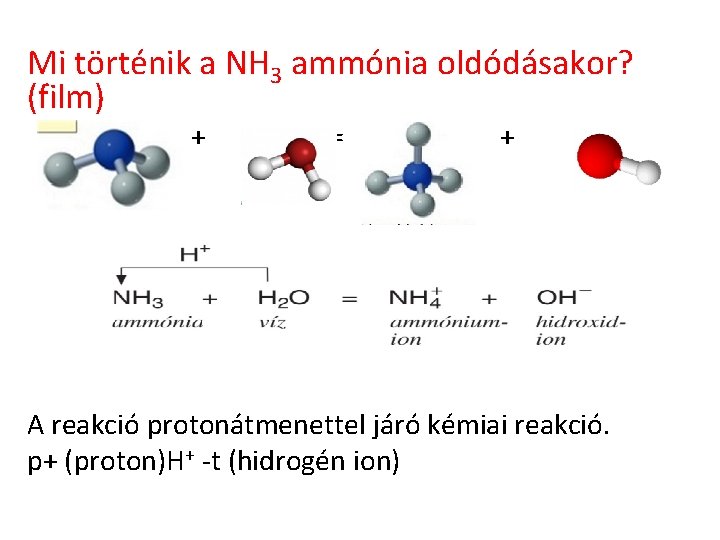
Mi történik a NH 3 ammónia oldódásakor? (film) + = + A reakció protonátmenettel járó kémiai reakció. p+ (proton)H+ -t (hidrogén ion)

Az ammónium ion és a hidroxid ion is összetett ion. Az ammónia vizes oldata az NH 4 OH ammónium hidroxid. Az ammónium-hidroxid csak oldatban létezik. Ionokból áll: NH 4+ OHammónium ion hidroxid ion Lúgos kémhatású oldatokban hidroxid ion van. Bázisnak nevezzük azokat az anyagokat, amelyek vizes oldatban protont képesek felvenni. NH 3 + H+ NH 4+

Sav, vagy bázis a víz, ezek alapján? Egyik anyag mindig sav, a másik bázis Sav-bázis reakciók A víz amfoter= kettős jellemű, hol sav, hol bázis.

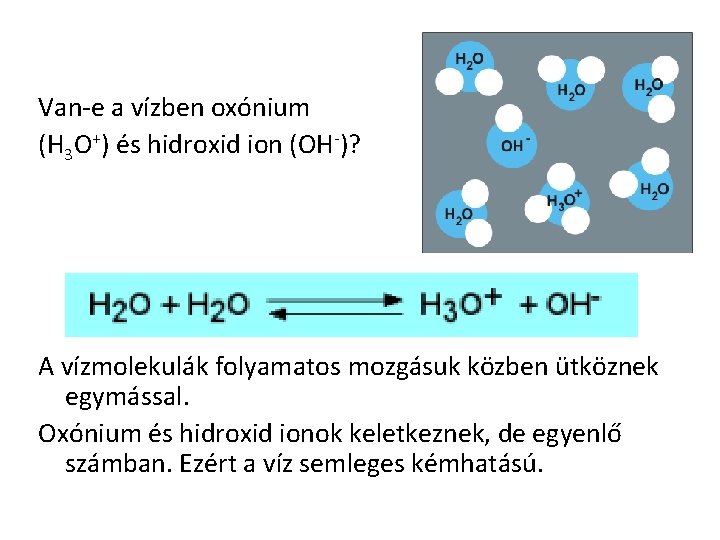
Van-e a vízben oxónium (H 3 O+) és hidroxid ion (OH-)? A vízmolekulák folyamatos mozgásuk közben ütköznek egymással. Oxónium és hidroxid ionok keletkeznek, de egyenlő számban. Ezért a víz semleges kémhatású.

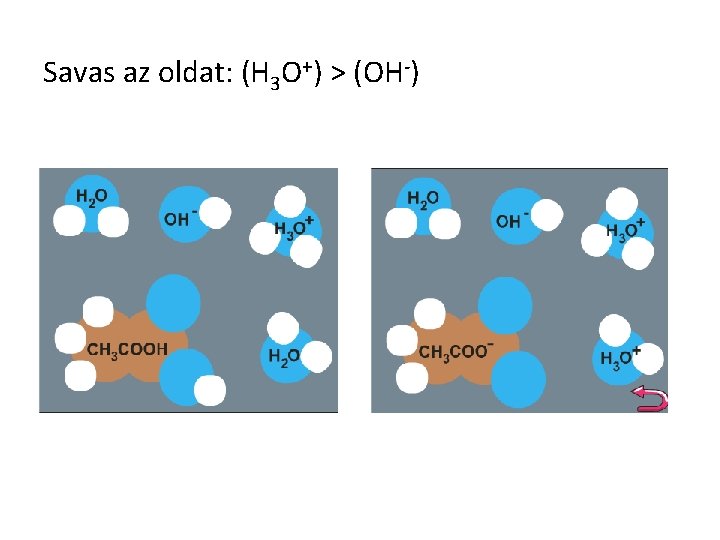
Savas az oldat: (H 3 O+) > (OH-)

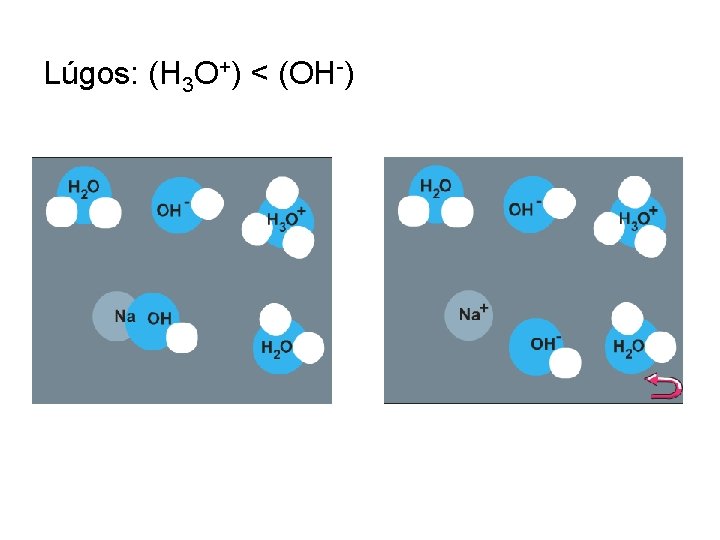
Lúgos: (H 3 O+) < (OH-)

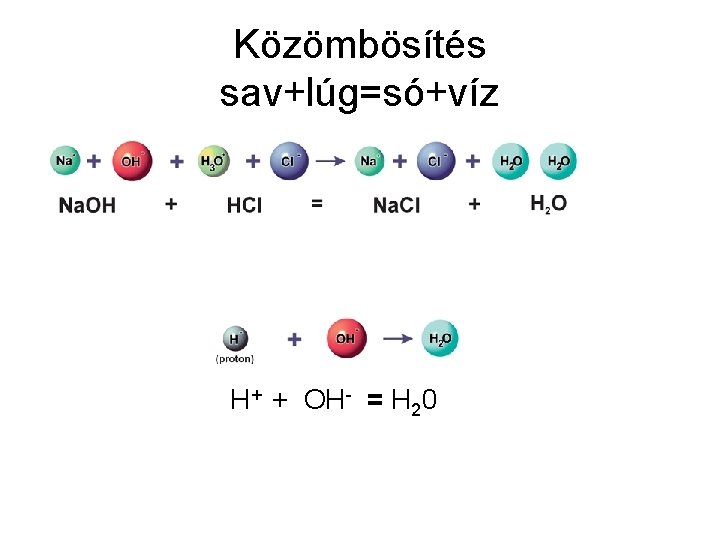
Közömbösítés sav+lúg=só+víz H+ + OH- = H 20

Összefoglalva: Savnak nevezzük azt az anyagot, ami proton leadásra képes, vizes oldata savas kémhatású. Bázisnak nevezzük azt az anyagot, ami proton felvételre képes, vizes oldata lúgos kémhatású. Amfoter = kettős jellemű azaz anyag, ami partnertől függően savként, vagy bázisként viselkedik, kémhatása semleges. A protonátmenettel járó kémiai reakciókat savbázis reakciónak is nevezzük.