Vitrotechniques Principales techniques et applications Vitrotechniques Plan l





























































- Slides: 81

Vitrotechniques Principales techniques et applications

Vitrotechniques Plan l Assainissement variétal – l Propagation de génotypes – – – l Micropropagation Embryogenèse somatique Le problème de la variation somaclonale Sélection /Amélioration variétale – – l Culture de méristèmes Création de variabilité Sauvetage d’embryons Haplo/diploïdisation Préparation et fusion de protoplastes Conservation génétique – Cryoconservation

Culture de méristèmes Assainissement de lignées

Sauvetage d’embryons Obtention de lignées saines l l Principe : les méristèmes sont indemnes de virus (travaux de P. Limasset) Culture de méristèmes – l Quelques 1/10 mm Régénération de plantes saines Attention : les lignées sont toujours sensibles à des infections ultérieures !!!

Sauvetage d’embryons Applications l Espèces à reproduction végétative – pomme de terre, bananier, artichaut, fraisier… Premiers succès dans les années 50 Service proposé par la plupart des sociétés de biotechnologies végétales – Normes sanitaires internationales

Micropropagation

Micropropagation l l Apex de tige ou bourgeons latéraux, Procédure en trois étapes (Murashige, 1974) – – – l I : établissement du tissu en conditions d’asepsie II: multiplication de tiges feuillées III: formation de racines et conditionnement de propagules avant transfert en serres Clonage très fidèle et très efficace – 200 000 rosiers à partir d’un bourgeon

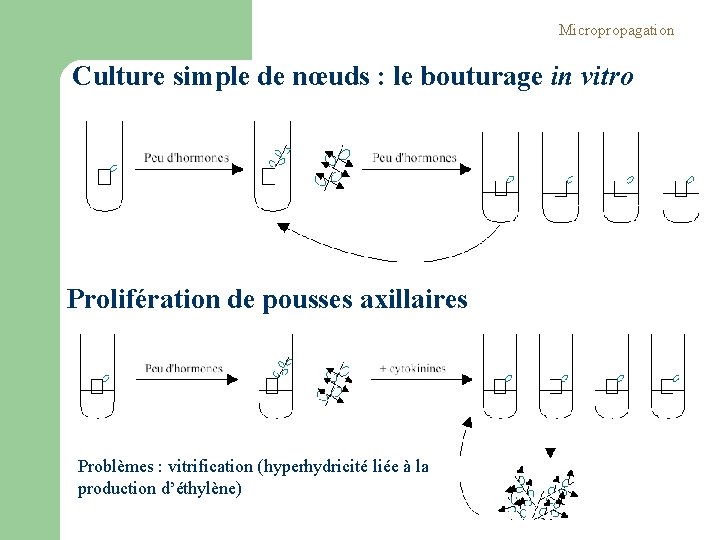
Micropropagation Culture simple de nœuds : le bouturage in vitro Prolifération de pousses axillaires Problèmes : vitrification (hyperhydricité liée à la production d’éthylène)

Exemple de la pomme de terre : applications industrielles depuis près de 20 ans

Micropropagation Applications l Horticulture, Sylviculture, Agronomie l Les « grands succès » économiques – – – l Banane Orchidées Pomme de Terre Conservation de la biodiversité – – plantes carnivores Orchidées

Micropropagation L’industrie de la micropropagation l l l Gain de place Affranchissement des saisons Rapidité Qualité sanitaire et homogénéité Pour certaines espèces : pas d’autres solutions

Micropropagation Millions de plants par an issus de la micropropagation 1980 1988 2001 Pays-Bas 7, 4 61, 5 France 2, 7 40, 5 Belgique 50 Facteur limitant : main d’œuvre Délocalisations

Micropropagation Exemples de PME réalisant de la micropropagation Vivai Battisitini (Italie) 20 hottes à flux laminaire 60 000 m 2 de serres 3 chambres de culture 4 000 plants vendus chaque année Multiplication Technivit (Bourges) Assainissement Création variétale

Micropropagation Bioplant (Belgique) Propagation technology (UK)

Embryogenèse somatique

Embryogenèse somatique l Génération d’un embryon à partir d’un méristème, d’un cal ou de suspensions

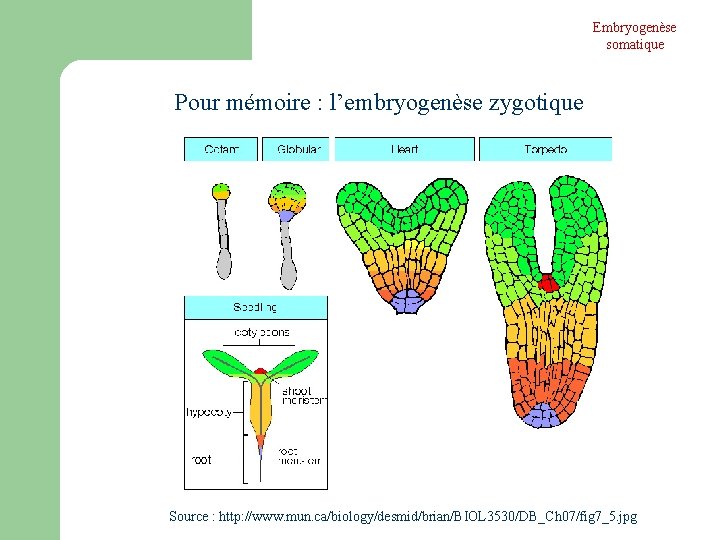
Embryogenèse somatique Pour mémoire : l’embryogenèse zygotique Source : http: //www. mun. ca/biology/desmid/brian/BIOL 3530/DB_Ch 07/fig 7_5. jpg

Exemple : la luzerne Pétioles de luzerne Embryogenèse somatique Mise en culture 2, 4 -D + kinétine 25°C 3 semaines, photopériode 16 h, 75 µE Masses de cal (origine cambium vasculaire) renfermant des cellules initiales d’embryons somatiques (origine épidermique) Dispersion en milieu liquide B 5 (2, 4 -D + kinétine) 7 jours Tamisage : fraction 200 -500 mm transférée sur milieu solide Développement des embryons : 5 -7 jours http: //www. plant. uoguelph. ca/research/embryo/synseeds. htm

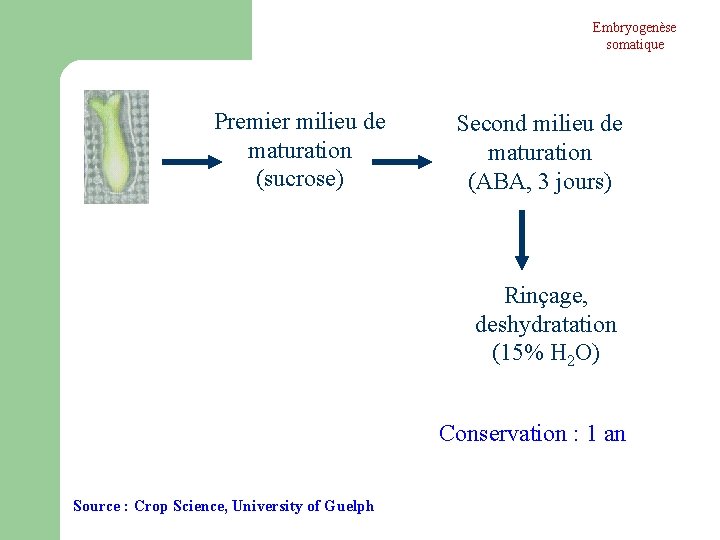
Embryogenèse somatique Premier milieu de maturation (sucrose) Second milieu de maturation (ABA, 3 jours) Rinçage, deshydratation (15% H 2 O) Conservation : 1 an Source : Crop Science, University of Guelph

Embryogenèse somatique Choix des explants, éventuellement application d’un stress pour les rendre compétents Exemple de réussite récente : 2003 : protocole d’embryogenèse somatique chez Arabidopsis avec une étape de stress: Ikeda-Iwai et al. (2003) Plant J.

Embryogenèse somatique Applications Obtention de semences pour des variétés stériles (ex: pommes de terre polyploïdes, bananier…) Semences « d’élite » pour des espèces allogames Solution pour la conservation d’espèces tropicales dont les semences sont dites « récalcitrantes » à la déshydratation Obtention rapide de semences « d’élite » pour des espèces ligneuses Possibilité de cultures en réacteurs : production de semences artificielles à grande échelle (gymnospermes)

Embryogenèse somatique Application aux ligneux http: //www. botanic-garden. ku. dk/eng/forskning/vaev 2. htm

Embryogenèse somatique Semences artificielles (synseeds)

Embryogenèse somatique Feijoa sellowiana

Vitrovariation Non-conformité de la multiplication

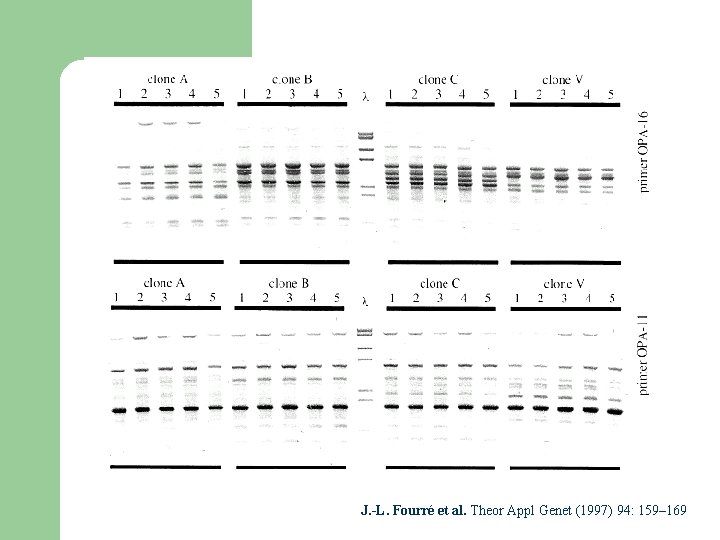
La vitrovariation l Les plantes régénérées à partir de cals, de protoplastes ou de feuilles ne sont pas toujours des clones parfaits: – – instabilité chromosomique, aneupleuïdies différences morphologiques

Clone V Clone C Clone A Clone B diploide Clone B chimère trisomique Clone C diploïde Clone C trisomique J. -L. Fourré et al. Theor Appl Genet (1997) 94: 159– 169

J. -L. Fourré et al. Theor Appl Genet (1997) 94: 159– 169

Utilisation de la vitrovariation l Mise à profit de la variation somaclonale dans le cadre de programmes de sélection – l Sélection de cals tolérants à des stress Augmentation artificielle de la variabilité – – Traitements chimiques Radiations

Création de variabilité Mutagenèse

Exemples à l’INRA d’Angers UMR Génétique et Horticulture INRA/INH/Université d’Angers Equipe : Méthodologie de la sélection et innovation variétale (A. Cadic) Arbres ornementaux : GIE Saphinov Pommier : SARL Novadi

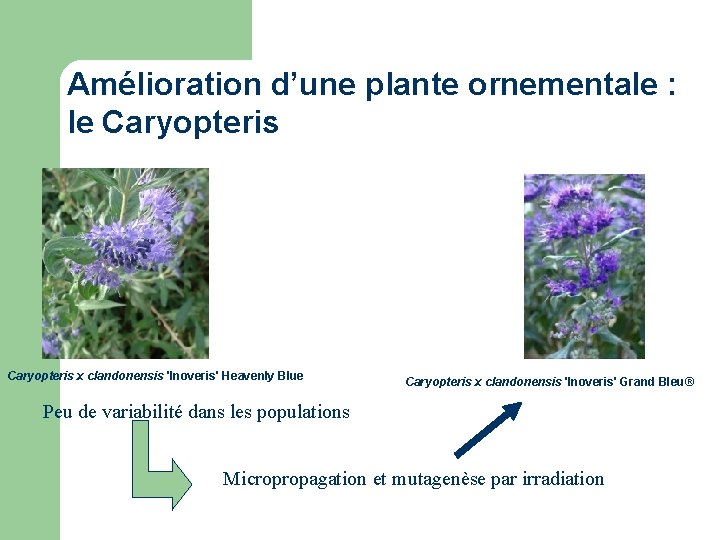
Amélioration d’une plante ornementale : le Caryopteris x clandonensis 'Inoveris' Heavenly Blue Caryopteris x clandonensis 'Inoveris' Grand Bleu® Peu de variabilité dans les populations Micropropagation et mutagenèse par irradiation

Vitropropagation (mise au point) 1 er prix New Plants 99 - Paris INRA/SAPHINOV. Diffusion SAPHO Irradiation de bourgeons : rayons γ (60 Co) (trouver la dose adéquate) Régénération des plantules Sélection des mutants Acclimatation, croissance Perte des caractères (? ? ) Acclimatation, obtention de graines Semis et sélection sur la nouvelle génération Stabilité des caractères Commercialisation

1972 Forsythia variété 'Lynwood'. Micropropagation et mutagenèse par irradiation © INRA, A. Cadic 'Courtalyn' WEEK-END ® Hybridation classique © INRA, A. Cadic 'Courtasol' MAREE D'OR ® 'Courtacour' BOUCLE D'OR

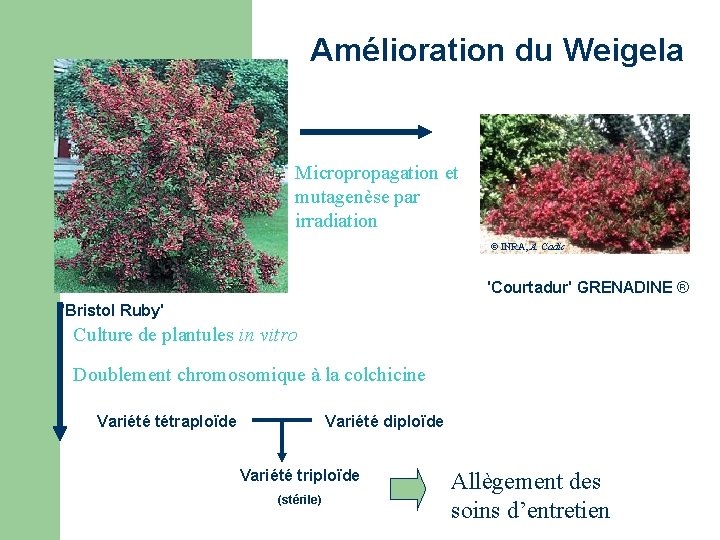
Amélioration du Weigela Micropropagation et mutagenèse par irradiation © INRA, A. Cadic 'Courtadur' GRENADINE ® 'Bristol Ruby' Culture de plantules in vitro Doublement chromosomique à la colchicine Variété tétraploïde Variété diploïde Variété triploïde (stérile) Allègement des soins d’entretien

Apport des biotechnologies dans l’amélioration du Bananier Variétés polyploïdes, stériles, fortement hétérozygotes Multiplication végétative L’amélioration génétique par croisement est impossible Presque toutes les variétés de bananes et de plantain découlent de mutations spontanées

Mutagenèse par irradiation de vitroplants de bananiers Sélection de mutants de petite taille, à fructification précoce PROF. KSHANIKA SANNASGALA HIRIMBUREGAMA Colombo, Sri Lanka Source FAO Possibilité de 4 récoltes tous les 2 ans (au lieu de 3) Impact sur la vie économique locale. Forte demande de plants issus de vitroculture

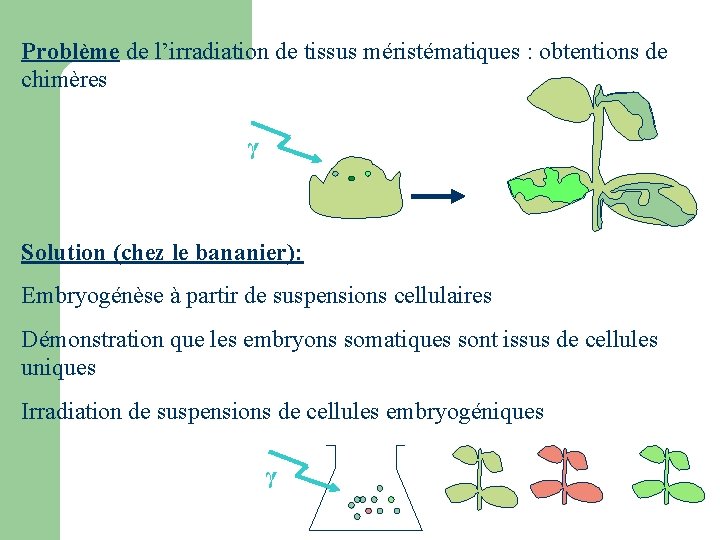
Problème de l’irradiation de tissus méristématiques : obtentions de chimères γ Solution (chez le bananier): Embryogénèse à partir de suspensions cellulaires Démonstration que les embryons somatiques sont issus de cellules uniques Irradiation de suspensions de cellules embryogéniques γ

Sauvetage d’embryon Culture de méristèmes

Sauvetage d’embryons Incompatibilité du porte graine l l Les semences hybrides sont viables mais le développement ne peut se faire sur le pied mère Régénération de la plante par culture in vitro de l’embryon Exemple de la triticale (Triticum x Secale)

Protoplastes Préparation, applications

Protoplastes Définition : cellule de plante, de bactérie ou de champignon débarrassée de sa paroi

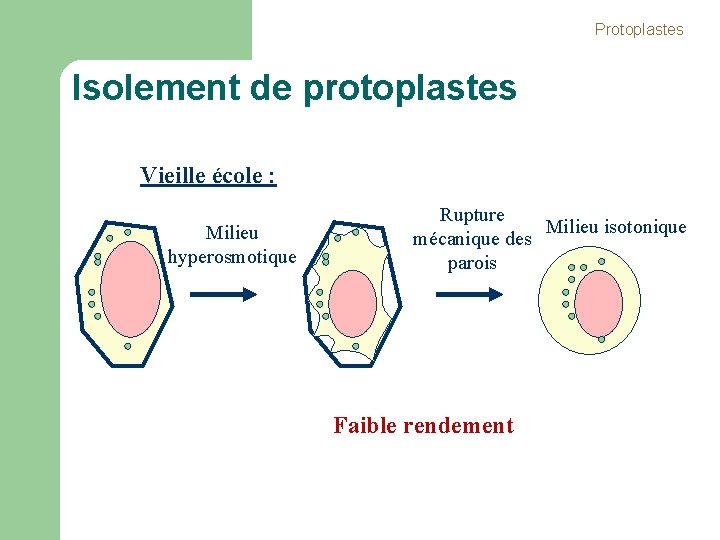
Protoplastes Isolement de protoplastes Vieille école : Milieu hyperosmotique Rupture Milieu isotonique mécanique des parois Faible rendement

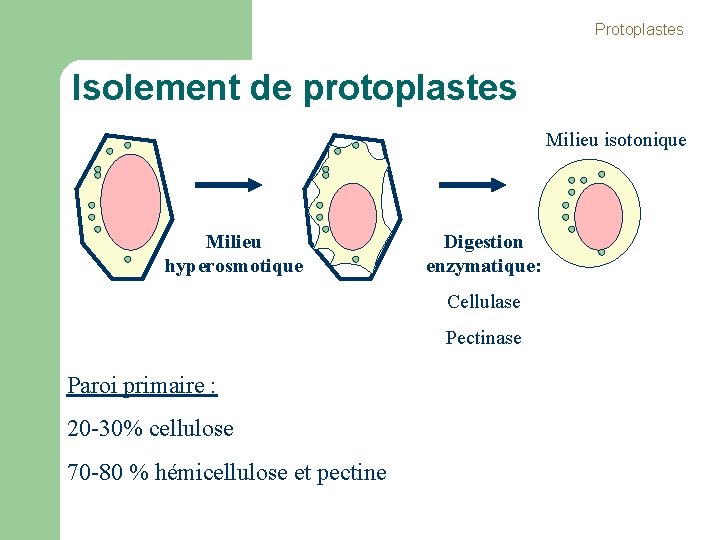
Protoplastes Isolement de protoplastes Milieu isotonique Milieu hyperosmotique Digestion enzymatique: Cellulase Pectinase Paroi primaire : 20 -30% cellulose 70 -80 % hémicellulose et pectine

Purification de protoplastes l Filtration – l l Rinçages Flottement sur coussin de saccharose – l Tamis successifs 100 à 30 µm Saccharose 20%, 100 g Contrôles – – Absence de paroi : Calcofluor White Viabilité : Florescein Diacetate (FDA) l Théoriquement > 80 % viabilité

Culture de protoplastes l l Couche mince, milieu liquide Composition des milieux – – Milieux MS (Murshige et Skoog), B 5 (Gamborg)… Maintenir un potentiel osmotique bas l l – Doses élevées d’hormones l l l Glucose 0, 35 M Glucose + mannitol Deux auxine fortes (2, 4 -D + ANA) + cytokinine Densité élevée de protoplastes (50 000 – 500 000/ ml) Premiers temps à l’obscurité : éviter l’oxydation

Protoplastes Intérêt des protoplastes l l Transformation génétique Régénération de plantes à partir de cultures de protoplastes Etudes d’échanges de métabolites Fusion de protoplastes

Protoplastes Fusion de protoplastes • Fusion spontanée (soja, maïs) • Ca 2+ p. H basique • PEG • Choc électrique

Protoplastes Comment trier les hybrides ? Exemple : fusion entre un protoplaste de poireau et un protoplaste de choux rouge http: //www. snv. jussieu. fr/vie/ Mais aussi : résistance à des xénobiotiques tri sur des caractères morphologiques

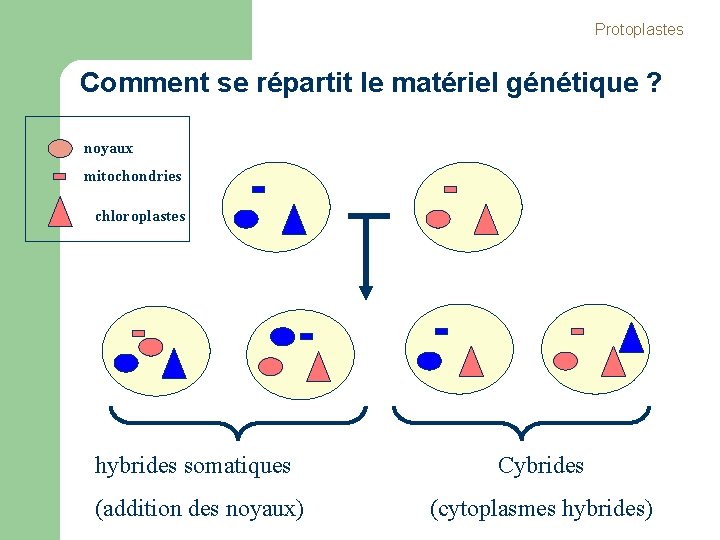
Protoplastes Comment se répartit le matériel génétique ? noyaux mitochondries chloroplastes hybrides somatiques Cybrides (addition des noyaux) (cytoplasmes hybrides)

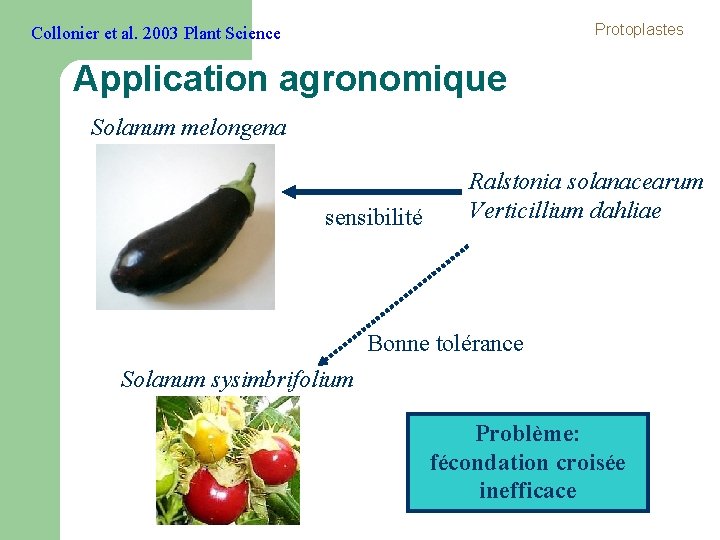
Protoplastes Collonier et al. 2003 Plant Science Application agronomique Solanum melongena sensibilité Ralstonia solanacearum Verticillium dahliae Bonne tolérance Solanum sysimbrifolium Problème: fécondation croisée inefficace

Collonier et al. 2003 Plant Science Protoplastes Confection de protoplastes à partir de 500 mg de feuilles de chaque espèce Ajustement de la densité à 3. 5 105 / ml dans 0. 5 M mannitol + 0. 5 m. M Ca. Cl 2 Mélanger les deux préparations dans une boite de Petri Alignement : courant alternatif 15 s, 230, V. cm-1, 1 MHz Fusion : courant continu 2*45 s 1200 V. cm-1

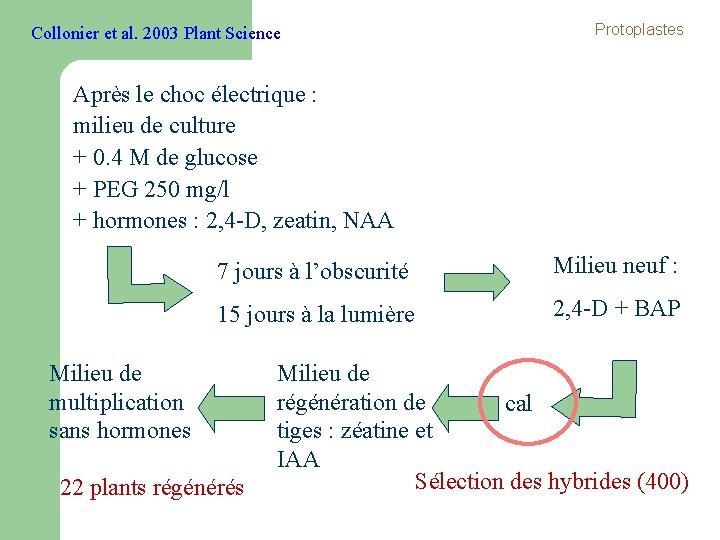
Collonier et al. 2003 Plant Science Protoplastes Après le choc électrique : milieu de culture + 0. 4 M de glucose + PEG 250 mg/l + hormones : 2, 4 -D, zeatin, NAA 7 jours à l’obscurité Milieu neuf : 15 jours à la lumière 2, 4 -D + BAP Milieu de multiplication sans hormones 22 plants régénérés Milieu de régénération de cal tiges : zéatine et IAA Sélection des hybrides (400)

Protoplastes Comment être sûr qu’il s’agit d’hybrides ?

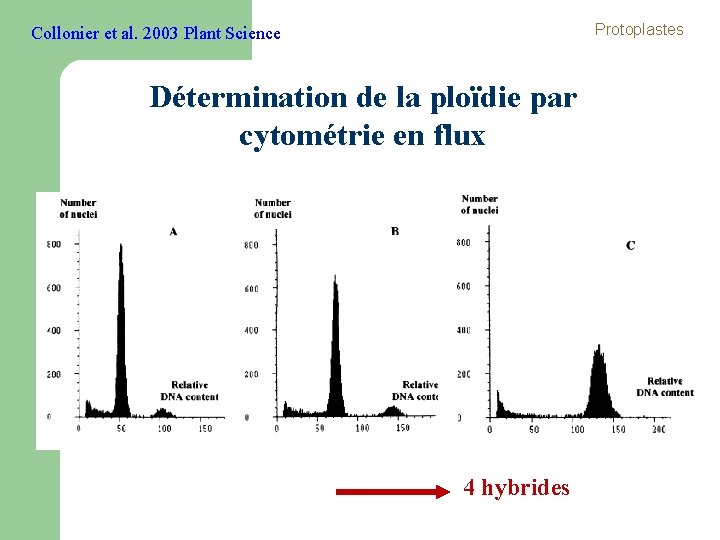
Protoplastes Collonier et al. 2003 Plant Science Détermination de la ploïdie par cytométrie en flux 4 hybrides

Collonier et al. 2003 Plant Science Morphologie des hybrides Protoplastes

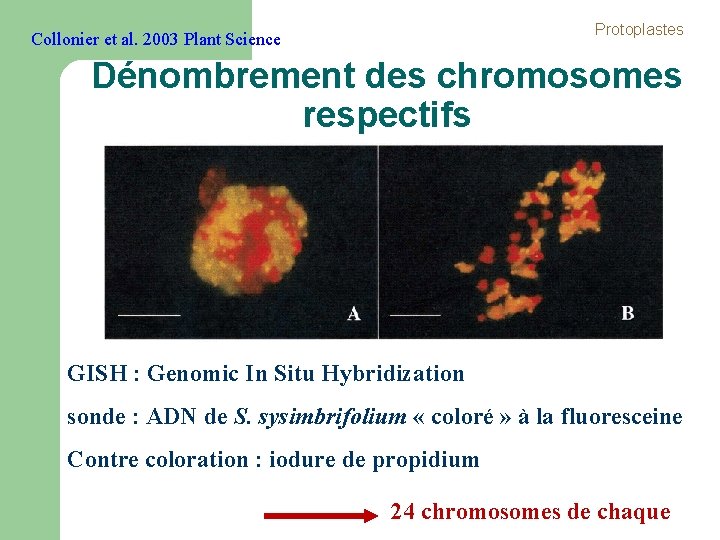
Protoplastes Collonier et al. 2003 Plant Science Dénombrement des chromosomes respectifs GISH : Genomic In Situ Hybridization sonde : ADN de S. sysimbrifolium « coloré » à la fluoresceine Contre coloration : iodure de propidium 24 chromosomes de chaque

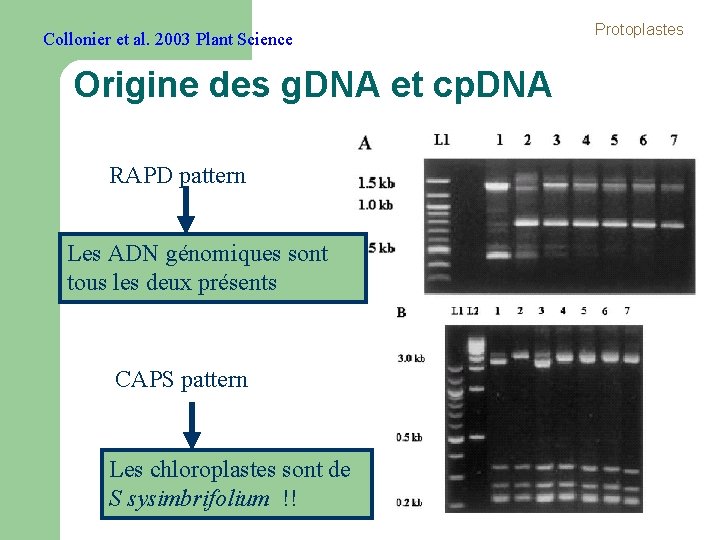
Collonier et al. 2003 Plant Science Origine des g. DNA et cp. DNA RAPD pattern Les ADN génomiques sont tous les deux présents CAPS pattern Les chloroplastes sont de S sysimbrifolium !! Protoplastes

Protoplastes Collonier et al. 2003 Plant Science Tolérance au flétrissement bactérien causé par Ralstonia S. melongena S. sysimbrifolia Hybride Collonier et al. 2003 Plant Science

Haplo/diploïdisation Androgenèse, Gynogenèse

Haplo/diploïdisation Des haploïdes : pourquoi faire ? l l Recherche de mutations récessives Haplo/diploïdisation : homozygotie 100% Des homozygotes : pourquoi faire ? Outil de sélection : espèces autogames, espèces allogames

Haplo/diploïdisation Obtention de plants haploïdes l Haploïdisation spontanée – l Parthénogenèse (cellules sac embryonnaire) Haploïdisation induite – – – Androgenèse in vitro Gynogenèse in vitro Parthénogenèse in situ

Haplo/diploïdisation Androgenèse l Limite : albinisme dans certains cas Développement sporophytique (haploïde) par culture des gamétophytes mâles – Cultures d’anthères ou de microspores isolées Source : CNRC-IBP-Canada

Haplo/diploïdisation Gynogenèse l Développement sporophytique de gamétophytes femelles obtention de plants haploïdes – – – Culture in vitro d’ovaires ou d’ovules Pollinisation croisée Parthénogenèse in situ Utilisation de pollen irradié

Haplo/diploïdisation Doublement des chromosomes l Utilisation d’agents mitoclasiques – Blocage de la polymérisation des microtubules l l l Colchicine Oryzaline Contrôle de la ploïdie – Cytométrie en flux

Haplo/diploïdisation Source : http: //www. angers. inra. fr/dossiers/haploidie/ Obtention d’haploïdes de pommier Le pommier : un matériel génétique difficile à étudier: • Cycle reproductif lent (période juvénile 5 -7 ans) • Autostérilité Impossible d’obtenir des lignées 100% homozygotes par la sélection classique Obtention de lignées haploïdes Doublement chromosomique

Source : http: //www. angers. inra. fr/dossiers/haploidie/ Haplo/diploïdisation Obtention des haploïdes l l l Fécondation avec du pollen irradié à 200 Gy Récolte des graines et semis Première étape : sélection des haploïdes

Source : http: //www. angers. inra. fr/dossiers/haploidie/ Haplo/diploïdisation Micropropagation des haploïdes l Mise en culture d’apex l Multiplication (repiquage toutes les 5 semaines)

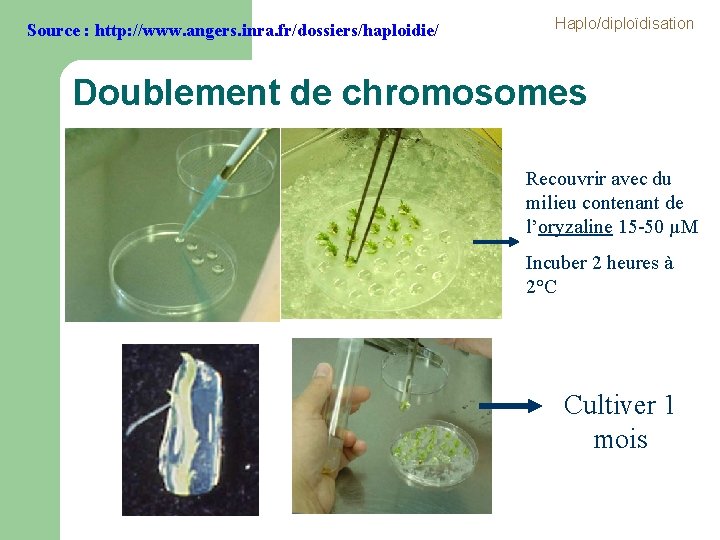
Source : http: //www. angers. inra. fr/dossiers/haploidie/ Haplo/diploïdisation Doublement de chromosomes Recouvrir avec du milieu contenant de l’oryzaline 15 -50 µM Incuber 2 heures à 2°C Cultiver 1 mois

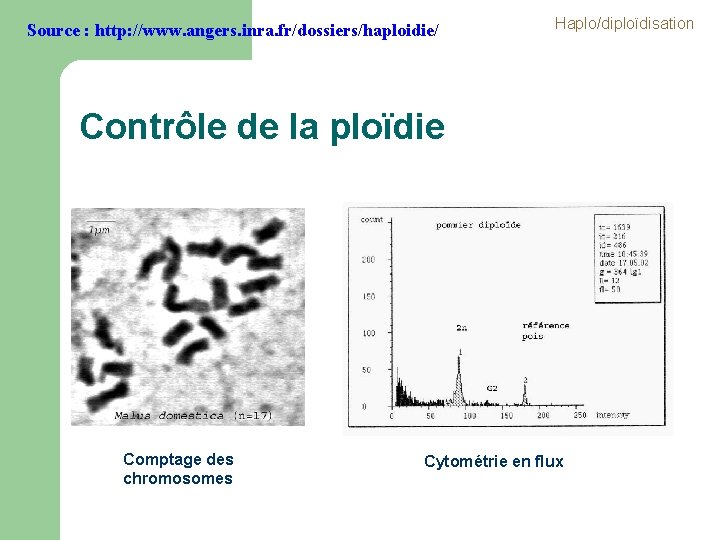
Source : http: //www. angers. inra. fr/dossiers/haploidie/ Haplo/diploïdisation Contrôle de la ploïdie Comptage des chromosomes Cytométrie en flux

Source : http: //www. angers. inra. fr/dossiers/haploidie/ Haplo/diploïdisation Microgreffage et sortie d’in vitro humidité relative 80%

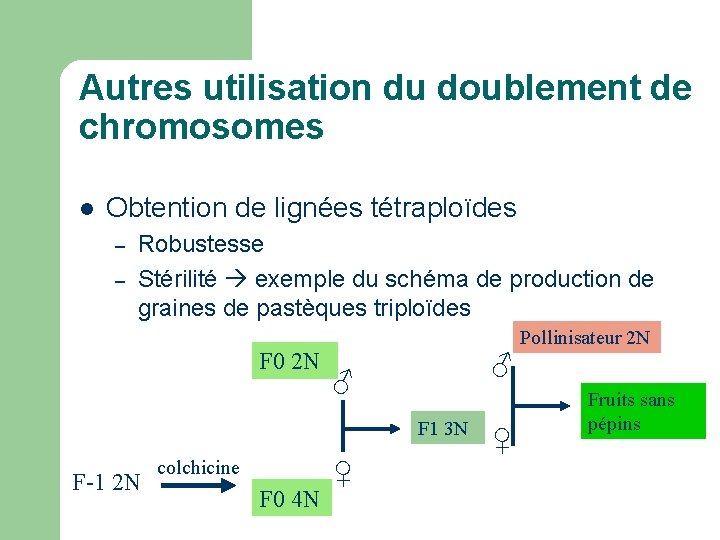
Autres utilisation du doublement de chromosomes l Obtention de lignées tétraploïdes – – Robustesse Stérilité exemple du schéma de production de graines de pastèques triploïdes F 0 2 N Pollinisateur 2 N ♂ ♂ F 1 3 N F-1 2 N colchicine F 0 4 N ♀ ♀ Fruits sans pépins

Cryoconservation

Cryoconservation Définitions l Conservation de matériel vivant à très basse température – – l Azote liquide (-196°C) Vapeurs d’azote (-150°C) Etat de vie suspendue, réversible

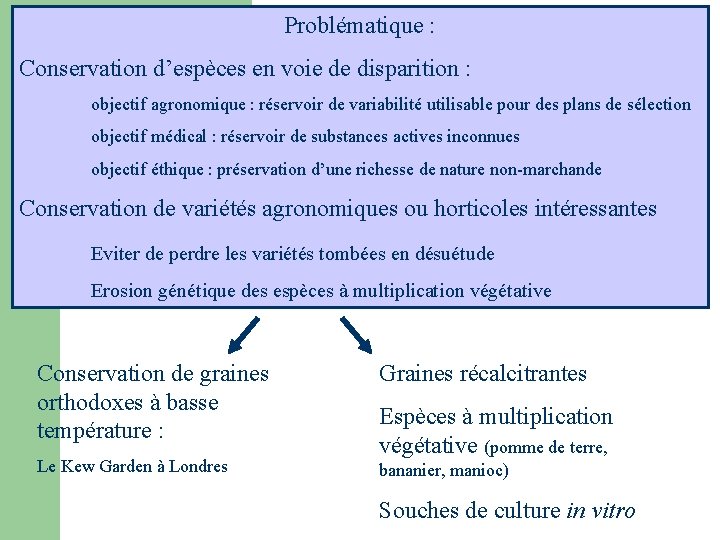
Problématique : Conservation d’espèces en voie de disparition : objectif agronomique : réservoir de variabilité utilisable pour des plans de sélection objectif médical : réservoir de substances actives inconnues objectif éthique : préservation d’une richesse de nature non-marchande Conservation de variétés agronomiques ou horticoles intéressantes Eviter de perdre les variétés tombées en désuétude Erosion génétique des espèces à multiplication végétative Conservation de graines orthodoxes à basse température : Graines récalcitrantes Le Kew Garden à Londres bananier, manioc) Espèces à multiplication végétative (pomme de terre, Souches de culture in vitro

Cryoconservation Cultures in vitro en conditions de croissance réduite : Avantage : faible surface / jardin botanique Exmple : Conservation de cultures de bananes Inconvénients : importantes charges de travail risque de pertes : contaminations, erreur humaine variations somaclonales http: //www. biw. kuleuven. be

Cryoconservation Meilleure solution : la cryopreservation stockage à – 196°C cryopreservation de cultures de tissus (100 espèces) cyopreservation de graines récalcitrantes (40 espèces) conservation de souches de cellules fortement productrices de métabolites secondaires conservation de tissus génétiquement modifiés

Cryoconservation Principes l Éviter la formation de cristaux dans le cytoplasme – – Congélation rapide Déshydratation des échantillons l l Séchage à l’air Déshydratation par congélation lente

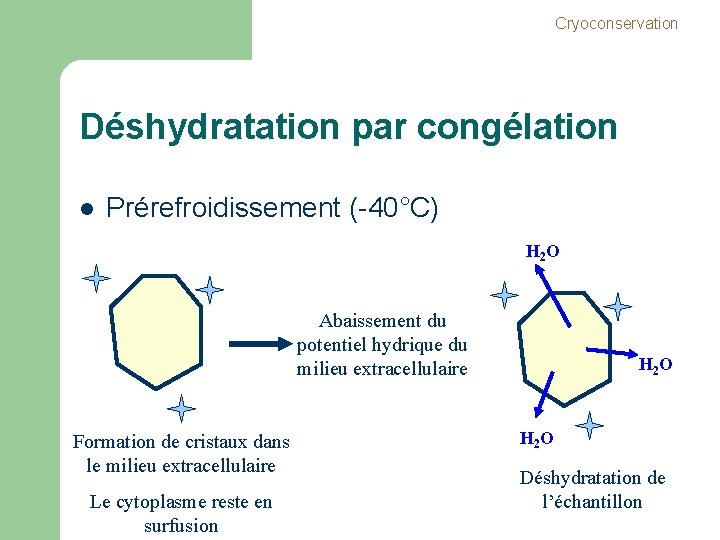
Cryoconservation Déshydratation par congélation l Prérefroidissement (-40°C) H 2 O Abaissement du potentiel hydrique du milieu extracellulaire Formation de cristaux dans le milieu extracellulaire Le cytoplasme reste en surfusion H 2 O Déshydratation de l’échantillon

Cryoconservation Vitrification du milieu intracellulaire l Solidification non-cristalline du cytoplasme – – Concentration de solutés osmoprotectants Congélation rapide

Cryoconservation Substances cryoprotectrices l l DMSO, glycérol, proline Adaptation métabolique: – – – Froid Réduction photopériode ABA [solutés ] Sucres, proline, glycine bétaïne
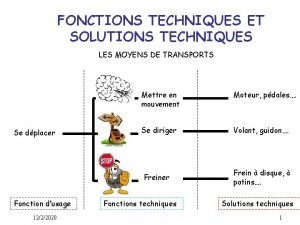
 Les fonctions techniques et les solutions techniques
Les fonctions techniques et les solutions techniques Handcuff nomenclature
Handcuff nomenclature Quality management tools
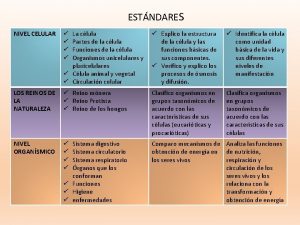
Quality management tools Principales zonas climáticas de la tierra
Principales zonas climáticas de la tierra Componentes principales de un navegador
Componentes principales de un navegador Idea principal de gestalt
Idea principal de gestalt Vegetacion montaña
Vegetacion montaña Conclusiones y recomendaciones de sistemas operativos
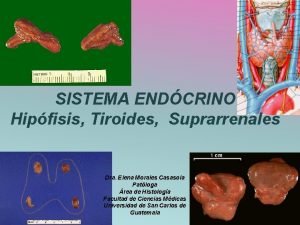
Conclusiones y recomendaciones de sistemas operativos Descripcion de la tiroides
Descripcion de la tiroides Principales obras de san agustín de hipona
Principales obras de san agustín de hipona Características del renacimiento y el barroco
Características del renacimiento y el barroco Principales alturas del relieve colombiano
Principales alturas del relieve colombiano Estructura de relieve
Estructura de relieve Principales características de los seres vivos
Principales características de los seres vivos Principales recursos económicos
Principales recursos económicos Personajes dama del alba
Personajes dama del alba Padre de la administración científica
Padre de la administración científica Lentes concavos
Lentes concavos Que tipo de fuente es
Que tipo de fuente es Que es el centro nervioso
Que es el centro nervioso Estructura de no oyes ladrar los perros
Estructura de no oyes ladrar los perros Principales prefijos y sufijos
Principales prefijos y sufijos Principales funciones de la mitocondria
Principales funciones de la mitocondria Micrómetros de interiores
Micrómetros de interiores Principales obras de manuel montt
Principales obras de manuel montt Dos características de las
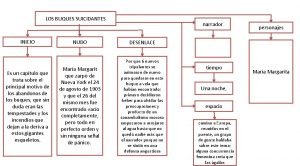
Dos características de las Los buques suicidantes personajes principales y secundarios
Los buques suicidantes personajes principales y secundarios La lluvia bajo la higuera
La lluvia bajo la higuera Las principales características del estado moderno
Las principales características del estado moderno Características de lazarillo de tormes
Características de lazarillo de tormes Zonas climaticas planisferio
Zonas climaticas planisferio Reforma protestante objetivo
Reforma protestante objetivo Toponimia de costa o chala
Toponimia de costa o chala Eucariota partes
Eucariota partes Particulas elementales mitocondria
Particulas elementales mitocondria Como saber las ideas principales de un texto
Como saber las ideas principales de un texto Fascismo características
Fascismo características Tipos de figuras literarias
Tipos de figuras literarias Estos son los resultados principales
Estos son los resultados principales Tales de mileto escuela
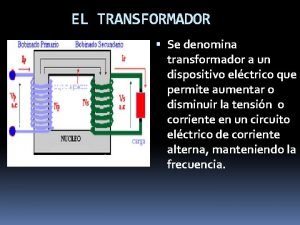
Tales de mileto escuela Conexion delta delta en transformadores
Conexion delta delta en transformadores El pianista historia real
El pianista historia real La ciencia es util
La ciencia es util Ideas principales del marxismo
Ideas principales del marxismo Relato popular
Relato popular Nietzsche ideas principales
Nietzsche ideas principales Instrumento barroco
Instrumento barroco Principales exponentes de positivismo
Principales exponentes de positivismo Contenido
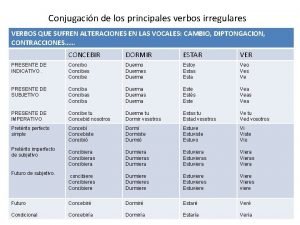
Contenido Principales verbos irregulares
Principales verbos irregulares Palabras para comparar y contrastar
Palabras para comparar y contrastar Colonialismo siglo xix caracteristicas
Colonialismo siglo xix caracteristicas Principales caracteristicas del modernismo
Principales caracteristicas del modernismo Teoría crítica de la escuela de frankfurt
Teoría crítica de la escuela de frankfurt Sociedad maya
Sociedad maya Principales paralelos y zonas climaticas
Principales paralelos y zonas climaticas Principal centrales hidroelectricas de venezuela
Principal centrales hidroelectricas de venezuela Características de platon
Características de platon Principales autores de la edad moderna
Principales autores de la edad moderna Estructura externa de bodas de sangre
Estructura externa de bodas de sangre Bodas de sangre personajes principales
Bodas de sangre personajes principales Martin lutero ideas
Martin lutero ideas Arturo uslar pietri: la lluvia
Arturo uslar pietri: la lluvia Un gato grande negro y gordo
Un gato grande negro y gordo Insectos arácnidos crustáceos y miriápodos
Insectos arácnidos crustáceos y miriápodos U
U Principales yacimientos de uranio en mexico
Principales yacimientos de uranio en mexico Que es sociologia de la salud
Que es sociologia de la salud Principales zonas industriales del mundo
Principales zonas industriales del mundo Que tipo de cuento es el cuento de horror de marco denevi
Que tipo de cuento es el cuento de horror de marco denevi Poemas inca
Poemas inca Atmani najib tronc commun
Atmani najib tronc commun Escuela poetica sevillana
Escuela poetica sevillana Una computadora y sus partes
Una computadora y sus partes Hildegard e peplau
Hildegard e peplau Dos de los objetivos principales del paari son
Dos de los objetivos principales del paari son Cuántas partes
Cuántas partes Principales estrofas castellanas
Principales estrofas castellanas Celula vegetal y animal
Celula vegetal y animal Principales ideas de montesquieu
Principales ideas de montesquieu Falanginas
Falanginas Diferencias entre procesos artesanales e industriales
Diferencias entre procesos artesanales e industriales