VIRUS DELLEPATITE E UNA ZOONOSI EMERGENTE Ilaria Di


























- Slides: 35

VIRUS DELL’EPATITE E: UNA ZOONOSI EMERGENTE? Ilaria Di Bartolo Istituto Superiore di Sanità Dipartimento Sicurezza Alimentare, Nutrizione e Sanità Pubblica Veterinaria Orvieto, 3 -4 Maggio 2018

EPATITE E NELL’UOMO • Prima segnalazione: 1955 New Delhi; focolaio epidemico (30. 000 persone), causato da acqua contaminata • Nel 1983 venne dimostrata la trasmissione oro-fecale • Inizio anni 90 infezione sperimentale nelle scimmie, identificazione dell’agente eziologico • In Italia primo caso umano, causato da virus autoctono nel 1999 Orvieto, 3 -4 Maggio 2018

CARATTERISTICHE CLINICHE • Trasmissione: via oro-fecale (principale) • Incubazione: 40 giorni (15 -60 giorni) • Sintomi: vomito, febbre, dolori addominali, ittero, innalzamento delle transaminasi • Acuta e autolimitante (3 settimane) • Letalità: 1% (donne gravide: 25%) Orvieto, 3 -4 Maggio 2018

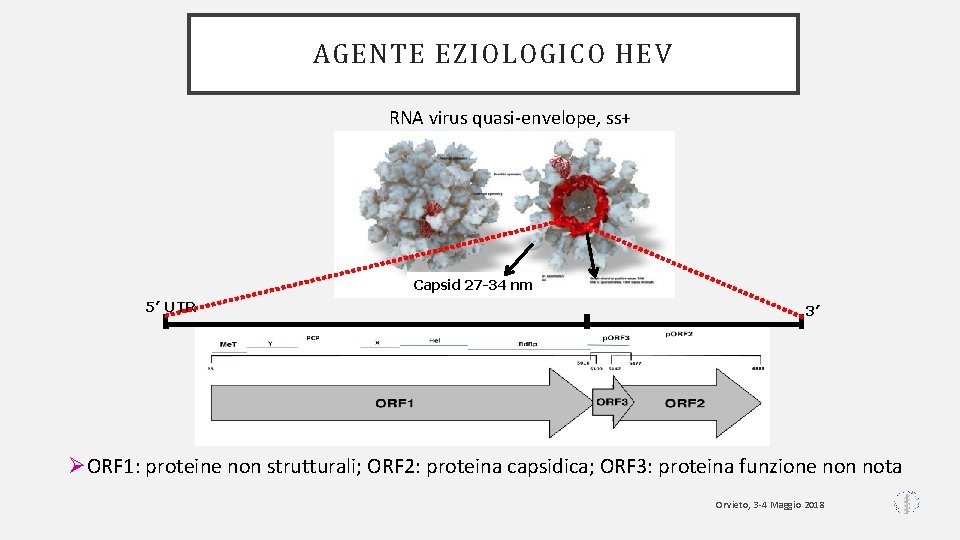
AGENTE EZIOLOGICO HEV RNA virus quasi-envelope, ss+ Capsid 27 -34 nm 5’ UTR 3’ ØORF 1: proteine non strutturali; ORF 2: proteina capsidica; ORF 3: proteina funzione non nota Orvieto, 3 -4 Maggio 2018

CLASSIFICAZIONE • Famiglia Hepeviridae • Genere Piscihepevirus and Orthohepevirus • Piscihepevirus trota • Orthohepevirus mammiferi e aviari • 4 specie: A-D • Orthohepevirus A uomo e animali • 8 genotipi: HEV 1– 8 Modified by Lhomme et al. , 2016 Orvieto, 3 -4 Maggio 2018

ORTHOHEPEVIRUS A Classificati in 7 genotipi (8 proposto) e sottotipi • HEV-1 e HEV-2 infettano l’uomo • HEV-3 -4 -7 infettano l’uomo e animali • HEV-5 -6 cinghiale (Giappone) Modificato da Pavio et al. , 2017 Orvieto, 3 -4 Maggio 2018

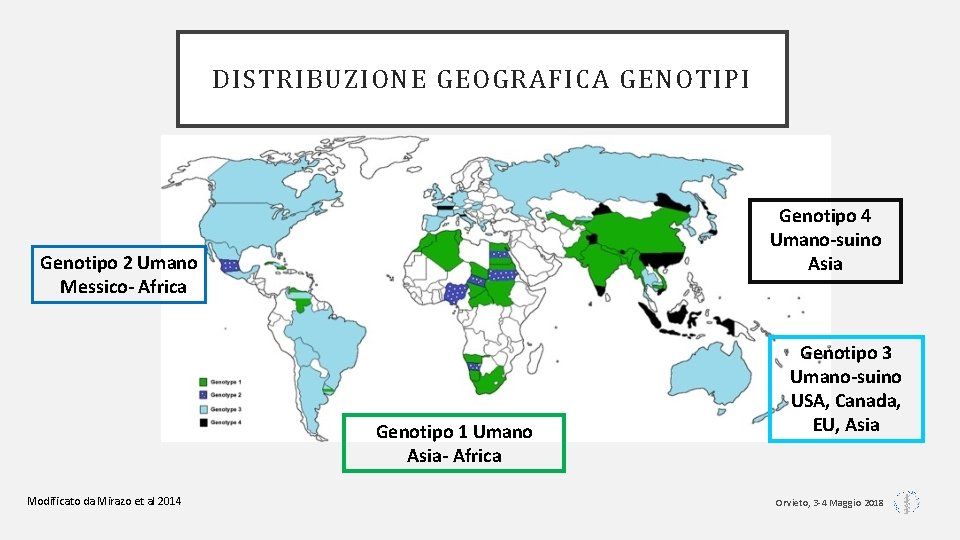
DISTRIBUZIONE GEOGRAFICA GENOTIPI Genotipo 4 Umano-suino Asia Genotipo 2 Umano Messico- Africa Genotipo 1 Umano Asia- Africa Modificato da Mirazo et al 2014 Genotipo 3 Umano-suino USA, Canada, EU, Asia Orvieto, 3 -4 Maggio 2018

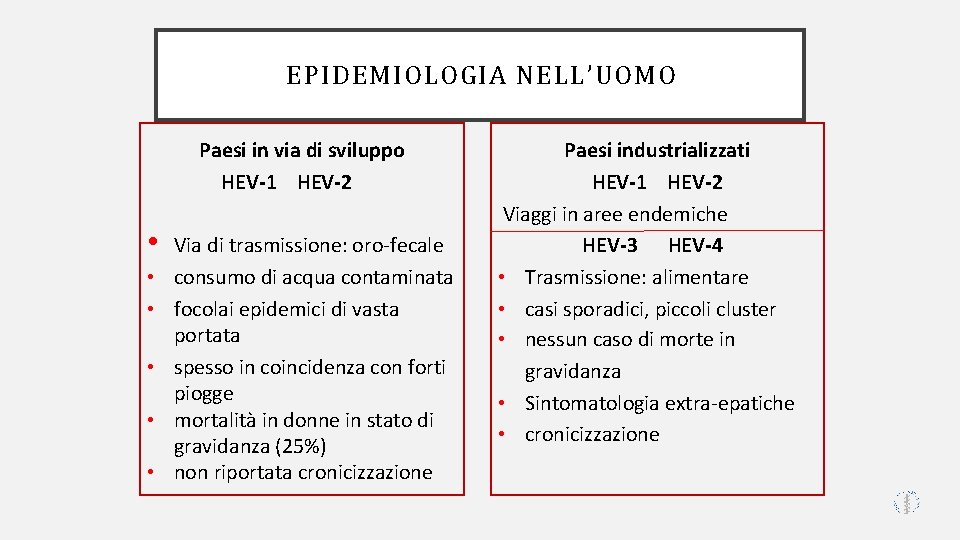
EPIDEMIOLOGIA NELL’UOMO Paesi in via di sviluppo HEV-1 HEV-2 • • • Via di trasmissione: oro-fecale consumo di acqua contaminata focolai epidemici di vasta portata spesso in coincidenza con forti piogge mortalità in donne in stato di gravidanza (25%) non riportata cronicizzazione Paesi industrializzati HEV-1 HEV-2 Viaggi in aree endemiche HEV-3 HEV-4 • Trasmissione: alimentare • casi sporadici, piccoli cluster • nessun caso di morte in gravidanza • Sintomatologia extra-epatiche • cronicizzazione

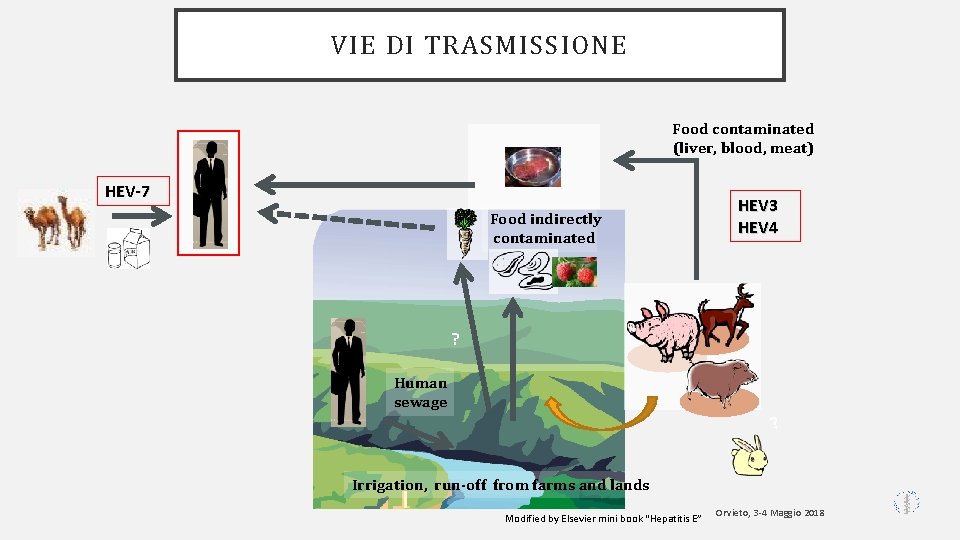
VIE DI TRASMISSIONE Food contaminated (liver, blood, meat) HEV-7 c HEV 3 HEV 4 Food indirectly contaminated ? c Human sewage ? Irrigation, run-off from farms and lands Modified by Elsevier mini book “Hepatitis E” Orvieto, 3 -4 Maggio 2018

HEV NEGLI ANIMALI • Primo ceppo animale di HEV identificato nel 1997 in USA nel suino (correlato a ceppi umani autoctoni) • Stessa distribuzione geografica ceppi umani e suini • Suino serbatoio di infezione • Ceppi umani, suini e del cinghiale sono geneticamente correlati e mostrano un’elevate identità nucleotidica Orvieto, 3 -4 Maggio 2018

PATOGENESI NEL SUINO • L’infezione è asintomatica • RNA di HEV è rilevabile principalmente in animali di 2 -4 mesi • Il virus viene rilasciato nelle feci per 7 -8 settimane • Il virus si trova nella bile e nel fegato. Infezioni sperimentali nel muscolo • Durata della viremia è variabile • Durata dell’immunità non è nota Modified by https: //www. pig 333. com/public-health/ Orvieto, 3 -4 Maggio 2018

SIEROPREVALENZA NEI SUINI • Sieroprevalenze elevate sono state descritte in Europa. • In Inghilterra e in Italia sieroprevalenza ~92% in animali al macello (scrofe, >9 mesi) (Grierson et al. , 2015; Ponterio et al. , 2014). In media le sieroprevalenze si attestano intorno al 50% • La sieroprevalenza varia in funzione dell’età dell’animale: < 2 mesi negativi > 3 -4 mesi prevalenza superiore all’ 80% Orvieto, 3 -4 Maggio 2018

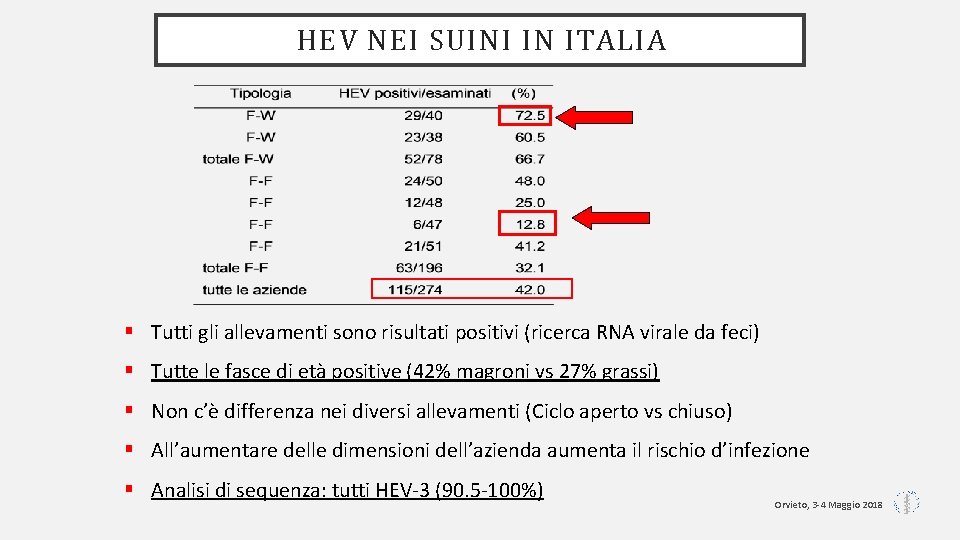
HEV NEI SUINI IN ITALIA § Tutti gli allevamenti sono risultati positivi (ricerca RNA virale da feci) § Tutte le fasce di età positive (42% magroni vs 27% grassi) § Non c’è differenza nei diversi allevamenti (Ciclo aperto vs chiuso) § All’aumentare delle dimensioni dell’azienda aumenta il rischio d’infezione § Analisi di sequenza: tutti HEV-3 (90. 5 -100%) Orvieto, 3 -4 Maggio 2018

HEV NEI SUINI IN ITALIA § 2008 48 suini al macello (20 di 3 -4 mesi; 28 di 9 -10 mesi). Prevalenza 64. 6% (31/48) La bile è il campione più frequentemente positivo 51%, seguito dalle feci 33% e dal fegato 20. 8%. Sieroprevalenza: 86%. TUTTI CEPPI DI suino identificati appartengo al GENOTIPO 3 § 2013 genotipo 4 nei suini (Monne et al. , 2014) § 2010 -2014 - 26 su 105 (24, 8%) allevamenti risultano positivi per ricerca HEV nelle feci (25 HEV-3, 1 HEV-4) (Mughini Gras et al. , 2017) Genotipo 4

HEV: ZOONOSI? • Elevate analogie genetiche tra ceppi virali umani e ceppi suini rinvenuti su uno stesso territorio (anche del 100%) • Dimostrata sperimentalmente la possibilità di trasmissione interspecifica di ceppi umani al suino e di ceppi suini a primati non umani • EVIDENZA DIRETTA • Identificazione stesso ceppo virale nell’uomo e negli alimenti consumati

HEV TRASMISSIONE ALIMENTARE Asia • HEV consumo carne di cinghiale poco cotta barbecue (Giappone 2003) • HEV consumo sashimi carne di cervo (Tei et al. , 2003) Europa • focolaio epidemico legato al consumo di Figatelli (Colson et al. , 2010) 8 casi di HEV notificati in soggetti senza anamnesi di viaggi all’estero che avevano consumato “Figatelli” in Corsica. (Figatelli: salsiccia secca contenente 30% fegato di maiale). • Studio Caso-Controllo conferma il link con il consumo di “Figatelli”. • Indagine virologica, sequenziamento, conferma HEV-3 nei “Figatelli” al commercio.

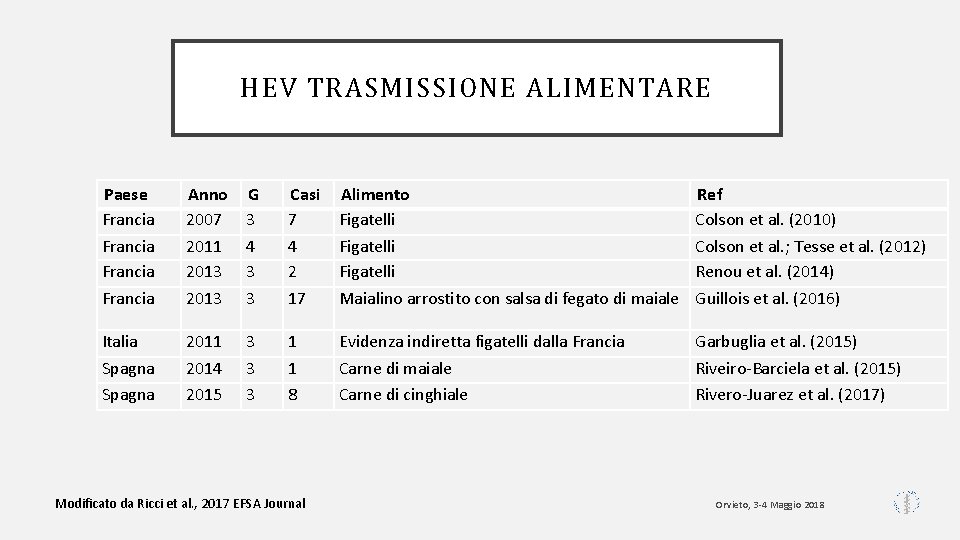
HEV TRASMISSIONE ALIMENTARE Paese Francia Anno 2007 2011 2013 G 3 4 3 3 Casi 7 4 2 17 Alimento Figatelli Maialino arrostito con salsa di fegato di maiale Ref Colson et al. (2010) Colson et al. ; Tesse et al. (2012) Renou et al. (2014) Guillois et al. (2016) Italia Spagna 2011 2014 2015 3 3 3 1 1 8 Evidenza indiretta figatelli dalla Francia Carne di maiale Carne di cinghiale Garbuglia et al. (2015) Riveiro-Barciela et al. (2015) Rivero-Juarez et al. (2017) Modificato da Ricci et al. , 2017 EFSA Journal Orvieto, 3 -4 Maggio 2018

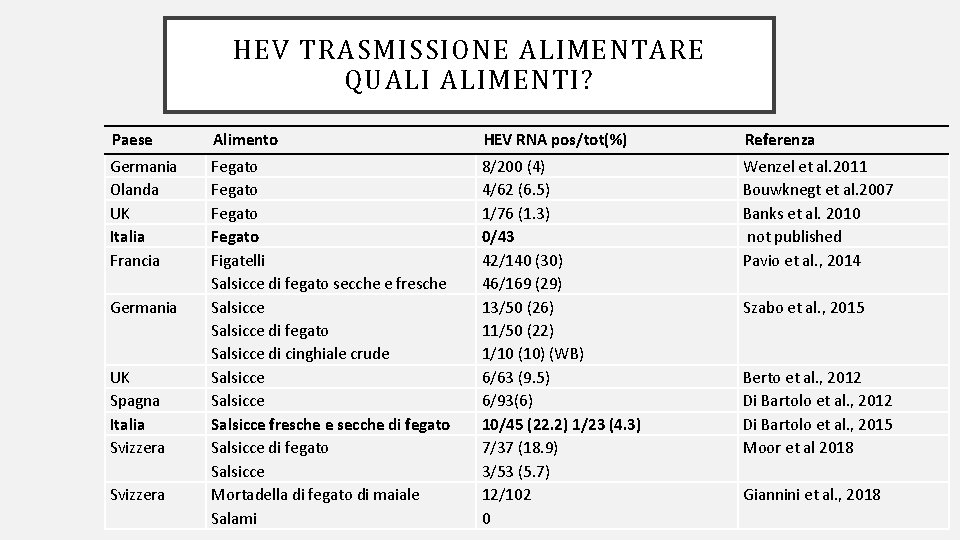
HEV TRASMISSIONE ALIMENTARE QUALI ALIMENTI? Paese Alimento HEV RNA pos/tot(%) Referenza Germania Olanda UK Italia Francia Fegato Figatelli Salsicce di fegato secche e fresche Salsicce di fegato Salsicce di cinghiale crude Salsicce fresche e secche di fegato Salsicce Mortadella di fegato di maiale Salami 8/200 (4) 4/62 (6. 5) 1/76 (1. 3) 0/43 42/140 (30) 46/169 (29) 13/50 (26) 11/50 (22) 1/10 (10) (WB) 6/63 (9. 5) 6/93(6) 10/45 (22. 2) 1/23 (4. 3) 7/37 (18. 9) 3/53 (5. 7) 12/102 0 Wenzel et al. 2011 Bouwknegt et al. 2007 Banks et al. 2010 not published Pavio et al. , 2014 Germania UK Spagna Italia Svizzera Szabo et al. , 2015 Berto et al. , 2012 Di Bartolo et al. , 2015 Moor et al 2018 Giannini et al. , 2018 Orvieto, 3 -4 Maggio 2018

PRESENZA DEL VIRUS DELL’EPATITE E NELLA FILIERA DI PRODUZIONE DEL SUINO Czech Republic Production stage Sample Feces Slaughterhouse Macello Liver Meat Processing/point Trasformazione of sale Sausage No. positive (%) Italy No. tested Spain Virus No. tested No. positive (%) HEV 40 1 a (2. 5) 34 14 (41. 2) 39 15 a (38. 5) PAd. V 40 39 (97. 5) 34 31 (91. 2) 39 35 (89. 7) HEV 40 2 a (5. 0) 33 2 (6. 06) 39 1 a (2. 6) PAd. V 40 - - 33 - - 39 - - HEV 40 1 (2. 5) 33 2 (6. 06) 39 - - PAd. V 40 - - 33 1 b (3. 03) 39 - - HEV 92 - - 128 - - 93 6 (6. 5) PAd. V 92 1 (1. 1) 128 1 (0. 78) 93 2 b (2. 2) Tamponi ambientali Orvieto, 3 -4 Maggio 2018

CONTAMINAZIONI AMBIENTALI Sample Production stage (area) Production (Slaughterhouse: carcass dissection & liver removal) Processing (skin removal & sausage preparation) Point of sale Total Type Workers hands & aprons Working surfaces & cutting tools Workers hands & gloves Working surfaces & cutting tools Hand wash basin tap & toilet edge All samples No. positive for virus (%) No. tested HEV PAd. V 7 5 (71. 4) 6 (85. 7) 16 7 (43. 8) 6 (37. 5) 7 2 (28. 6) - - 19 4 (21. 1) - - 6 - - 12 1 (8. 3) - - 8 1 (12. 5) 75 20 (26. 7) 13 (17. 3) Rischio di contaminazione nelle fasi di lavorazione Orvieto, 3 -4 Maggio 2018

VITALITÀ DEL VIRUS Il rilevamento dell’RNA virale non implica vitalità del virus • Inoculo su cellule (3 D) di 4 campioni di salsiccia di fegato. Replicazione dimostrata per 1 campione di salsiccia (Berto, 2013) • Infezione sperimentale nel suino Inoculo Genotipo Trattamento termico Referenza Omogenato di fegato HEV-3 56°C per 1 h 100°C per 5’ Infezione + - Patè (30% fegato + 48% grasso) HEV-3 62°C - 71°C per 5’ 71°C per 20’ Infezione + - Feagins et al. 2008 Barnaud et al. 2012 Orvieto, 3 -4 Maggio 2018

CINGHIALE • HEV 3 • Ceppi HEV 3 con elevate identità nucleotidica circolano nel suino, nel cinghiale e nell’uomo • Infezione sperimentale di cinghiale con HEV 3 ceppo suino • Trasmissione alimentare Europa: • Sieroprevalenze dal 4. 9% (Caruso et al. , 2015) al 57. 4% (Kukielka et al. , 2016) • Italia: (almeno 8 studi pubblicati per la ricerca di HEV-RNA): 0% (1 studio)- 52. 2% (De Sabato et al. accepted) • Animali adulti positivi per HEV-RNA nel fegato Orvieto, 3 -4 Maggio 2018

CONIGLIO Italia sieroprevalenza Ig. G HEV: 3. 4% coniglio d’allevamento, 6. 6% pet HEV-RNA Allevamento Selvatico Francia 7% 23% Izopet et al. 2012 Olanda 0%-23% 60% Burt et al. , 2016 Italia 0% - Di Bartolo et al. , 2016 Ceppi di coniglio classificati come HEV-3 ra • Francia: 5 casi positivi per HEV-3 ra. Nessun contatto diretto conigli (Abravanel et al. , 2017) • Nessun caso di trasmissione alimentare • Infezioni sperimentali ceppo suino nel coniglio e viceversa risultati discordanti Orvieto, 3 -4 Maggio 2018

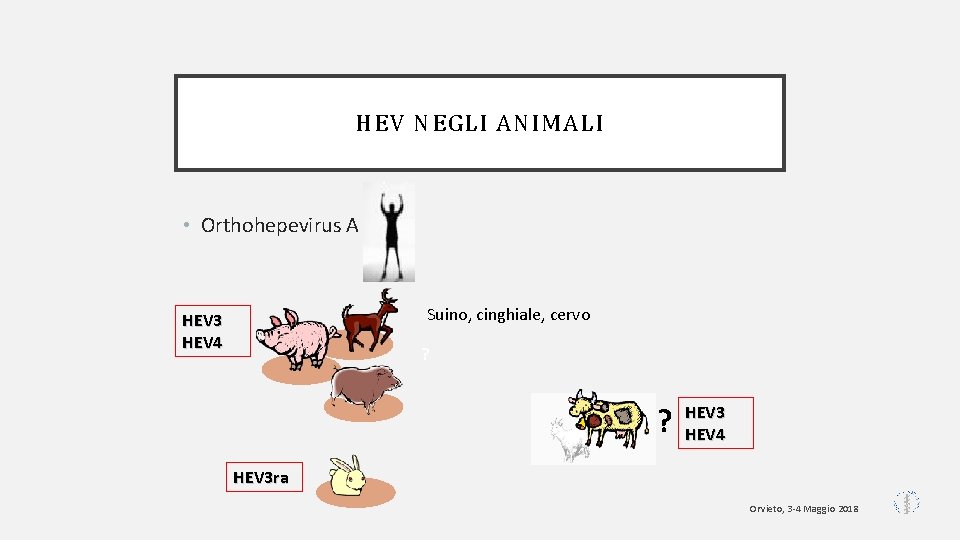
HEV NEGLI ANIMALI • Orthohepevirus A Suino, cinghiale, cervo HEV 3 HEV 4 ? ? HEV 3 HEV 4 HEV 3 ra Orvieto, 3 -4 Maggio 2018

EPATITE NELL’UOMO EUROPA Casi umani registrati in 15 paesi Europei ITALIA notifica obbligatoria (ISS-Rep Epatiti Virali; Sistema Epidemiologico Integrato dell'Epatite Virale Acuta (SEIEVA) ) Modificato da Ricci et al. , 2017 EFSA J. , dati ECDC 2017 Orvieto, 3 -4 Maggio 2018

EPATITE NELL’UOMO ITALIA HEV-1 • 1994 -2009 651 sieri di pazienti 20. 6% positivi per Ig. G e/o Ig. M 71. 6% RNA positivi (Romanò et al. 2011 ) HEV-3 Autoctoni 22/134 Casi secondari 3/134 • 2007 -2010: 43 sieri positivi per HEV Ig. G e/o Ig. M; 17 RNA postivi. 12 HEV-1 e 5 HEV-3 (consumo di maiale o macellato cinghiale) (La rosa et al. , 2011) Orvieto, 3 -4 Maggio 2018

EPATITE NELL’UOMO ITALIA SIEROPREVALENZA • Sieroprevalenza donatori di sangue tra 0. 9%-9. 1% Donatori di sangue-Centro Italia area iperendemica Ig. G anti-HEV 49% (153/313); 3 soggetti positivi per Ig. M (2 HEV 3 RNA positivi) Consumo di salsicce di fegato di maiale fattore di rischio (Lucarelli et al. , 2016) Soggetti esposti (lavoratori del settore suinicolo, veterinari, cacciatori) hanno sieroprevalenze più elevate in Europa • 9. 64% donatori di sangue , 8. 82% veterinari (De sabato et al. , 2016) • 1. 3% popolazione di controllo, 5. 7% lavoratori. Sieroprevalenza nei lavoratori aumenta con la durata di esposizione (Caruso et al. , 2017) • HEV Ig. G 12. 3% lavoratori allevamenti o macelli suini, 0. 9% in popolazione generale, 3% in vegani. Esposizione lavorativa ai suini risulta essere un fattore di rischio (Mughini et al. , 2016) Orvieto, 3 -4 Maggio 2018

HEV: ZOONOSI? • Elevate analogie genetiche tra ceppi virali umani e ceppi suini rinvenuti su uno stesso territorio (anche del 100%) • Dimostrata sperimentalmente la possibilità di trasmissione interspecifica di ceppi umani al suino e di ceppi suini a primati non umani • EVIDENZA DIRETTA • Identificazione stesso ceppo virale nell’uomo e negli alimenti consumati Orvieto, 3 -4 Maggio 2018

CEPPI HEV-3 ITALIA Orvieto, 3 -4 Maggio 2018

CONCLUSIONI § In Europa la via di trasmissione alimentare è la principale § HEV-3 (HEV-4) sono virus zoonotici § Suino e cinghiale (in minor misura i cervi) sono i reservoirs principali dei genotipi zoonotici § HEV identificato in suini in allevamento e al macello (bile, feci, fegato, muscolo ? ) § HEV identificato nel fegato di cinghiali adulti § Esposizione nei soggetti che lavorano a contatto con suini e cinghiali Orvieto, 3 -4 Maggio 2018

Orvieto, 3 -4 Maggio 2018

Orvieto, 3 -4 Maggio 2018

https: //ecdc. europa. eu/sites/portal/files/documents/HEV_Surveillance-report-2005 -2015. pdf Orvieto, 3 -4 Maggio 2018

DATA GAP • Stima dell’infezione nell’uomo (sottostima, percentuale di casi non caratterizzati) • Soggetti a rischio (immunodepressi) • • • Identificazione degli alimenti a maggior rischio Ruolo dell’ambiente (es. acqua d’irrigazione, reflui, molluschi, vegetali) Classificazione Metodi diagnostici (alimenti, quantitativi) Perfezionamento test di infettività (crescita in vitro) • Management dell’infezione (vaccinazione? HEV-free allevamenti? …. ) Orvieto, 3 -4 Maggio 2018

GRAZIE! Dr. Luca De Sabato Dr. ssa Marina Monini Dr. Giovanni Ianiro Edoardo Vignolo Dr. Gabriele Vaccari Dr. Franco Maria Ruggeri Dr. ssa Giorgia Angeloni Dr. ssa Eleonora Ponterio Università di Bologna Prof. Fabio Ostanello Orvieto, 3 -4 Maggio 2018
 Paradigma dominante
Paradigma dominante Desarrollo cognoscitivo en la adultez emergente
Desarrollo cognoscitivo en la adultez emergente Lcag management
Lcag management Emergente eigenschap biologie
Emergente eigenschap biologie Ilaria arosio data di nascita
Ilaria arosio data di nascita Ilaria di matteo
Ilaria di matteo Ilaria giannoccaro
Ilaria giannoccaro Ilaria baiardini
Ilaria baiardini Ilaria fadda
Ilaria fadda Ilaria rizzato unige
Ilaria rizzato unige Ilaria malerba
Ilaria malerba Ilaria panzini
Ilaria panzini Ilaria baiardini
Ilaria baiardini Cuando matias analiza el grafico de una onda
Cuando matias analiza el grafico de una onda Trojanski konj virus
Trojanski konj virus Clasificación de los virus
Clasificación de los virus Virus dermatrópicos ejemplos
Virus dermatrópicos ejemplos Virus cibernetic
Virus cibernetic Veoh tv
Veoh tv Blended threat virus
Blended threat virus Rabies incubation period in humans
Rabies incubation period in humans What is lytta virus
What is lytta virus Poxviridae ailesi
Poxviridae ailesi Mumps virus
Mumps virus Measles and mumps virus
Measles and mumps virus Adware virus informatico
Adware virus informatico Reoviridae classification
Reoviridae classification Como se clasifica los virus
Como se clasifica los virus Características de los pluricelulares
Características de los pluricelulares Pepino mozaïek virus
Pepino mozaïek virus Growth curve of virus
Growth curve of virus Virus cultivation in embryonated eggs
Virus cultivation in embryonated eggs Mcafee anti-virus
Mcafee anti-virus Virus polimorfos o mutantes
Virus polimorfos o mutantes Creeper virus
Creeper virus Contoh peta konsep virus
Contoh peta konsep virus