Vee struktuur ja fsikokeemilised omadused Puhverlahused Vee molekuli














- Slides: 29

Vee struktuur ja füsikokeemilised omadused. Puhverlahused

• • • Vee molekuli struktuur Vesi kui lahusti Vesi reaktsioonikeskkonnana Vee molekuli ionisatsioon Puhvrid. Henderson-Hasselbachi võrrand

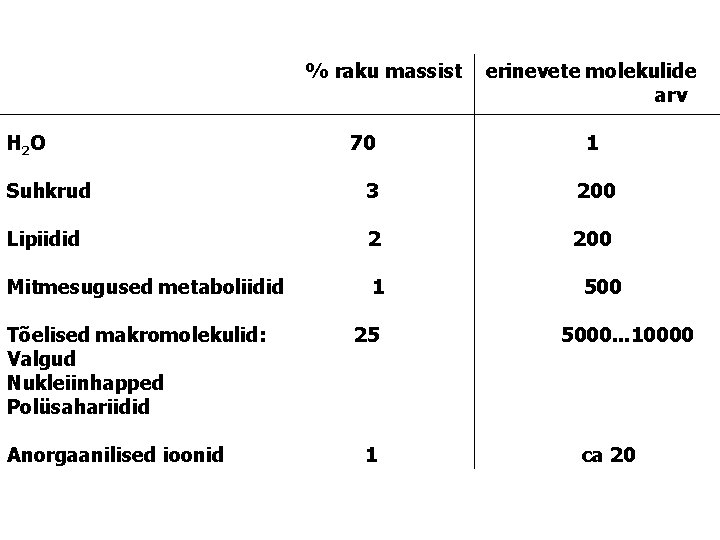
% raku massist H 2 O 70 erinevete molekulide arv 1 Suhkrud 3 200 Lipiidid 2 200 Mitmesugused metaboliidid 1 Tõelised makromolekulid: Valgud Nukleiinhapped Polüsahariidid Anorgaanilised ioonid 25 1 5000. . . 10000 ca 20

Vesi • Solvent bioloogilistes süsteemides • Metaboolsete reaktsioonide toimumise keskkond • Suure mahtuvusega soojuse akumulaator • Transpordiks kasutatav keskkond- veri, lümf, uriin • Vahetu osaleja paljudes biokeemilistes reaktsioonides

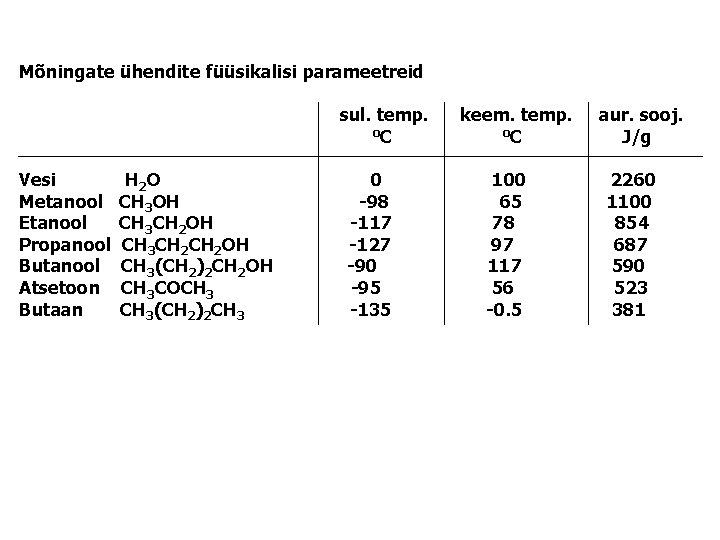
Mõningate ühendite füüsikalisi parameetreid sul. temp. o. C Vesi Metanool Etanool Propanool Butanool Atsetoon Butaan H 2 O CH 3 OH CH 3 CH 2 CH 2 OH CH 3(CH 2)2 CH 2 OH CH 3 COCH 3(CH 2)2 CH 3 0 -98 -117 -127 -90 -95 -135 keem. temp. o. C 100 65 78 97 117 56 -0. 5 aur. sooj. J/g 2260 1100 854 687 590 523 381

Vesi moodustab unikaalse keskkonna bioloogilistele protsessidele • Kõrge sulamis ja keemistemperatuur • Suur aurustumissoojus • Pindpinevus • Kõrge dielektriline konstant • Maksimaalne tihedus vedelas olekus Vesi 100 o. C, metaan -164 o. C Vee liikumine mullas, taimedes Vesi 78. 5 Et. OH 24. 3 Ammoniaak 16. 9 Benseen 2. 3 Vedelik 1. 00, jää 0. 92 g/l

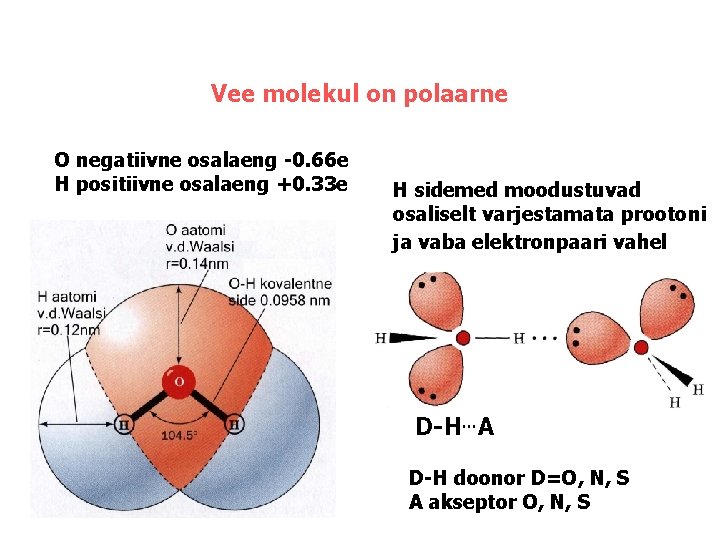
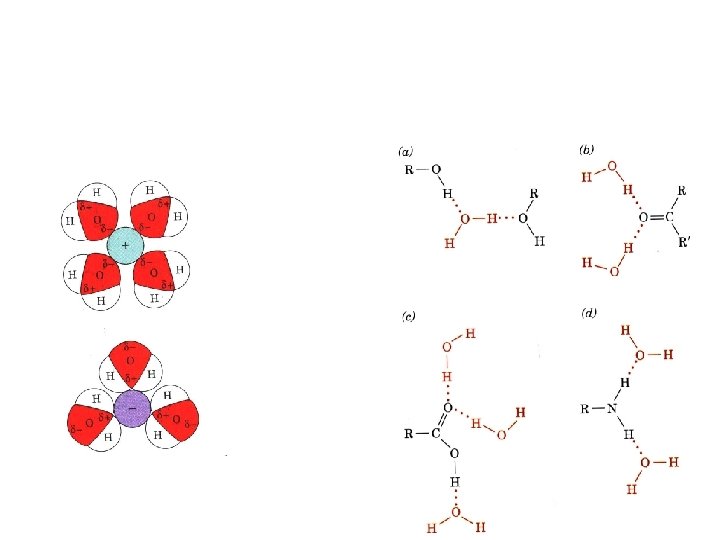
Vee molekul on polaarne O negatiivne osalaeng -0. 66 e H positiivne osalaeng +0. 33 e H sidemed moodustuvad osaliselt varjestamata prootoni ja vaba elektronpaari vahel D-H…A D-H doonor D=O, N, S A akseptor O, N, S

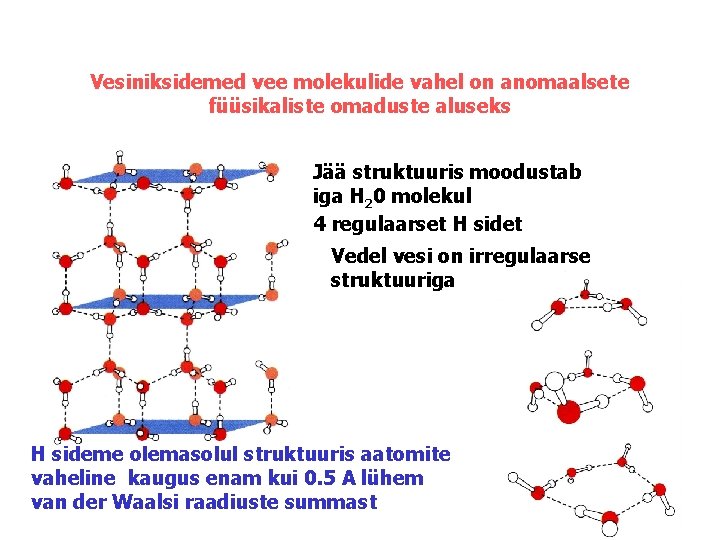
Vesiniksidemed vee molekulide vahel on anomaalsete füüsikaliste omaduste aluseks Jää struktuuris moodustab iga H 20 molekul 4 regulaarset H sidet Vedel vesi on irregulaarse struktuuriga H sideme olemasolul struktuuris aatomite vaheline kaugus enam kui 0. 5 A lühem van der Waalsi raadiuste summast

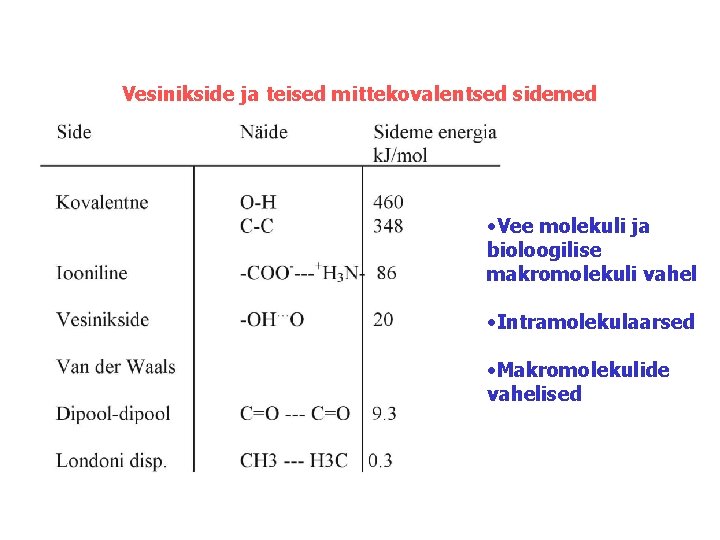
Vesinikside ja teised mittekovalentsed sidemed • Vee molekuli ja bioloogilise makromolekuli vahel • Intramolekulaarsed • Makromolekulide vahelised

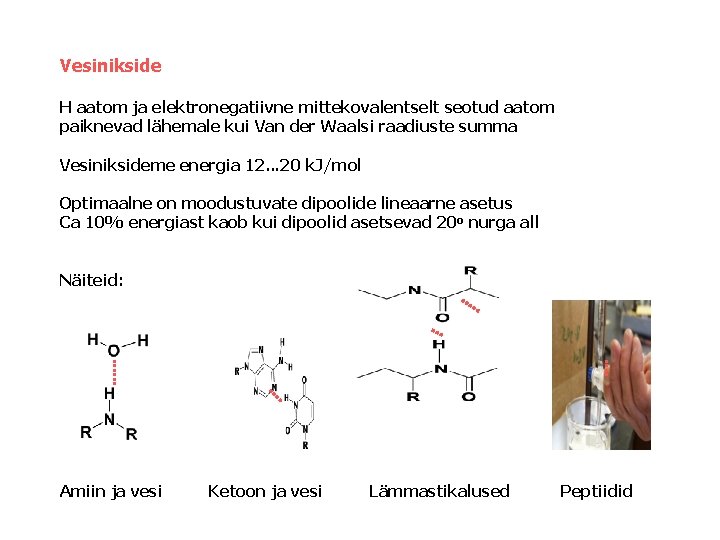
Vesinikside H aatom ja elektronegatiivne mittekovalentselt seotud aatom paiknevad lähemale kui Van der Waalsi raadiuste summa Vesiniksideme energia 12. . . 20 k. J/mol Optimaalne on moodustuvate dipoolide lineaarne asetus Ca 10% energiast kaob kui dipoolid asetsevad 20 o nurga all Näiteid: Amiin ja vesi Ketoon ja vesi Lämmastikalused Peptiidid

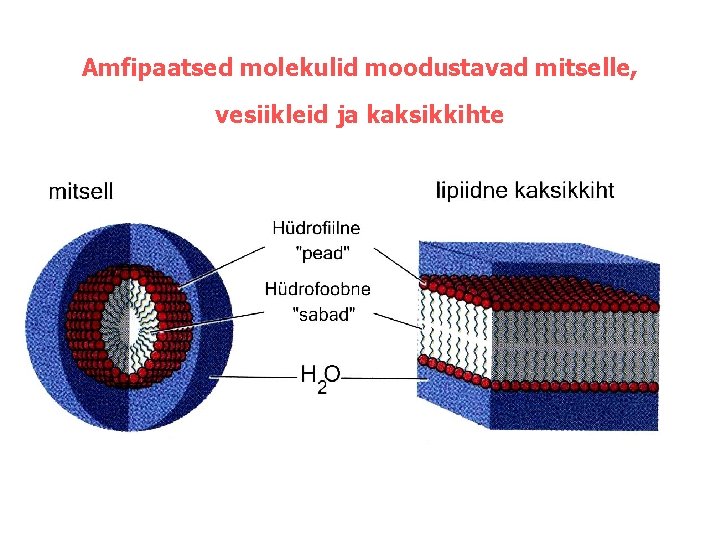
Vesi solvendina Vees lahustuvad ühendid- hüdrofiilsed • polaarsed • ioonilised Hüdrofiilsed molekulid solvateeruvad vees Veel on kõrge ioonide solvatatsiooni võime Na+ 0. 14 M K+ 0. 04 M Cl 0. 10 M Ioonide kontsentratsioon veres Vees mittelahustuvad ühendid- hüdrofoobsed mittepolaarsed Amfipaatsed ehk amfifiilsed-molekulid kus on nii hüdrofiilne kui hüdrofoobne osa Moodustavad mitselle kaksikkihilisi vesiikleid või lehti


Hüdrofoobne efekt • Hüdrofoobsed molekulid asetuvad selliselt, et kokkupuutepind vee molekulidega oleks minimaalne • Entroopiline komponent oluline • Määrav faktor makromolekulide struktuuri moodustumisel ja lipiidide agregatsioonil

Amfipaatsed molekulid moodustavad mitselle, vesiikleid ja kaksikkihte

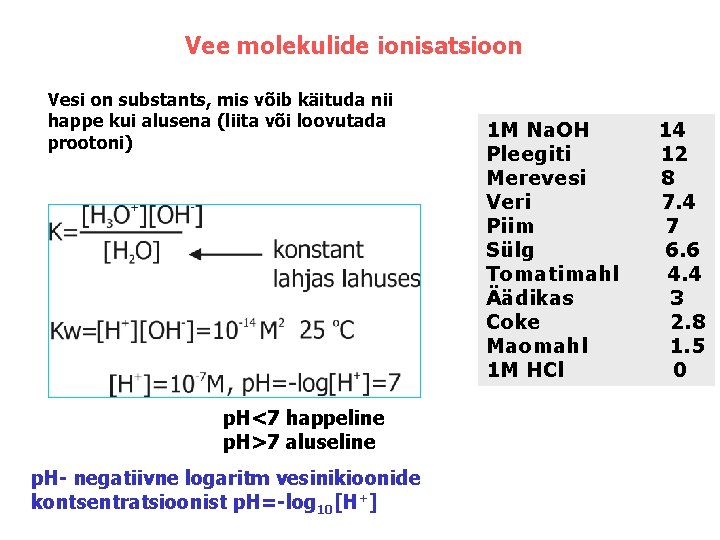
Vee molekulide ionisatsioon Vesi on substants, mis võib käituda nii happe kui alusena (liita või loovutada prootoni) p. H<7 happeline p. H>7 aluseline p. H- negatiivne logaritm vesinikioonide kontsentratsioonist p. H=-log 10[H+] 1 M Na. OH Pleegiti Merevesi Veri Piim Sülg Tomatimahl Äädikas Coke Maomahl 1 M HCl 14 12 8 7. 4 7 6. 6 4. 4 3 2. 8 1. 5 0

Happed- prootoni doonorid alused- prootoni akseptorid 1923 Bronsted ja Lowry Konjugeeritud aluse ja hape vaheline reaktsioon

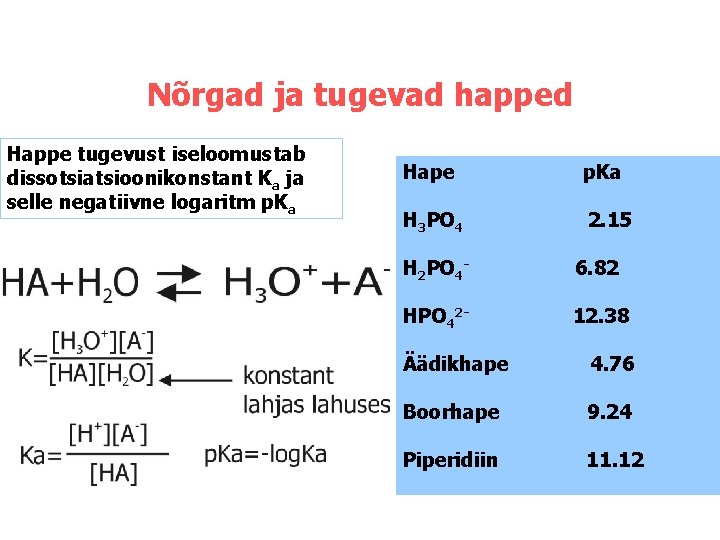
Nõrgad ja tugevad happed Happe tugevust iseloomustab dissotsiatsioonikonstant Ka ja selle negatiivne logaritm p. Ka Hape p. Ka H 3 PO 4 2. 15 H 2 PO 4 - 6. 82 HPO 42 - 12. 38 Äädikhape 4. 76 Boorhape 9. 24 Piperidiin 11. 12

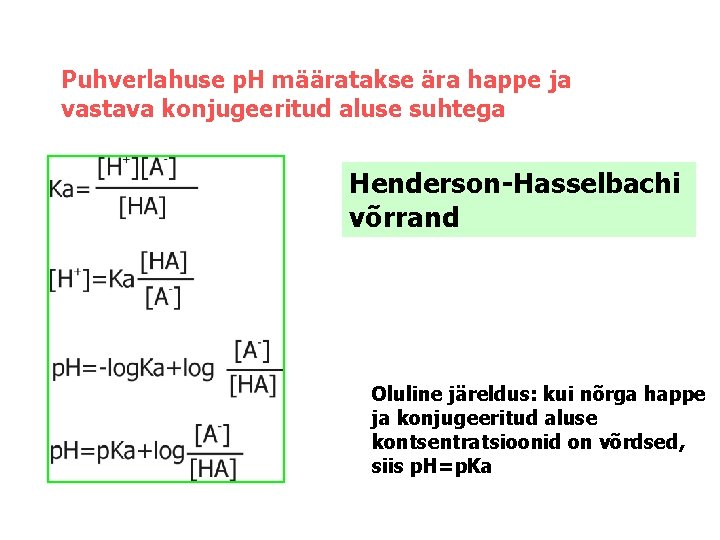
Puhverlahuse p. H määratakse ära happe ja vastava konjugeeritud aluse suhtega Henderson-Hasselbachi võrrand Oluline järeldus: kui nõrga happe ja konjugeeritud aluse kontsentratsioonid on võrdsed, siis p. H=p. Ka

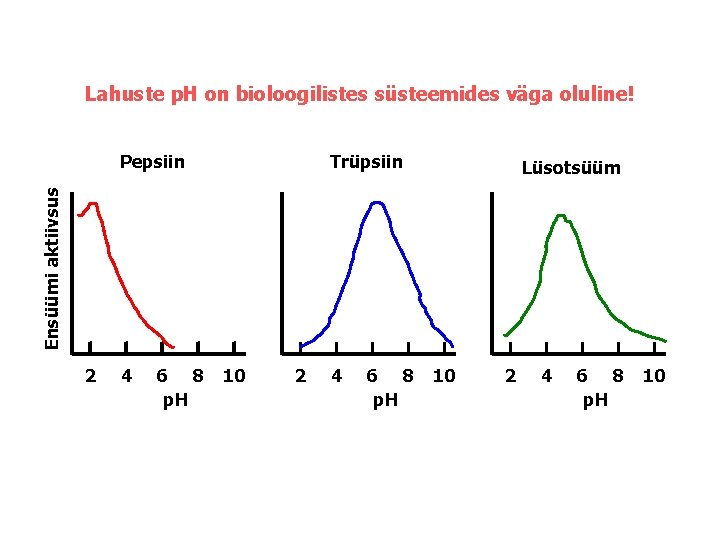
Lahuste p. H on bioloogilistes süsteemides väga oluline! Trüpsiin Lüsotsüüm Ensüümi aktiivsus Pepsiin 2 4 6 8 p. H 10

Tiitrimine Tiitrimiseks nimetatakse analüüsimeetodeid, mis baseeruvad ruumala mõõtmisel Näiteks: lahuses aluse kontsentratsiooni mõõtmine kasutades kindla kontsentratsiooniga happe lahust, või vastupidi Vajalikud töövahendid: kalibreeritud klaasnõud, p. H indikaator või p. Hmeeter

Puhverlahused- stabiliseerivad p. H Tilk 1 M HCl liitrisse vette või 0. 1 M Na. OAc lahusesse! Henderson-Hasselbachi võrrandist tulenevalt ei muutu nõrga happe ja vastava aluse segule tugeva happe lisamisel oluliselt p. H Puhvermahtuvus- Tugeva happe või aluse moolide arv, mis muudab 1 l puhverlahuse p. H 1 ühiku võrra

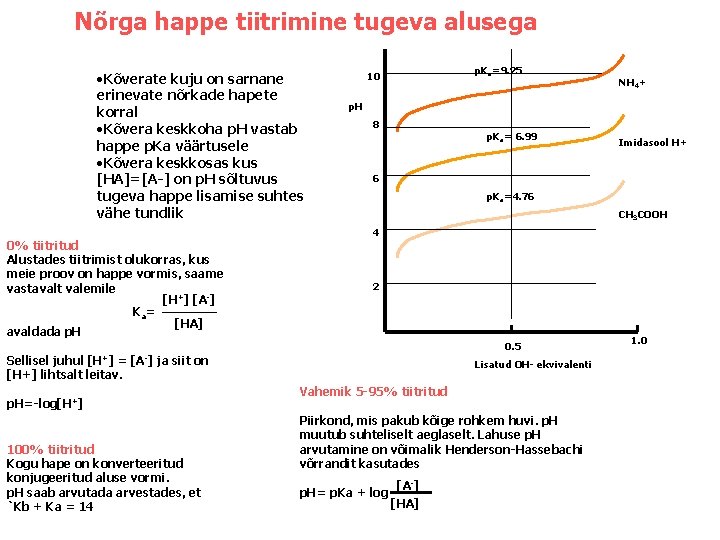
Nõrga happe tiitrimine tugeva alusega • Kõverate kuju on sarnane erinevate nõrkade hapete korral • Kõvera keskkoha p. H vastab happe p. Ka väärtusele • Kõvera keskkosas kus [HA]=[A-] on p. H sõltuvus tugeva happe lisamise suhtes vähe tundlik 0% tiitritud Alustades tiitrimist olukorras, kus meie proov on happe vormis, saame vastavalt valemile [H+] [A-] K a= [HA] avaldada p. H p. Ka=9. 25 10 p. H 8 p. Ka= 6. 99 p. Ka=4. 76 CH 3 COOH 4 2 Sellisel juhul [H+] = [A-] ja siit on [H+] lihtsalt leitav. 100% tiitritud Kogu hape on konverteeritud konjugeeritud aluse vormi. p. H saab arvutada arvestades, et `Kb + Ka = 14 Imidasool H+ 6 0. 5 p. H=-log[H+] NH 4+ Lisatud OH- ekvivalenti Vahemik 5 -95% tiitritud Piirkond, mis pakub kõige rohkem huvi. p. H muutub suhteliselt aeglaselt. Lahuse p. H arvutamine on võimalik Henderson-Hassebachi võrrandit kasutades p. H= p. Ka + log [A-] [HA] 1. 0

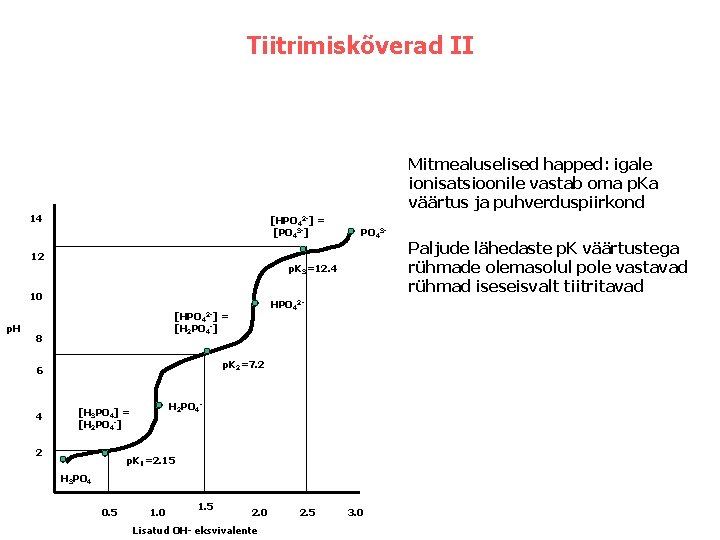
Tiitrimiskõverad II Mitmealuselised happed: igale ionisatsioonile vastab oma p. Ka väärtus ja puhverduspiirkond 14 [HPO 42 -] = [PO 43 -] 12 p. K 3=12. 4 10 p. H HPO 42 - [HPO 42 -] = [H 2 PO 4 -] 8 p. K 2=7. 2 6 4 PO 43 - H 2 PO 4 - [H 3 PO 4] = [H 2 PO 4 -] 2 p. K 1=2. 15 H 3 PO 4 0. 5 1. 0 1. 5 2. 0 Lisatud OH- eksvivalente 2. 5 3. 0 Paljude lähedaste p. K väärtustega rühmade olemasolul pole vastavad rühmad iseseisvalt tiitritavad

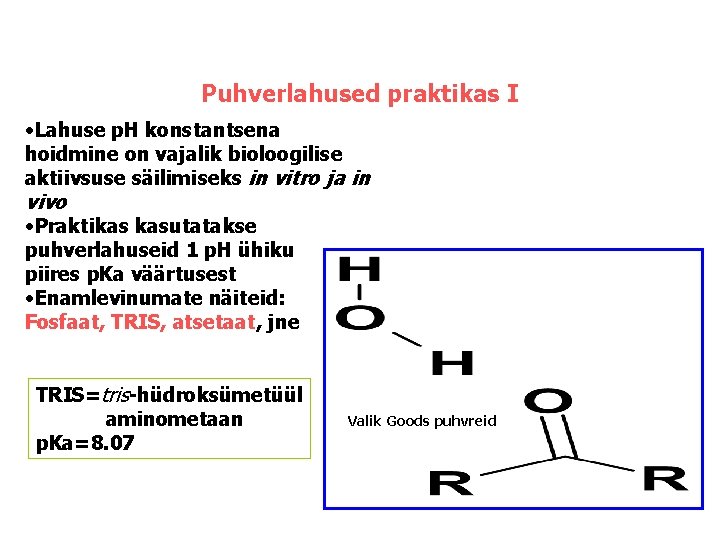
Puhverlahused praktikas I • Lahuse p. H konstantsena hoidmine on vajalik bioloogilise aktiivsuse säilimiseks in vitro ja in vivo • Praktikas kasutatakse puhverlahuseid 1 p. H ühiku piires p. Ka väärtusest • Enamlevinumate näiteid: Fosfaat, TRIS, atsetaat, jne TRIS=tris-hüdroksümetüül aminometaan p. Ka=8. 07 Valik Goods puhvreid

Puhverlahused praktikas II • Fosfaatpuhver on oluline rakusisese p. H konstantsena hoidmisel (p. Ka 2=6. 82) • Histidiini struktuuri kuulub imidasooli rühm (p. Ka=6. 04). Valgud on samuti olulised puhverdavad ühendid organismides • Vereplasma p. H säilitatakse konstantsena bikarbonaatpuhvri abil Hapnik transporditakse veres hemoglobiini poolt, mis paikneb punastes verelibledes CO 2 transpordiks kasutatakse nii vereplasmat kui punaseid vereliblesid CO 2(aq) + 2 H 2 O CO 2(g) H 2 CO 3 H+ + HCO 3 - Füsioloogiline p. H 7. 4 7. 35 … 7. 45 OK! Atsidoos 7. 1 Alkaloos 7. 6

Näide 1: Milline on teatud orgaanilise happe p. Ka, kui 0. 0084 M happe lahuse p. H on 3. 15?

Näide 2: Mitu millimooli HCl tuleb lisada 10 ml 0. 150 M p. H 6. 80 kaaliumtsitraadi puhvrile selleks et puhvri p. H kukuks väärtuseni 6. 50? Sidrunhappe vastav p. Ka 3=6. 39

Näide 3: Millise p. H-ga on puhver, mis saadakse 0. 15 M p. H 6. 87 kaaliumfosfaatpuhvri lahjendamisel destilleeritud veega 0. 035 M lahuseni?

Näide 4: Valmistatakse puhverlahus kasutades 3. 71 g sidrunhapet ja 2. 91 g KOH, mis lahustatakse vees viies lõppruumala 250 ml mahuni. Milline on saadava lahuse p. H ja milline on selles lahuses vesinikioonide kontsentratsioon? Sidrunhappe p. Ka väärtused on 3. 14, 4. 77 ja 6. 39