Vecteurs de Clonage Anne universitaire 20172018 DR OULDJAOUI















- Slides: 38

Vecteurs de Clonage Année universitaire 2017/2018 DR. OULDJAOUI AHMED

A. Définitions ØUn vecteur est une séquence d'ADN permettant la propagation, la sélection, la modification d'une séquence d'ADN d'intérêt. En bref l'étude et la manipulation d'une séquence d'ADN isolée. ØLe clonage est l'action d'isoler et d'insérer dans un vecteur un fragment d'ADN d'intérêt pour le multiplier à l'identique. ØL'ADN génomique est le support physique de l'ensemble des gènes de la cellule. Øl'ADN complémentaire (ADNc) est la copie en ADN des ARNm.

B. Utilité ● Permet de conserver une séquence d'ADN donnée. ● Permet de la multiplier pour en accroître la quantité. ● Permet de la modifier pour y introduire des mutations, délétions. ● Permet de la réintroduire dans des cellules.

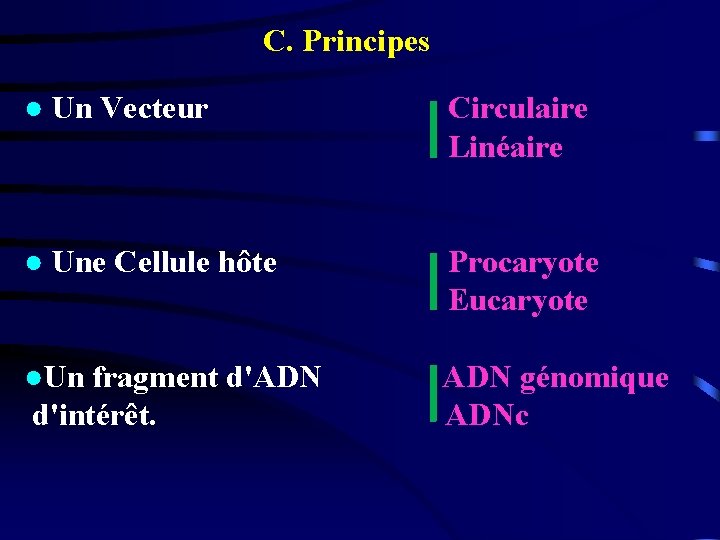
C. Principes ● Un Vecteur Circulaire Linéaire ● Une Cellule hôte Procaryote Eucaryote ●Un fragment d'ADN ADN génomique d'intérêt. ADNc

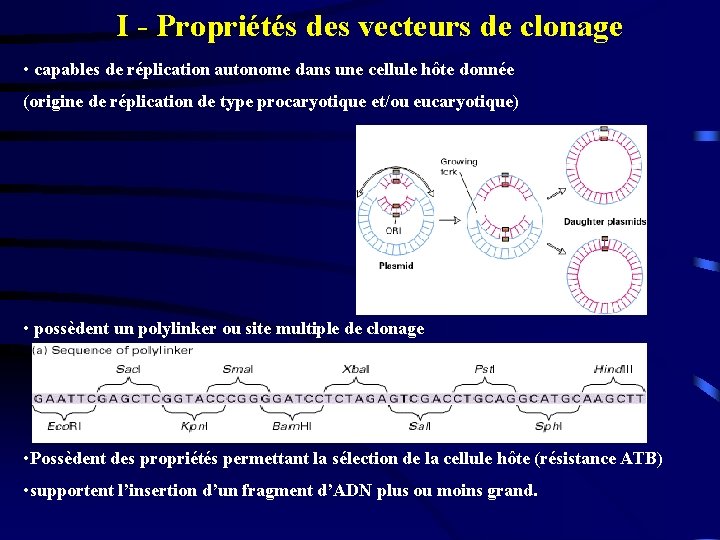
I - Propriétés des vecteurs de clonage • capables de réplication autonome dans une cellule hôte donnée (origine de réplication de type procaryotique et/ou eucaryotique) • possèdent un polylinker ou site multiple de clonage • Possèdent des propriétés permettant la sélection de la cellule hôte (résistance ATB) • supportent l’insertion d’un fragment d’ADN plus ou moins grand.

II – Principes généraux d’utilisation d’un vecteur - Préparation du vecteur - Préparation de l’ADN à insérer - Réalisation d’un recombinant - Incorporation à l’hôte

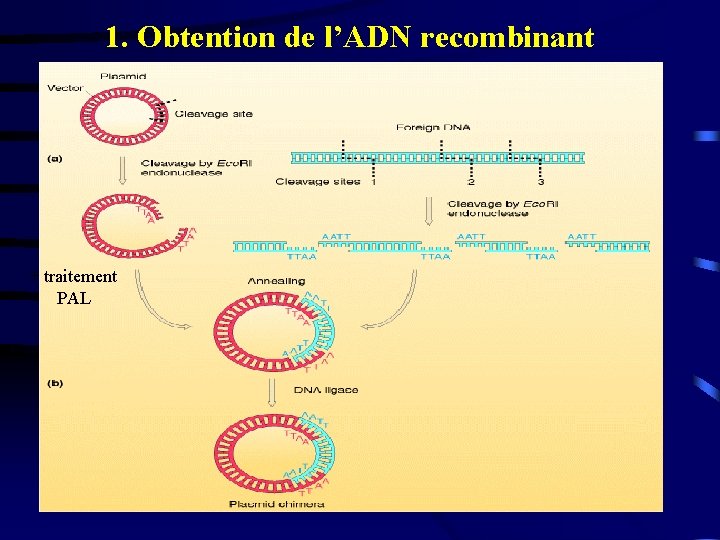
1. Obtention de l’ADN recombinant + traitement PAL

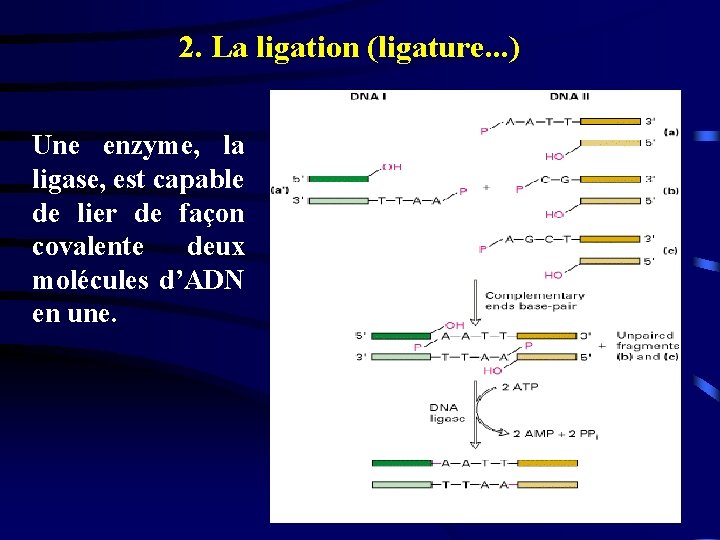
2. La ligation (ligature. . . ) Une enzyme, la ligase, est capable de lier de façon covalente deux molécules d’ADN en une.

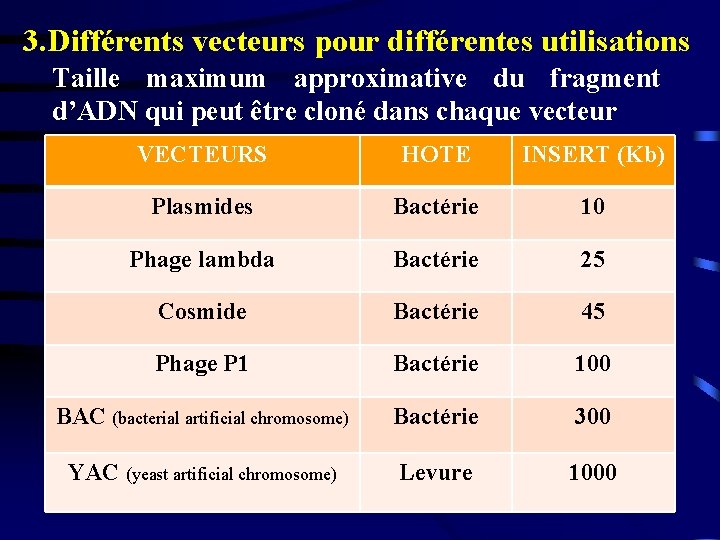
3. Différents vecteurs pour différentes utilisations Taille maximum approximative du fragment d’ADN qui peut être cloné dans chaque vecteur VECTEURS HOTE INSERT (Kb) Plasmides Bactérie 10 Phage lambda Bactérie 25 Cosmide Bactérie 45 Phage P 1 Bactérie 100 BAC (bacterial artificial chromosome) Bactérie 300 YAC (yeast artificial chromosome) Levure 1000

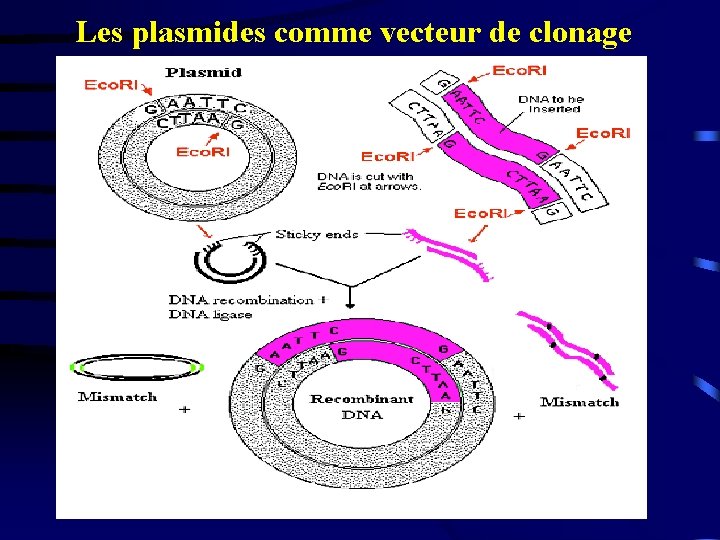
4. Les plasmides comme vecteurs de clonage ØMolécule d’ADN de taille réduite, d'origine bactérienne ØMolécule d’ADN circulaire – taille 2 kb à 5 kb ØPeut accepter jusqu’à 10 kb d’ADN exogène ØPeut être considérée comme un minichromosome capable de réplication autonome ØConfère la résistance à un ou plusieurs antibiotiques= sélection

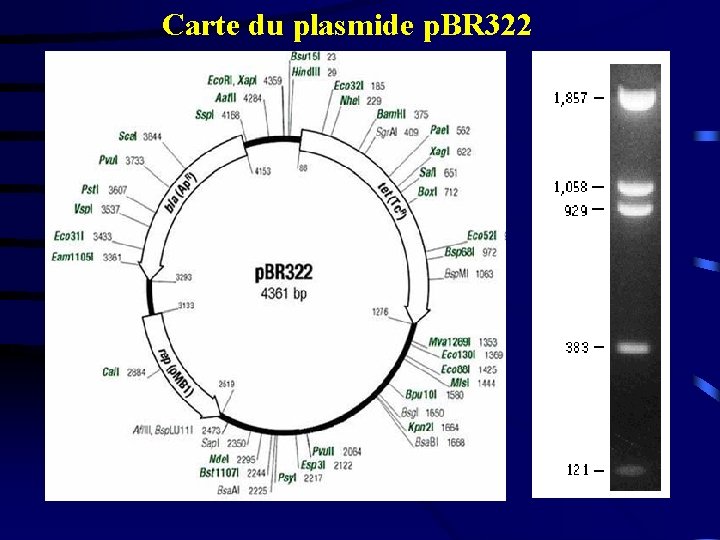
5. Les classes de plasmides 5. 1. Les plasmides de première génération : Ce sont les premiers à avoir été utilisés en génie génétique. Ce sont des plasmides à l’état naturel, non modifiés au laboratoire. Il s’agit des plasmides suivants : • Col. E 1 • RSF 2124 • p. SC 101 5. 2. Les plasmides de deuxième génération : Ce ne sont pas des plasmides naturels mais résultent de plusieurs transformations : plasmides "artificiels". La série la plus importante de ces plasmides est la série p. BR 312 à p. BR 322. Le plasmide p. BR 322 est constitué de 4, 4 Kb et possède deux gènes de résistance : un pour la tétracycline (Tc. R), l’autre pour l’amplicilline (Ap. R). il possède, en plus, 20 sites uniques pour les endonucléases de restriction dont 11 localisés sur les deux gènes de résistance.

Carte du plasmide p. BR 322

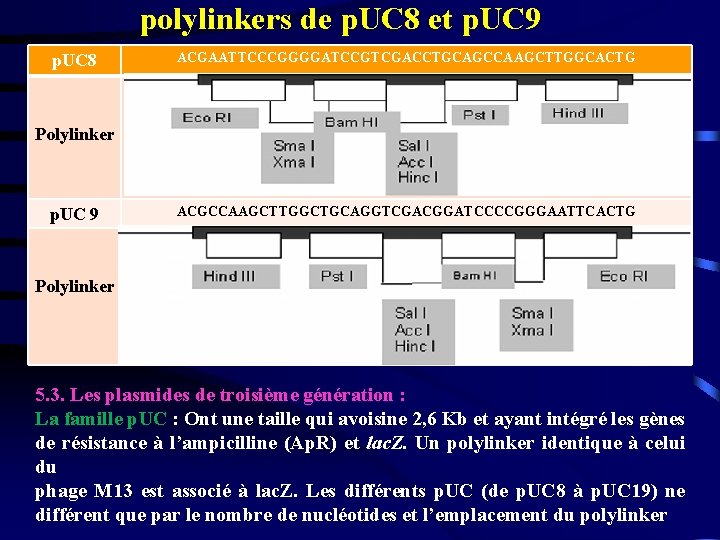
polylinkers de p. UC 8 et p. UC 9 p. UC 8 ACGAATTCCCGGGGATCCGTCGACCTGCAGCCAAGCTTGGCACTG Polylinker p. UC 9 ACGCCAAGCTTGGCTGCAGGTCGACGGATCCCCGGGAATTCACTG Polylinker 5. 3. Les plasmides de troisième génération : La famille p. UC : Ont une taille qui avoisine 2, 6 Kb et ayant intégré les gènes de résistance à l’ampicilline (Ap. R) et lac. Z. Un polylinker identique à celui du phage M 13 est associé à lac. Z. Les différents p. UC (de p. UC 8 à p. UC 19) ne différent que par le nombre de nucléotides et l’emplacement du polylinker

Les plasmides comme vecteur de clonage

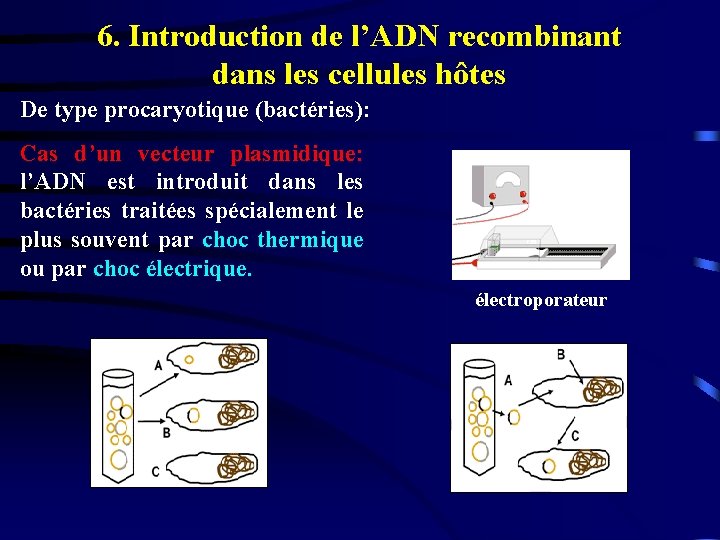
6. Introduction de l’ADN recombinant dans les cellules hôtes De type procaryotique (bactéries): Cas d’un vecteur plasmidique: l’ADN est introduit dans les bactéries traitées spécialement le plus souvent par choc thermique ou par choc électrique. électroporateur

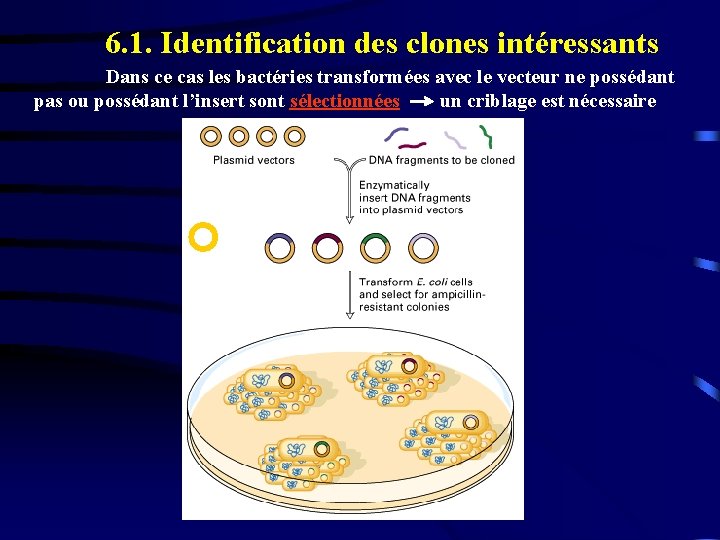
6. 1. Identification des clones intéressants Dans ce cas les bactéries transformées avec le vecteur ne possédant pas ou possédant l’insert sont sélectionnées un criblage est nécessaire

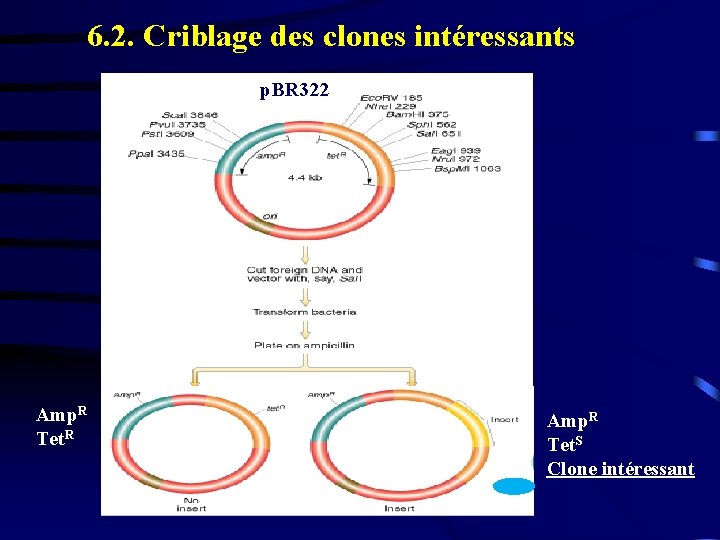
6. 2. Criblage des clones intéressants p. BR 322 Amp. R Tet. R Amp. R Tet. S Clone intéressant

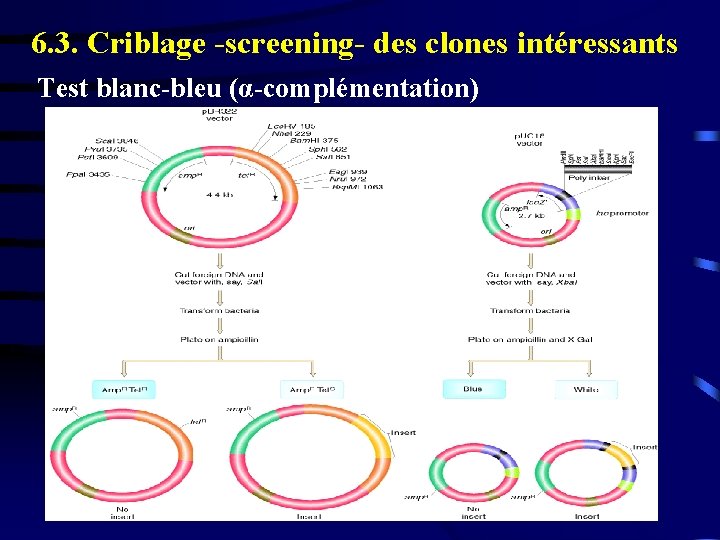
6. 3. Criblage -screening- des clones intéressants Test blanc-bleu (α-complémentation)

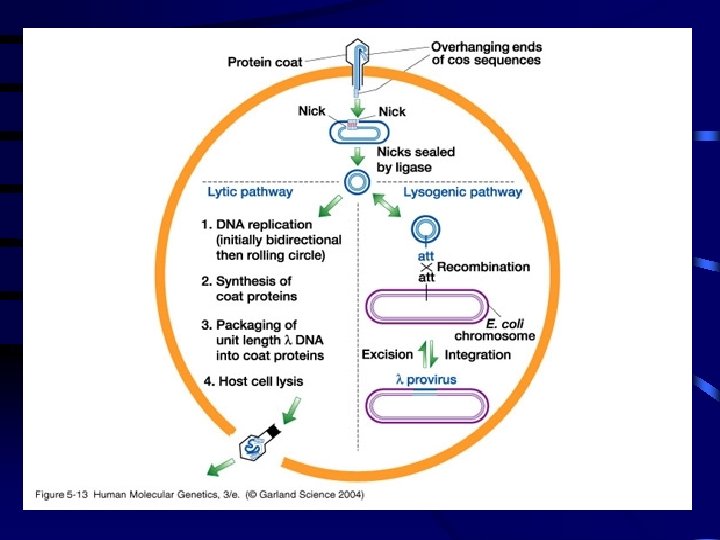
LES PHAGES Virus de bactérie-infectieux : Rendement +++ • λ : 48 Kb • Les phages et les bactéries hôtes sont généralement mutées pour éviter le cycle de Lysogénie au profit du cycle lytique. • Grande partie non essentielle VECTEURS 2 Types : • Insertion (λ zap, gt CHARON c. DNA Faible capacité ≤ 10 Kb • Délétion : substitution • (Charon, EMBL, DASH, FIX…) Partie non essentielle « stuffer » est délétée et remplacée : ≤ 25 Kb • Sélection spi.

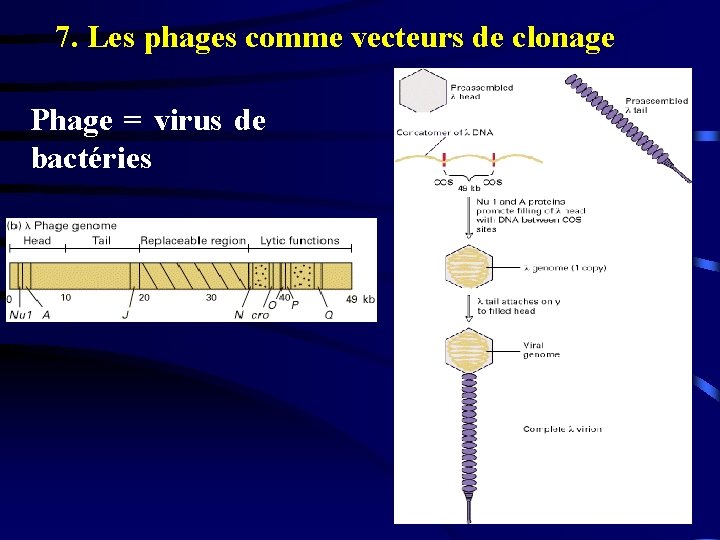
7. Les phages comme vecteurs de clonage Phage = virus de bactéries


7. 1. Introduction de l’ADN recombinant dans les cellules hôtes De type procaryotique: Cas d’un vecteur phagique

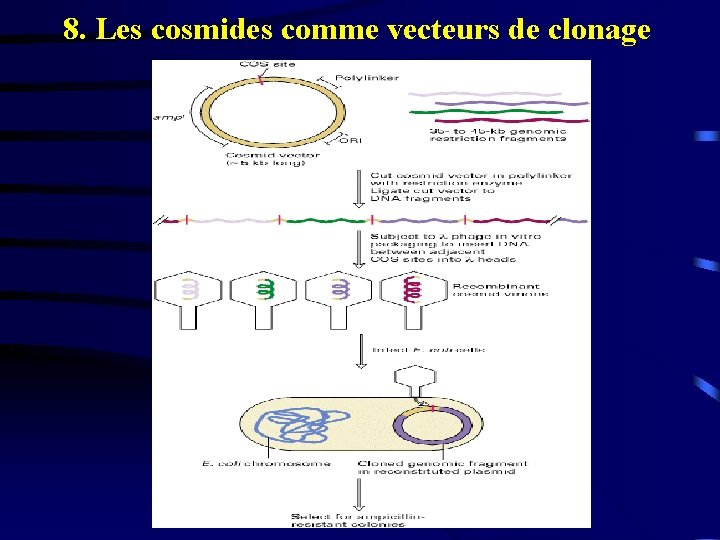
8. Les cosmides comme vecteurs de clonage

9. Bacterial Artificial Chromosomes BAC 7. 4 kb ● Avantages : – Grande capacité d'insertion – Facilité de manipulation (comme plasmide) – Hôte bactérien – Copie unique – Pas (peu) de réarrangement ● par. A, par. B and rep. E sont des gènes requis pour la stabilité du BAC. ● Ori. S est une origine de réplication ● CM : gène de résistance au chloramphénicol

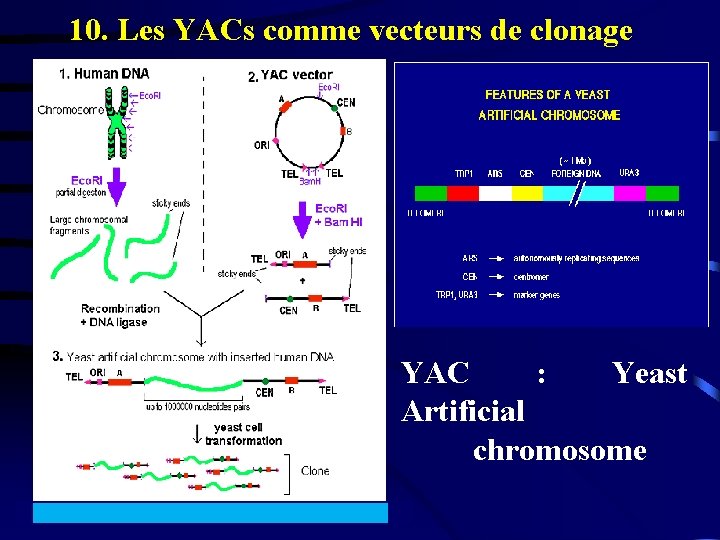
10. Les YACs comme vecteurs de clonage YAC : Yeast Artificial chromosome

III - APPLICATIONS DES VECTEURS - Clonage et amplification d’une séquence d’ADN - Création des banques d’ADN génomiques et d’ADNc - Introduction d’un gène dans des cellules, des plantes ou des organismes (animaux transgéniques) - Production d’ARN - Production de protéines codées par les gènes insérés

Banques d’ADN -Banques d’ADN génomique - Banques de c. DNA

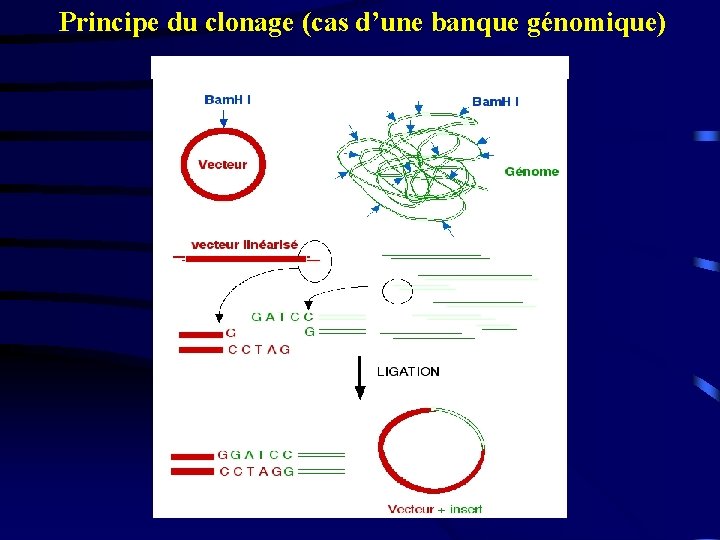
Principe du clonage (cas d’une banque génomique)

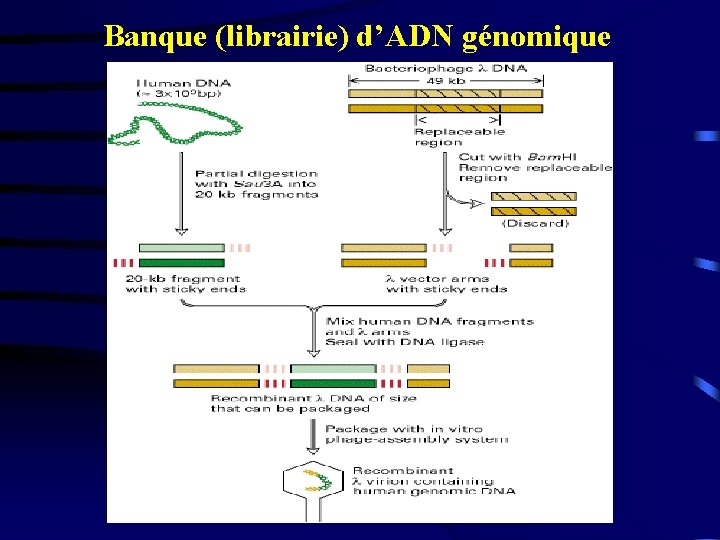
Banque (librairie) d’ADN génomique

Comment définir si une banque est suffisamment grande pour espérer trouver un fragment d’intérêt? Calcul afin de définir la probabilité de trouver une séquence donnée dans une banque. N=In(1 -P)/In(1 -f) N: nombre de recombinants P: probabilité désirée f: proportion de génome dans un seul recombinant Ex: 99% de probabilité d’avoir une séquence représentée dans une banque de fragments de 17 kb d’un génome eucaryote (3. 109 pb) N= In(1 -0. 99)/In(1 -(1, 7. 104/3. 109))=8, 1. 105 colonies

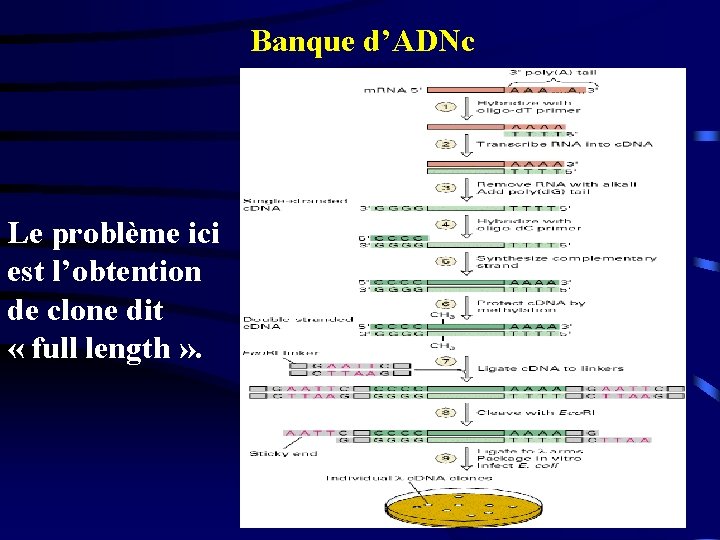
Banque d’ADNc Le problème ici est l’obtention de clone dit « full length » .

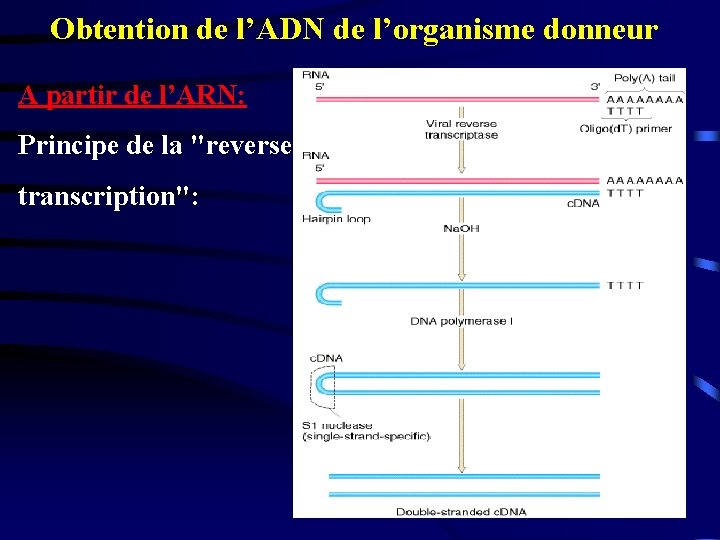
Obtention de l’ADN de l’organisme donneur A partir de l’ARN: Principe de la "reverse transcription":

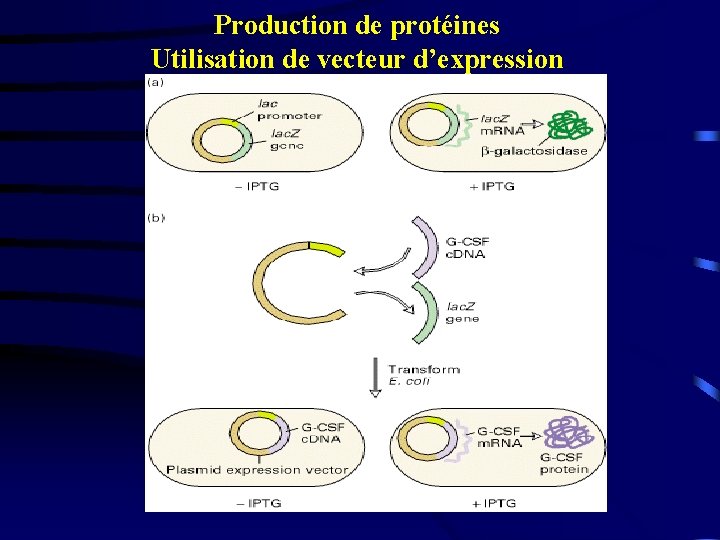
Production de protéines Utilisation de vecteur d’expression

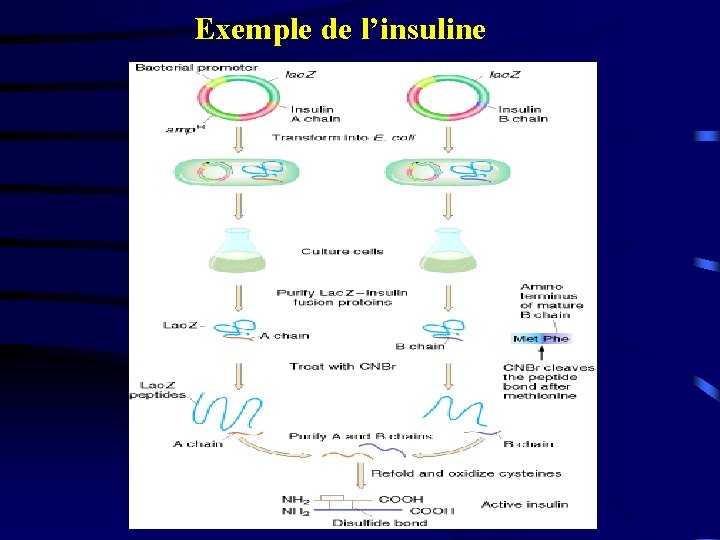
Production de protéines humaines à but thérapeutique - Facteur VIII de la coagulation dans l’hémophilie A - Hormone de croissance - Insuline

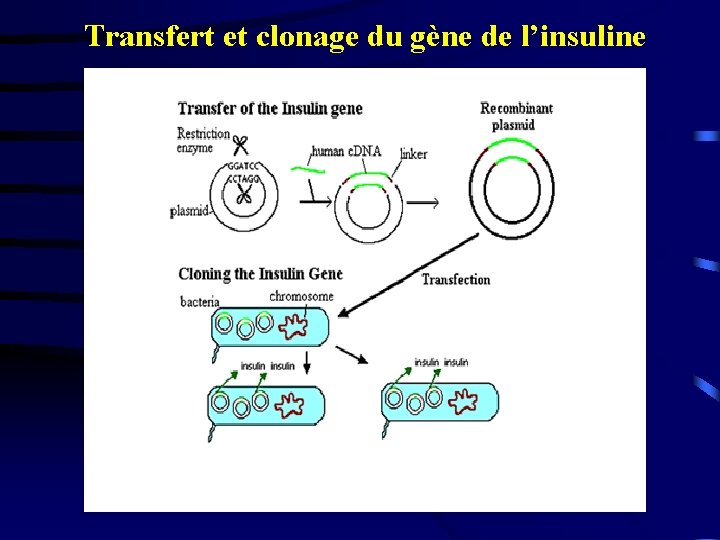
Exemple de l’insuline

CELLULES HÔTES -Bactéries : E. Coli premier hôte utilisé nombreux vecteurs plasmidiques connus et utilisables culture en masse dans les fermenteurs taux d’expression élevés (plusieurs g de protéine/litre) MAIS secrètent mal les protéines : éclatement des bactéries -pas de modifications post-traductionnelles -Levure saccharomyces cerevisiae modifications post traductionnelles MAIS pas de secrétion, moins bon rendement -Cellules CHO (chinese hamster ovary) culture de masse en bioréacteurs, protéines complexes MAIS cher et rendement plus faible

Transfert et clonage du gène de l’insuline

MERCI POUR VOTRE ATTENTION