Va cac em hoc sinh AN MON KIM












- Slides: 14

Vaø caùc em hoïc sinh à

Ï AÊN MOØN KIM LOAÏI

SÖÏ AÊN MOØN KIM LOAÏI I. Giôùi thieäu II. Phaân loaïi III. Choáng aên moøn kim loaïi

I. GIÔÙI THIEÄU • AÊn moøn kim loaïi laø hieän töôïng phaù huyû kim loaïi bôõi caùc chaát ôû moâi tröôøng xung quanh, trong ñoù nguyeân töû kim loaïi bò oxy hoaù thaønh ion döông kim loaïi. Sau khi bò oxy hoaù, kim loaïi bò phaù huyû cô caáu laøm cho kim loaïi maát tính naêng ban ñaàu cuûa noù.

II. PHA N LOAÏI 1. AÊn moøn hoùa hoïc : Söï oxy hoaù kim loaïi do tröïc tieáp moät chaát khaùc ôû moâi tröôøng xung quanh taùc ñoäng leân kim loaïi maø khoâng phaùt sinh doøng ñieän. Ví duï: OÁng thoaùt khoùi xe honda laâu ngaøy bò seùt ræ töø trong ra. ÔÛ nhieät ñoä cao hôi nöôùc thoaùt ra keát hôïp vôùi oxy khoâng khí laøm cho saét beân trong bò oxy hoaù thaønh gæ saét. (gæ saét)

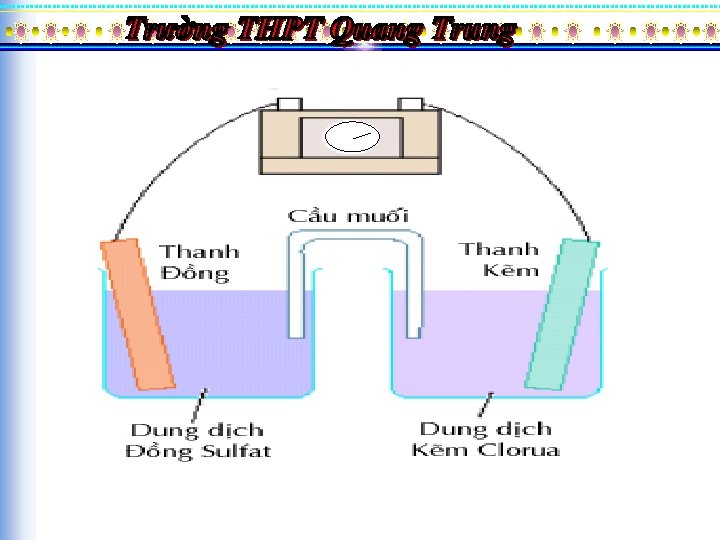
2. AÊn moøn ñieän hoùa: söï oxy hoaù kim loaïi coù phaùt sinh doøng ñieän. a. Thí nghieäm veà söï aên moøn ñieän hoùa



• Trong thí nghieäm treân ñaây, treân beà maët cuûa baûn kim loaïi keõm coù söï oxy hoaù keõm: - 2 e Zn 2+ Zn • Treân beà maët cuûa baûn kim loaïi ñoàng coù söï khöû: Cu 2+ + 2 e Cu • Nhö vaäy caùc electron ñaõ di chuyeån töø keõm theo daây daãn ñeán ñoàng ñeå khöû Cu 2+

• b. Cô cheá cuûa quaù trình ñieän hoaù: ØTreân beà maët cuûa baûn kim loaïi hoaït ñoäng hôn coù söï oxy hoaù kim loaïi thaønh ion döông kim loaïi, baûn cöïc naøy ñöôïc goïi laø anod(cöïc aâm) ØTreân beà maët cuûa baûn kim loaïi keùm hoaït ñoäng hôn coù söï khöû, ôû ñoù ion H+ hoaëc nöôùc bò khöû thaønh H 2 hoaëc OH-, baûn cöïc naøy ñöôïc goïi laø catod(cöïc döông)

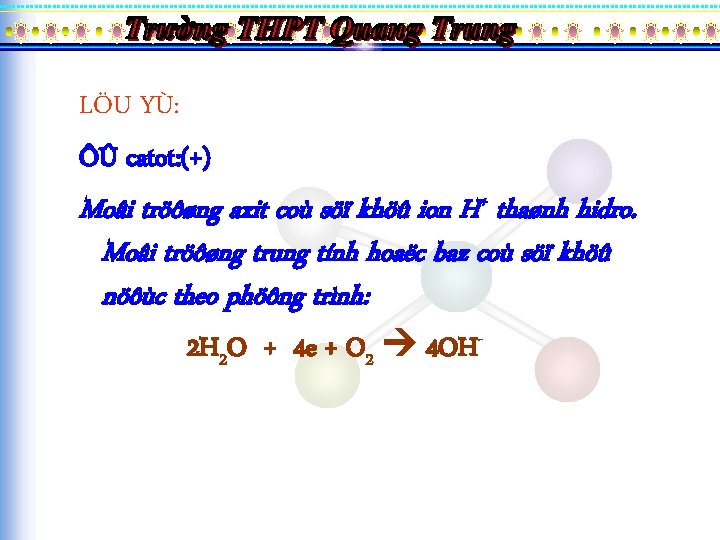
LÖU YÙ: ÔÛ catot: (+) Moâi tröôøng axit coù söï khöû ion H+ thaønh hidro. Moâi tröôøng trung tính hoaëc baz coù söï khöû nöôùc theo phöông trình: 2 H 2 O + 4 e + O 2 4 OH-

• c. Ñieàu kieän ñeå hieän töôïng aên moøn ñieän hoaù xaûy ra: – Baûn chaát hai ñieän cöïc phaûi khaùc nhau. – Hai ñieän cöïc phaûi cuøng tieáp xuùc vôùi moâi tröôøng chaát ñieän ly. – Hai ñieän cöïc phaûi tieáp xuùc tröïc tieáp hoaëc giaùn tieáp vôùi nhau. Ví duï: Thaân taøu bieån bò aên moøn trong nöôùc bieån.

Cô cheá cuûa söï aên moøn thaân taøu bieån. • Thaân taøu bieån laøm baèng theùp, trong ñoù than chì ñoùng vai troø moät catod, saét ñoùng vai troø moät anod, nöôùc bieån laø moâi tröôøng chaát ñieän ly trung tính, thaân taøu bieån bò aên moøn theo kieåu ñieän hoaù: • Anod(-): Fe - 2 e Fe 2+ • Catod(+): H 2 O + 2 e + 1/2 O 2 2 OH • 2 Fe(OH)2+1/2 O 2+ H 2 O 2 Fe(OH)3
