UVVIS UV 200 400 nm VIS 400 800















- Slides: 19

UV/VIS UV: 200 – 400 nm VIS: 400 – 800 nm UV/VIS spektra oppstår som følge av lys-energien absorberes og gir elektroniske overganger mellom forskjellige elektroniske energinivåer i molekylet.

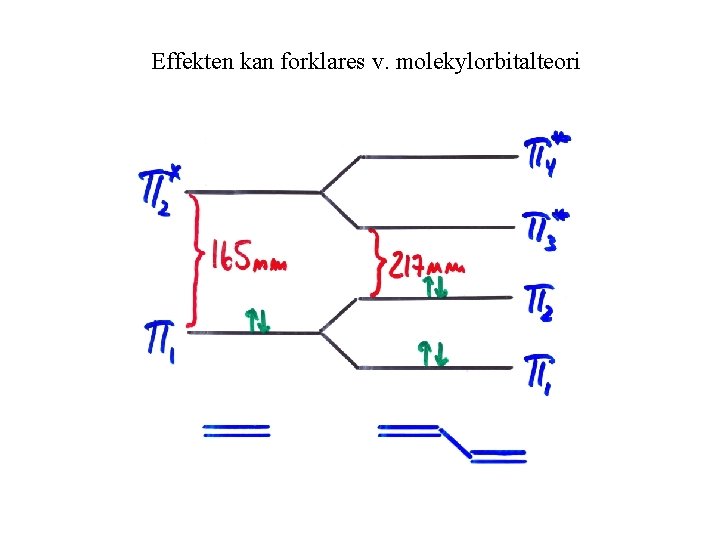
UV–energien er kvantisert og man skulle forvente et linjespekter, men: Siden hvert elektroniske energinivå har mange vibrasjons-og rotasjonsenerginvåer får vi ikke et linje spektrum, men brede absorbsjonsbånd. I organiske molekyler skjer de mest vanlige elektroniske overganger mellom en okkupert bindende orbital (σ, π ) eller ikke bindende n (p) orbital og en tom anti-bindende orbital (σ* eller π*).

Elektronisk overgang for ett elektron fra π til π* i eten ved bølgelengde 165 nm

Absorbans For en gitt frekvens absorberer en prøve etter Lamberts. Beers lov : A = Log I 0/I = εlc A = absorbans I 0 = utsendt lysstyrke fra lyskilde I = detektert lysstyrke ε = molar absorbsjon (ekstingsjonskoeffisient) l = veilengde (standard 1 cm) c = konsentrasjon (standard 1 M)

Ved å plotte bølgelengde mot ε får man et UV-spektrum. En ”blank” prøve uten stoff brukes som referanse.

εmax > 10. 000 : høy intensites absorpsjon εmax < 1000 : lav intensitets absorpsjon εmax < 100 : ”forbudte” overganger

Valg av løsningsmiddel 1. Løselighet 2. Gjennomsiktighet

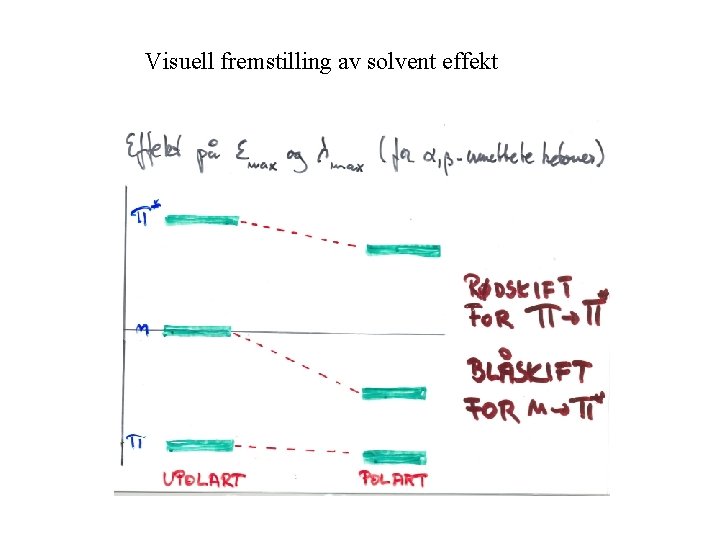
Løsningmiddel effekter (for α, β-umettede ketoner) π til π*: Fleste overganger leder til en eksitert tilstand som er mer polar enn grunntilstanden. Dipol-dipol interaksjoner med solventet vil derfor senke energien til den eksiterte tilstanden mer enn grunntilstanden. Polare solventer vil gi et rødt skift. n til π*: solventet kan i mindre grad hydrogen binde til karbonyl gruppen i eksitert tilstand sammenlignet med grunn tilstanden. Polar solventer vil gi et blått skift.

Visuell fremstilling av solvent effekt

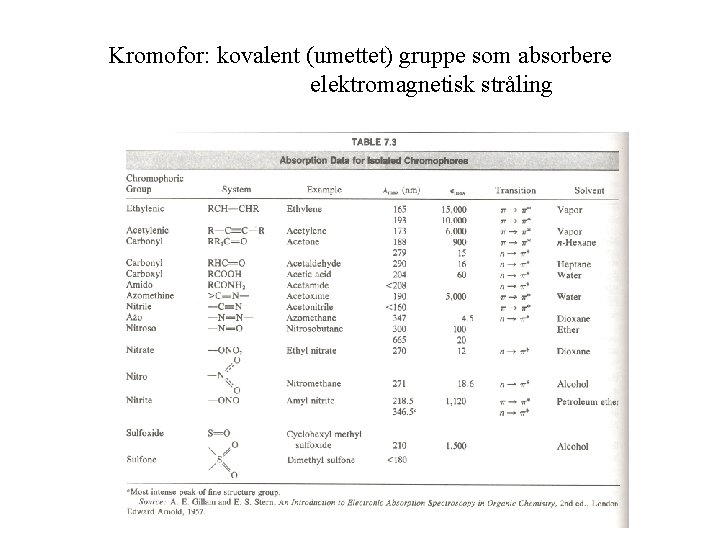
Kromofor: kovalent (umettet) gruppe som absorbere elektromagnetisk stråling

Definisjoner λmax : bølgelengden ved maksimum absorpsjon εmax : molar absorbsjon ved λmax Rødt skift: skifte av λmax til lengre bølgelengde Blått skift: skifte av λmax til kortere bølgelengde Auxochrome: Substituent på en chromophore som gir rødt skift Hypochromic effekt: reduksjon i absorbsjonsintensitet Hyperchromic effekt: En økning i absorbsjonsintensitet

Effekt av økende konjugasjon Polyener: λmax og εmax øker med økende lengde av konjugasjon

Effekten kan forklares v. molekylorbitalteori

Additivitetsregler Det viser seg at det er mulig å forutsi λmax ganske nøyaktig for mange kromofor-systemer vha empiriske additivitetsregler: Konjugerte diener, substituerte bensener, α, βumettede ketoner, aldehyder, syrer, ester, nitriler, amider.

Additivitetesregler (diener)

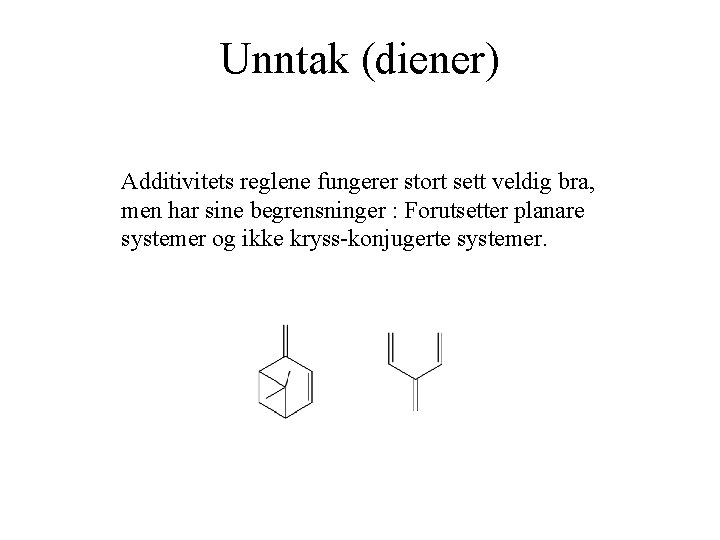
Unntak (diener) Additivitets reglene fungerer stort sett veldig bra, men har sine begrensninger : Forutsetter planare systemer og ikke kryss-konjugerte systemer.

Umettede ketoner og aldehyder

Bensen ringer

 800+200+400
800+200+400 100 200 300 400 500 600 700 800 900
100 200 300 400 500 600 700 800 900 200+200+300
200+200+300 Vis a vis
Vis a vis Terza declinazione primo gruppo neutro
Terza declinazione primo gruppo neutro Vis a vis unai
Vis a vis unai Catalog poem example
Catalog poem example What is a dramatic poem
What is a dramatic poem 800+600+400
800+600+400 Linjespekter
Linjespekter 800 pixels wide and 200 pixels tall pictures
800 pixels wide and 200 pixels tall pictures 100 200 300 400
100 200 300 400 200 300 400
200 300 400 100+200+300+400
100+200+300+400 100 200 300 400 500
100 200 300 400 500 200/400 meter training program
200/400 meter training program 200 300 400
200 300 400 400, 200, 100, 50, 25,
400, 200, 100, 50, 25, 100 200 300 400
100 200 300 400 200+200+100
200+200+100