UNSUR RADIOAKTIF Oleh M Nurissalam S Si SMA






















- Slides: 37

UNSUR RADIOAKTIF Oleh: M. Nurissalam, S. Si SMA Muhammadiyah I Metro Unsur Radioaktif adalah unsur yang dapat memancarkan radiasi secara spontan. Radiasi adalah sejenis sinar tetapi memiliki energi yang besar dan daya tembus yang tinggi. Radiasi yang dipancarkan zat radioaktif terdiri dari 3 jenis partikel: • Sinar alfa 2 • Sinar beta -1 4 0 • Sinar gama 0 0 +

NOTASI DAN SIMBOL PARTIKEL INTI Partikel Simbol Proton p atau H Netron n 1 n 0 0 e atau 0 atau 0 e -1 -1 -1 2 +2 Elektron/ Sinar beta Sinar alfa atau He Sinar gama Notasi 1 atau p 1 4 1 H 1 atau 2 He 4 0 0 Muatan +1 0

KESETABILAN INTI Mengapa atom bersifat radioaktif ? Atom bersifat radioaktif karena intinya tidak stabil, sehingga mudah meluruh/pecah yang disertai pemancaran radiasi. Proton (+) Netron (o) Mengapa proton sebagai penyusun inti tidak saling tolak menolak/ dapat menyatu ?

Ada 3 Pendekatan tentang kesetabilan inti Atom 1. Pita kesetabilan. Diidentifikasi perbandingan n/p isotop-isotop yang terdapat di alam. Contoh Isotop 6 C 12 memiliki n=6 dan p= 6 maka n/p = 1 Isotop 11 Na 23 memiliki n= 12 dan p=11 maka n/p=12/11 = 1, 09. Isotop 20 Ca 40 mempunyai n=20 dan p=20 maka n/p=1 Dari perhitungan diatas maka diperoleh diagram berikut yang disebut diagram pita kesetabilan.

Catatan: 1. Isotop yang stabil adalah isotop yang memiliki n/p berada pita kesetabilan. n/p isotop stabil 2. Isotop dengan No atom lebih dari 82 semua radio aktif. 3. Ada 3 kelompok isotop tidak stabil; a. Di atas pita kestabilan. b. Di bawah pita kestabilan c. Atom berat dengan No > 82 82

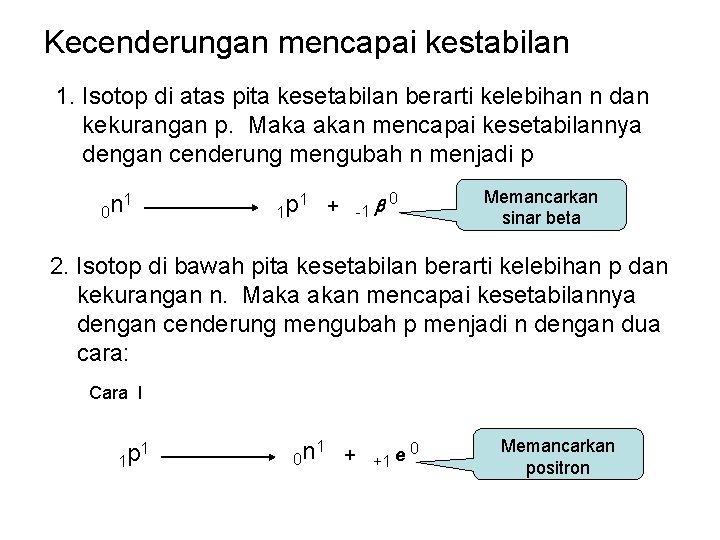
Kecenderungan mencapai kestabilan 1. Isotop di atas pita kesetabilan berarti kelebihan n dan kekurangan p. Maka akan mencapai kesetabilannya dengan cenderung mengubah n menjadi p 1 0 n + -1 0 1 1 p Memancarkan sinar beta 2. Isotop di bawah pita kesetabilan berarti kelebihan p dan kekurangan n. Maka akan mencapai kesetabilannya dengan cenderung mengubah p menjadi n dengan dua cara: Cara I 1 p 1 0 n 1 + +1 e 0 Memancarkan positron

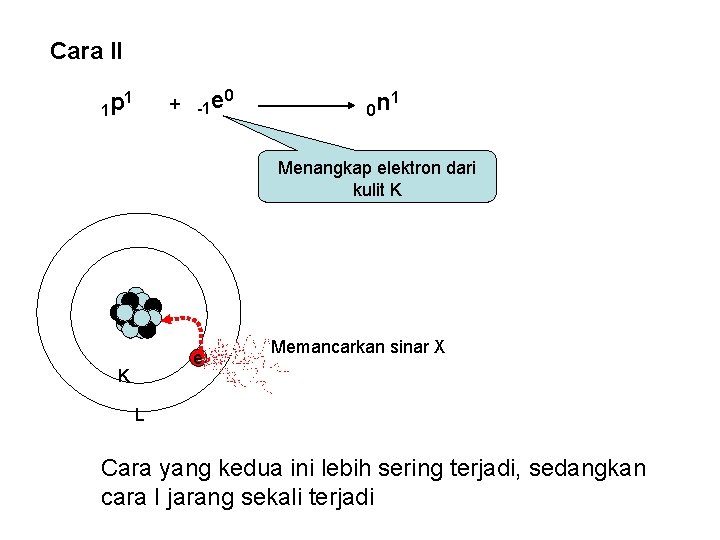
Cara II 1 p + -1 e 1 0 0 n 1 Menangkap elektron dari kulit K e K Memancarkan sinar X L Cara yang kedua ini lebih sering terjadi, sedangkan cara I jarang sekali terjadi

3. Istop-isotop dengan No. atom lebih dari 82. (inti berat) Cenderung meluruh dengan memancarkan sinar alfa ( ) meskipun kadang disertai sinar beta ( ) dan gama ( ) 238 U 92 234 Th 90 234 4 Th + 90 2 230 4 Ra + 2 88

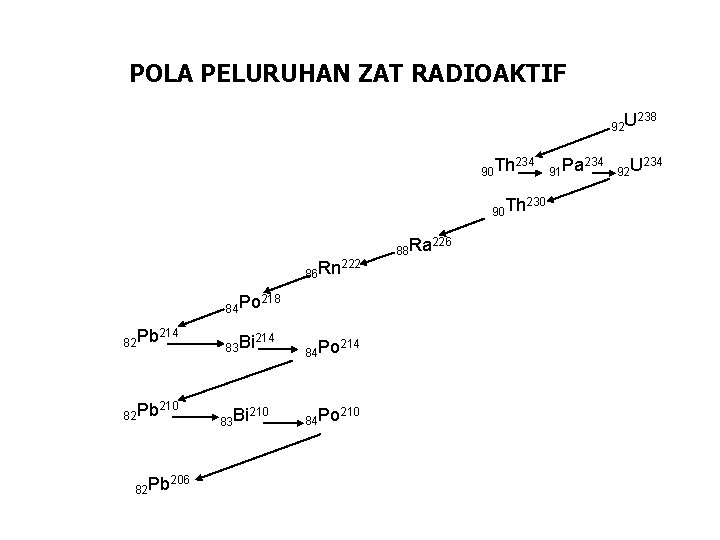
POLA PELURUHAN ZAT RADIOAKTIF 92 U 90 Th 234 90 Th 86 Rn 84 Po 82 Pb 214 82 Pb 210 82 Pb 206 83 Bi 222 218 214 210 84 Po 214 84 Po 210 88 Ra 226 230 91 Pa 234 238 92 U 234

2. Energi Bonding Menurut kajian ini kesetabilan inti atom disebabkan karena adanya energi bonding pernukleon yang cukup besar. Menurut konsep ini sebagian massa dari partikel inti diubah menjadi energi ikat antar nukleon (penyusun inti). Hal ini dapat dilihat dari selisih massa secara teori dan massa secara kenyataan, selisih massa tersebut kemudian diubah menjadi energi dengan konversi Einstein E = mc 2 dan kemudian dibagi jumlah nukleonnya, sehingga akan diperoleh energi ikatan pernukleon.

Nuclear binding energy (BE) is the energy required to break up a nucleus into its component protons and neutrons. BE + 199 F 911 p + 1010 n E = mc 2 BE = 9 x (p mass) + 10 x (n mass) – 19 F mass BE (amu) = 9 x 1. 007825 + 10 x 1. 008665 – 18. 9984 BE = 0. 1587 amu 1 amu = 1. 49 x 10 -10 J BE = 2. 37 x 10 -11 J binding energy per nucleon = number of nucleons 2. 37 x 10 -11 J = 1. 25 x 10 -12 J = 19 nucleons 23. 2

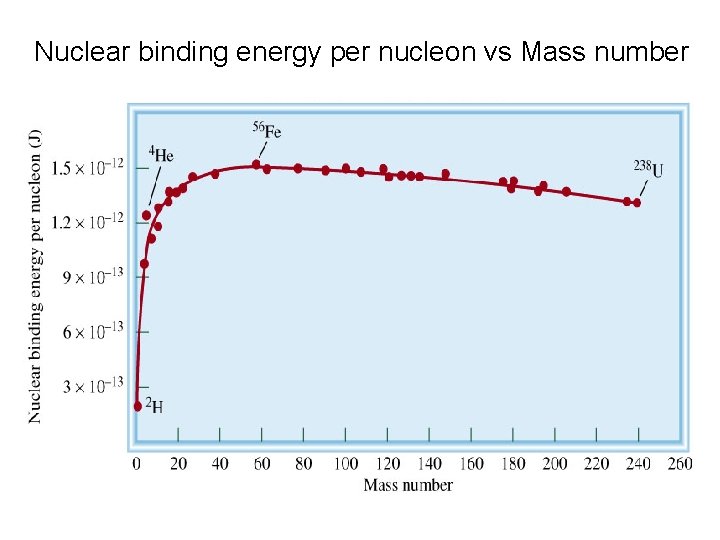
Nuclear binding energy per nucleon vs Mass number

Nuclear Transmutation 14 N 7 27 Al 13 14 N 7 + 24 + 11 p 17 O 8 + 11 p 30 P 15 + 01 n 11 C 6 + 24 Cyclotron Particle Accelerator 23. 4

Balancing Nuclear Equations 1. Conserve mass number (A). The sum of protons plus neutrons in the products must equal the sum of protons plus neutrons in the reactants. 235 92 U + 10 n 138 55 Cs + 96 37 Rb + 2 10 n 235 + 1 = 138 + 96 + 2 x 1 2. Conserve atomic number (Z) or nuclear charge. The sum of nuclear charges in the products must equal the sum of nuclear charges in the reactants. 235 92 U + 10 n 138 55 Cs + 96 37 Rb 92 + 0 = 55 + 37 + 2 x 0 + 2 10 n 23. 1

WAKTU PARUH ( t½ ) Waktu yang diperlukan untuk meluruhkan separuh dari jumlah inti suatu isotop. Waktu paruh bersifat spesifik untuk setiap isotop. Contoh : t½ C-14 = 5700 th t½ Po-214 = 1, 6 x 10 -4 detik t½ Bi-210 = 5 hari t½ Pb-214 = 26, 8 menit Semakin besar (panjang) waktu paruhnya berarti proses peluruhannya berlangsung lambat (Isotop kurang aktif) Semakin pendek waktu paruhnya berarti peluruhannya berlangsung cepat (Isotop sangat aktif)

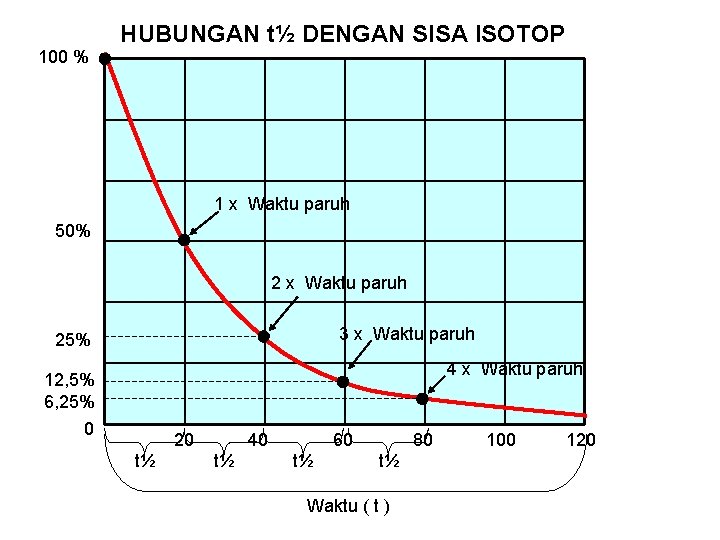
100 % HUBUNGAN t½ DENGAN SISA ISOTOP 1 x Waktu paruh 50% 2 x Waktu paruh 3 x Waktu paruh 25% 4 x Waktu paruh 12, 5% 6, 25% 0 20 t½ 40 t½ 60 t½ 80 t½ Waktu ( t ) 100 120

HUBUNGAN t½ DENGAN SISA ISOTOP Periode Waktu paruh: t / t½ 0 Sisa Isotop Nt 100% = 1 bagian (½)0 bagian 1 50% = ½ bagian (½)1 bagian 2 25 % = ¼ bagian (½)2 bagian 3 12, 5% = 1/8 bagian (½)3 bagian 4 6, 25% = 1/16 bagian (½)4 bagian n Maka sisa isotop ( Nt ) (½)n bagian Maka jumlah isotop yang tersisa; Rumus Nt = ( ½ )n. No

Contoh soal: 1. Suatu isotop setelah disimpan selama 20 hari ternyata masih tersisa = 1/16 bagian. Tentukanlah waktu paruh isotop tersebut ! Jawab: Diketahui : No = 1 bagian Nt = 1/16 bagian Nt = ( ½ )n No 1/16 = ( ½ )n = ( ½ )4 n= t t½ Maka n = 4 Maka t½ = 20 = 5 hari 4

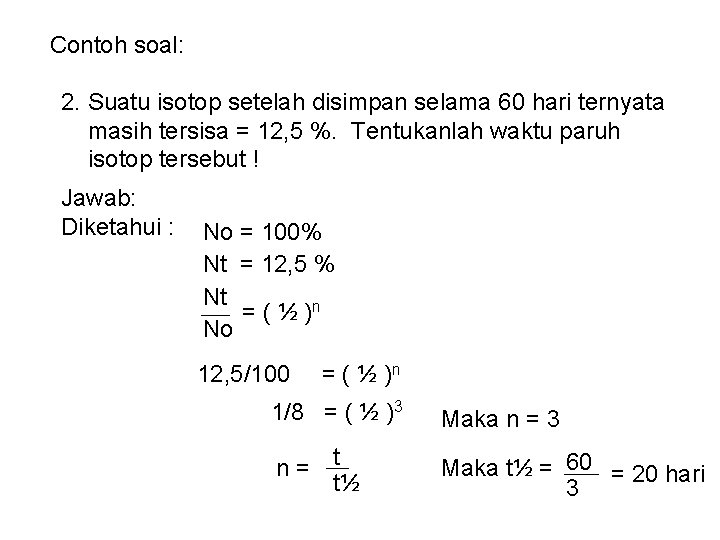
Contoh soal: 2. Suatu isotop setelah disimpan selama 60 hari ternyata masih tersisa = 12, 5 %. Tentukanlah waktu paruh isotop tersebut ! Jawab: Diketahui : No = 100% Nt = 12, 5 % Nt = ( ½ )n No 12, 5/100 = ( ½ )n 1/8 = ( ½ )3 Maka n = 3 n= t t½ Maka t½ = 60 = 20 hari 3

PENENTUAN USIA FOSIL Pada mahluk hidup kadar C-14 yang ada dalam tubuh adalah konstan. Hal ini karena pada mahluk hidup masih melakukan aktivitas kehidupannya Pada mahluk yang sudah mati kadar C-14 yang ada dalam tubuh adalah berkurang. Hal ini karena pada mahluk mati tidak melakukan aktivitas kehidupannya Usia suatu fosil dapat ditentukan berdasarkan aktivitas isotop C-14 yang terkandung dalam fosil ( sebagai Nt ) dibandingkan dengan aktivitas C-14 yang terkandung dalam jasad masih hidup ( sebagai No )

Contoh soal: 3. Telah ditemukan fosil manusia purba di Desa Sangiran, Setelah diidentifikasi aktivitas C-14 nya ternyata memiliki aktivitas 5, 1 dps. Jika pada tulang yang masih hidup memiliki aktivitas C-14 =15, 3 dps dan t ½ C-14 =5700 th. Tentukan usia fosil manusia purba tersebut. Jawab: Diketahui : No = 15, 3 dps Nt = 5, 1 dps Nt = ( ½ )n No 5, 1/15, 3 = ( ½ )n ⅓ = ( ½ )n log ⅓ = log ( ½ )n log ⅓ = n log ½ Hitung n ?

REAKSI INTI Transmutasi inti. Pada transmutasi inti atom ditembaki dengan partikel (proton, netron, alfa atau partikel lain. ) Cyclotron Particle Accelerator

Nuclear Transmutation

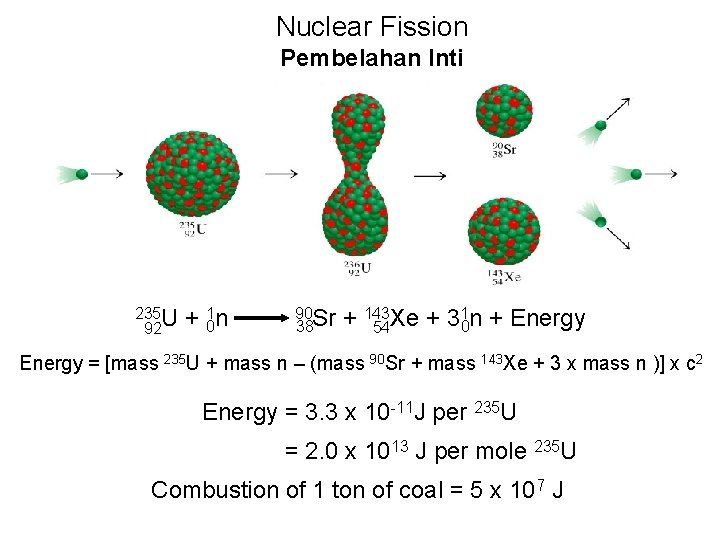
Nuclear Fission Pembelahan Inti 235 U 92 + 01 n 90 Sr 38 1 n + Energy + 143 Xe + 3 0 54 Energy = [mass 235 U + mass n – (mass 90 Sr + mass 143 Xe + 3 x mass n )] x c 2 Energy = 3. 3 x 10 -11 J per 235 U = 2. 0 x 1013 J per mole 235 U Combustion of 1 ton of coal = 5 x 107 J

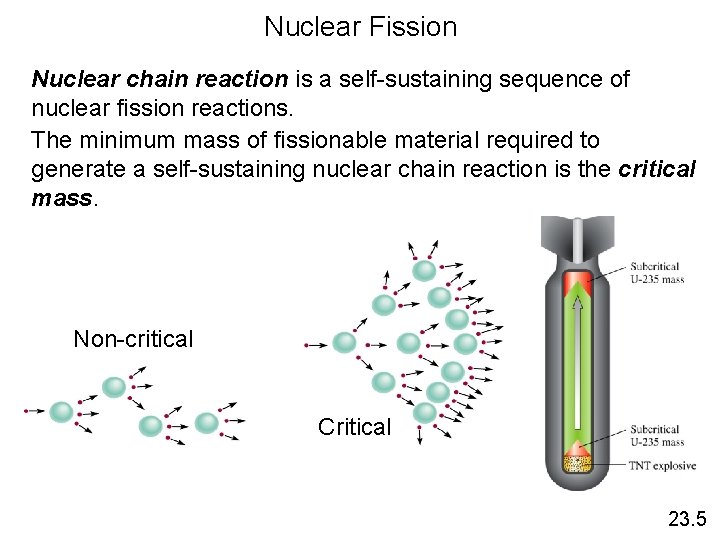
Nuclear Fission Nuclear chain reaction is a self-sustaining sequence of nuclear fission reactions. The minimum mass of fissionable material required to generate a self-sustaining nuclear chain reaction is the critical mass. Non-critical Critical 23. 5

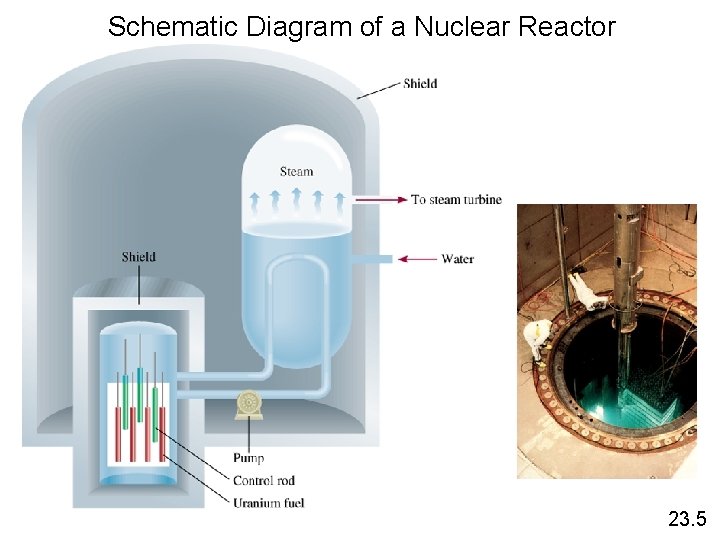
Schematic Diagram of a Nuclear Reactor 23. 5

Natural Uranium 0. 7202 % U-235 99. 2798% U-238 Measured at Oklo 0. 7171 % U-235 Chemistry In Action: Nature’s Own Fission Reactor

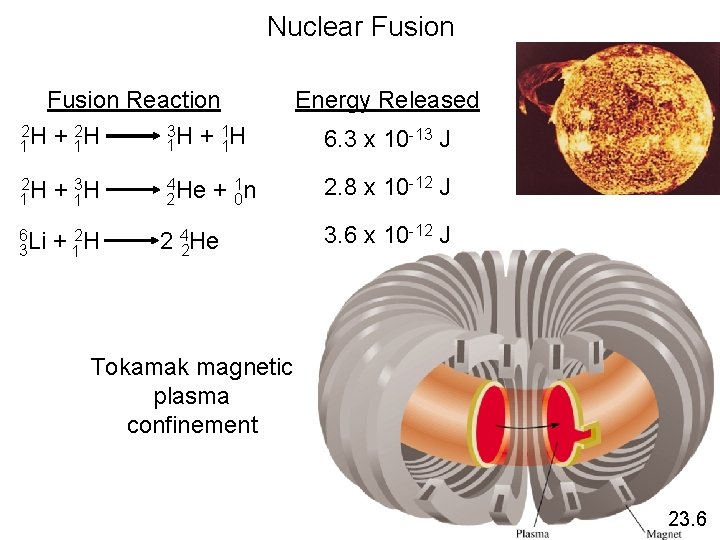
Nuclear Fusion Reaction 2 2 3 1 1 H + 1 H 2 H 1 + 13 H 6 Li 3 + 12 H 4 He 2 2 + 01 n 4 He 2 Energy Released 6. 3 x 10 -13 J 2. 8 x 10 -12 J 3. 6 x 10 -12 J Tokamak magnetic plasma confinement 23. 6


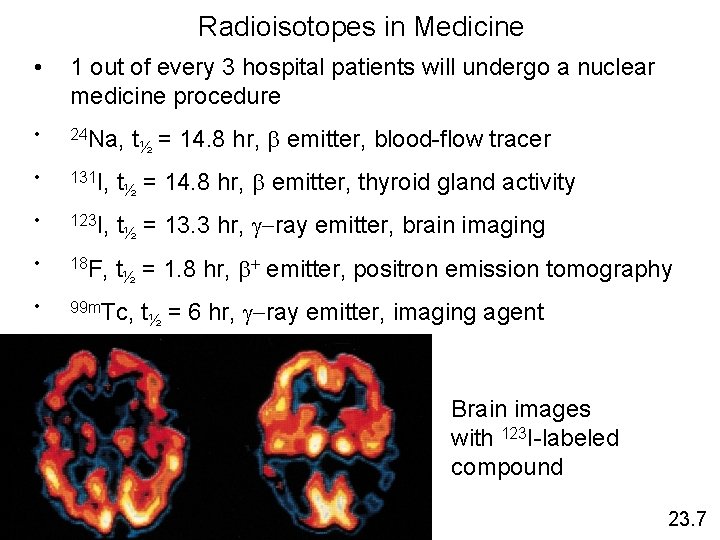
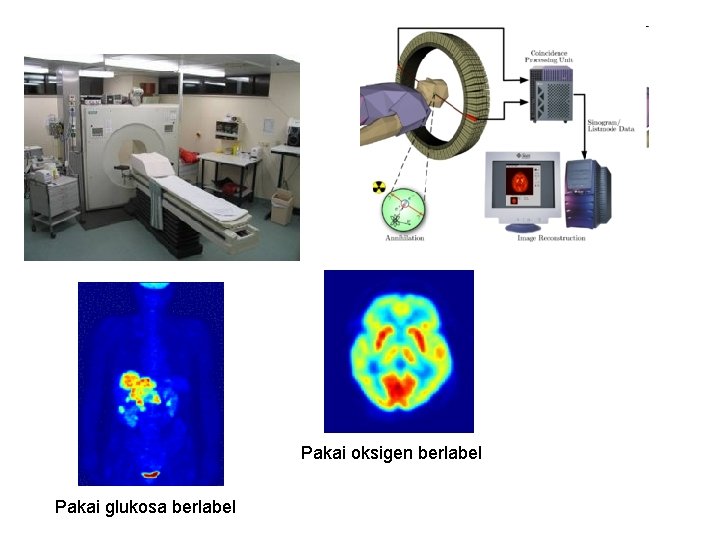
Radioisotopes in Medicine • 1 out of every 3 hospital patients will undergo a nuclear medicine procedure • 24 Na, • 131 I, t½ = 14. 8 hr, emitter, thyroid gland activity • 123 I, t½ = 13. 3 hr, -ray emitter, brain imaging • 18 F, t½ = 1. 8 hr, + emitter, positron emission tomography • 99 m. Tc, t½ = 14. 8 hr, emitter, blood-flow tracer t½ = 6 hr, -ray emitter, imaging agent Brain images with 123 I-labeled compound 23. 7

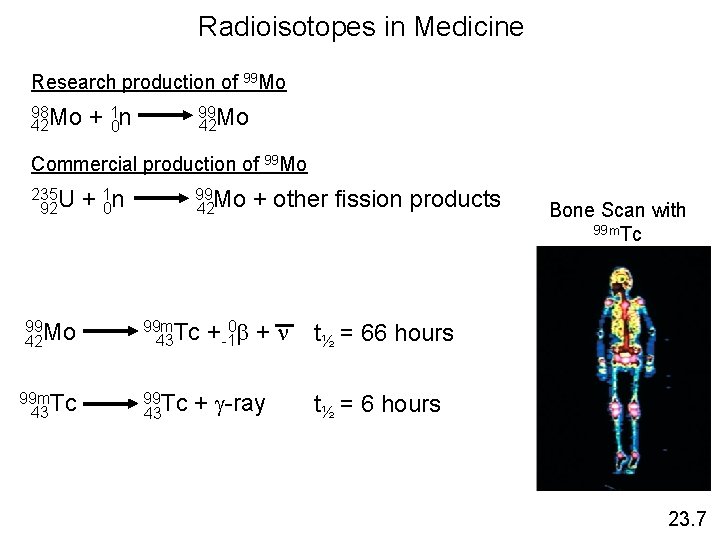
Radioisotopes in Medicine Research production of 99 Mo 98 Mo 42 + 10 n 99 Mo 42 Commercial production of 99 Mo 235 U 92 99 Mo 42 99 m. Tc 43 + 10 n 99 Mo 42 99 m. Tc 43 99 Tc 43 + other fission products + -10 + n + -ray Bone Scan with 99 m. Tc t½ = 66 hours t½ = 6 hours 23. 7

Pakai oksigen berlabel Pakai glukosa berlabel



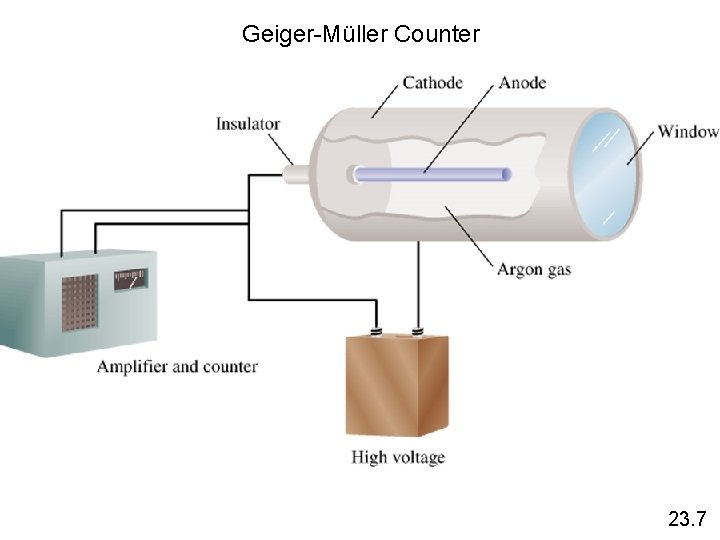
Geiger-Müller Counter 23. 7

Biological Effects of Radiation absorbed dose (rad) 1 rad = 1 x 10 -5 J/g of material Roentgen equivalent for man (rem) 1 rem = 1 rad x Q Quality Factor -ray = 1 =1 = 20 23. 8

Chemistry In Action: Food Irradiation Dosage Effect Up to 100 kilorad Inhibits sprouting of potatoes, onions, garlics. Inactivates trichinae in pork. Kills or prevents insects from reproducing in grains, fruits, and vegetables. 100 – 1000 kilorads Delays spoilage of meat poultry and fish. Reduces salmonella. Extends shelf life of some fruit. 1000 to 10, 000 kilorads Sterilizes meat, poultry and fish. Kills insects and microorganisms in spices and seasoning.
 Unsur unsur naskah
Unsur unsur naskah Peluruhan radioaktif berantai
Peluruhan radioaktif berantai Pemanfaatan konsep fisika inti dalam kehidupan sehari hari
Pemanfaatan konsep fisika inti dalam kehidupan sehari hari Sistem piramida terbalik
Sistem piramida terbalik Jenis investigasi dalam penelitian
Jenis investigasi dalam penelitian Bidang diagonal kubus
Bidang diagonal kubus Apa itu wawasan wiyata mandala
Apa itu wawasan wiyata mandala Unsur unsur pendidikan
Unsur unsur pendidikan Unsur penunjang pak guru
Unsur penunjang pak guru Unsur unsur bangun ruang
Unsur unsur bangun ruang Pengertian finance lease
Pengertian finance lease Unsur manajemen adalah
Unsur manajemen adalah Unsur unsur sumber daya manusia
Unsur unsur sumber daya manusia Setiap kelompok atau tim
Setiap kelompok atau tim Mengapa susunan unsur unsur diberi sisipan kata periodik
Mengapa susunan unsur unsur diberi sisipan kata periodik Unsur unsur sankri
Unsur unsur sankri Tuliskan pengertian wawasan nusantara
Tuliskan pengertian wawasan nusantara Unsur unsur trapesium
Unsur unsur trapesium Unsur perencanaan pembelajaran
Unsur perencanaan pembelajaran Unsur unsur komputer
Unsur unsur komputer Indikator pelaksanaan demokrasi pancasila
Indikator pelaksanaan demokrasi pancasila Cara pembuatan obat tradisional
Cara pembuatan obat tradisional Angka kredit anggota pgri
Angka kredit anggota pgri Komponen manajemen keperawatan
Komponen manajemen keperawatan Unsur-unsur temuan kekurangan
Unsur-unsur temuan kekurangan Unsur unsur kerucut
Unsur unsur kerucut Unsur unsur logam
Unsur unsur logam Berikut yang bukan merupakan atom isotop adalah … *
Berikut yang bukan merupakan atom isotop adalah … * Unsur unsur pembangun prosa fiksi
Unsur unsur pembangun prosa fiksi Proposal festival band
Proposal festival band Unsur unsur koperasi
Unsur unsur koperasi Unsur-unsur penunjang kesehatan rohani di tempat kerja
Unsur-unsur penunjang kesehatan rohani di tempat kerja 5 m dalam manajemen
5 m dalam manajemen Unsur unsur penilaian kinerja
Unsur unsur penilaian kinerja Teori terbentuknya bangsa
Teori terbentuknya bangsa Unsur unsur negara secara klasik
Unsur unsur negara secara klasik Luas selimut kerucut = 2 ∏ r t
Luas selimut kerucut = 2 ∏ r t Parameter identitas nasional
Parameter identitas nasional