Universidade Federal do Paran Setor de Tecnologia Depto

















- Slides: 19

Universidade Federal do Paraná Setor de Tecnologia Depto de Engenharia Química Prof. Dr. Mário José Dallavalli BIOMATERIAIS E BIOMEC NICA TQ-064

Biomateriais Metálicos 1 Metais como Materiais Biocompatíveis • Aplicações dos Metais – Substituição de ossos – Reparação de ossos – Placas metálicas para fraturas, etc. – Implantes dentários, enchimento e pinos – Parafusos e grampos § Partes de outros dispositivos – – Corações artificiais – bombas Marca-passos Cateteres Extensores (stents)

Biomateriais Metálicos § Obtenção e processamento dos Metais • Mineração e purificação do minério • Metais brutos e formas de estocagem • Tarugos e chapas – usinagem, conformação, estampagem, etc • formas e dispositivos preliminares • Processamento • Acabamento e tratamento de superfície

Biomateriais Metálicos 2 Metais mais usados como Biomateriais • Assuntos relacionados aos Metais como Biomateriais – Identidade química (ligas) – Cristalografia – Fases presentes na microestrutura – Grãos e tamanho de grão – Quantidade, distribuição e orientação das fases - Propriedades dos metais

Biomateriais Metálicos • Aço Inoxidável • Ligas a base de Cobalto – Sempre misturado com cromo • Ligas a base de Titânio – Muito leve com relativa alta resistência – Conteúdo de oxigênio afeta a resistência – Relativamente puro

Biomateriais Metálicos • Metais nobres - Au, Pt, Pd, Ir – Caros e com propriedades pobres como materiais – Usados em eletrodos – elevada resistência a corrosão • Mercúrio – Amalgama dentário – Amalgamas - é toda liga metálica em que um dos metais envolvidos está em estado líquido, geralmente o mercúrio – Metais formadores - mercúrio, prata e estanho, podendo haver também o zinco e cobre

Biomateriais Metálicos 3 Aço Inoxidável • Inúmeras variedades existentes • Ligas de baixo teor de carbono mais usadas – Altos teores de carbono causam corrosão do ferro • • Misturas de Fe, Cr, e Ni O cromo oxida para limitar a corrosão – – – Por que a corrosão é indesejada? Lixiviação para o corpo Formação de trincas e fadiga

AÇOS § Aços - ligas Fe-C que podem conter outros elementos. – Propriedades mecânicas dependem da %C. § %C < 0. 25% => baixo carbono § 0. 25% < %C < 0. 60% => médio carbono § 0. 60% < %C < 1. 4% => alto carbono § Aços carbono – Baixíssima concentração de outros elementos. § Aços liga – Outros elementos em concentração apreciável.

Biomateriais Metálicos • Presença de altos teores de cromo reduz a resistência • Níquel adicionado para aumento de resistência – Estabiliza a austenita • Quanto menores os grãos, maior a resistência – Como ajustar o tamanho de grão?

Biomateriais Metálicos 4 Corrosão • Metais degradam a óxidos, hidróxidos e outros compostos • Fenômeno oposto a de uma bateria • Fluidos biológicos contem água, oxigênio dissolvido, íons, etc. - Mistura muito agressiva • Corrosão é um dos aspectos mais importantes da Biocompatibilidade dos metais

Corrosão em superfície

Biomateriais Metálicos • Mecanismo da corrosão – O estado de menor energia é o estado oxidado – Átomos dos metais ionizam, entram em solução e combinam com o oxigênio § Equação geral da formação da ferrugem Fe (s) ---> Fe 2+ + 2 e- (oxidação do ferro) O 2 + 2 H 2 O + 4 e- ---> 4 OH- (redução do oxigênio) 2 Fe + O 2 + 2 H 2 O ---> 2 Fe(OH)2 – Similarmente a ferrugem no ferro: os metais “escamam” • A tendência a corrosão é baseada na série eletroquímica

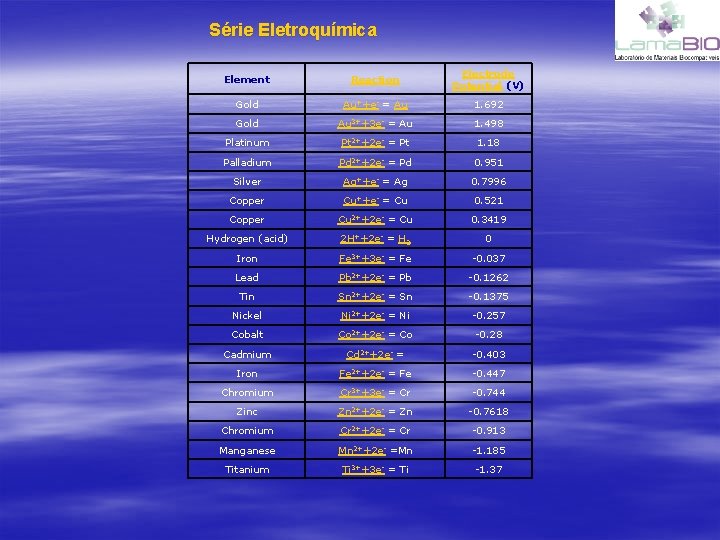
Biomateriais Metálicos • Série eletroquímica (H=0) – Au > Ag > H > Fe > Ti > Al > Na > Li – Metais nobres possuem potencial de Nernst positivo, sendo imune a corrosão • Metais com potencial negativo se tornam anodos • Corrosão galvânica envolve dois metais similares – O processo é muito mais rápido do que se utilizado um único metal – Devemos evitar metais misturados!!!!!!

Série Eletroquímica Element Reaction Electrode Potential (V) Gold Au++e- = Au 1. 692 Gold Au 3++3 e- = Au 1. 498 Platinum Pt 2++2 e- = Pt 1. 18 Palladium Pd 2++2 e- = Pd 0. 951 Silver Ag++e- = Ag 0. 7996 Copper Cu++e- = Cu 0. 521 Copper Cu 2++2 e- = Cu 0. 3419 Hydrogen (acid) 2 H++2 e- = H 2 0 Iron Fe 3++3 e- = Fe -0. 037 Lead Pb 2++2 e- = Pb -0. 1262 Tin Sn 2++2 e- = Sn -0. 1375 Nickel Ni 2++2 e- = Ni -0. 257 Cobalt Co 2++2 e- = Co -0. 28 Cadmium Cd 2++2 e- = -0. 403 Iron Fe 2++2 e- = Fe -0. 447 Chromium Cr 3++3 e- = Cr -0. 744 Zinc Zn 2++2 e- = Zn -0. 7618 Chromium Cr 2++2 e- = Cr -0. 913 Manganese Mn 2++2 e- =Mn -1. 185 Titanium Ti 3++3 e- = Ti -1. 37

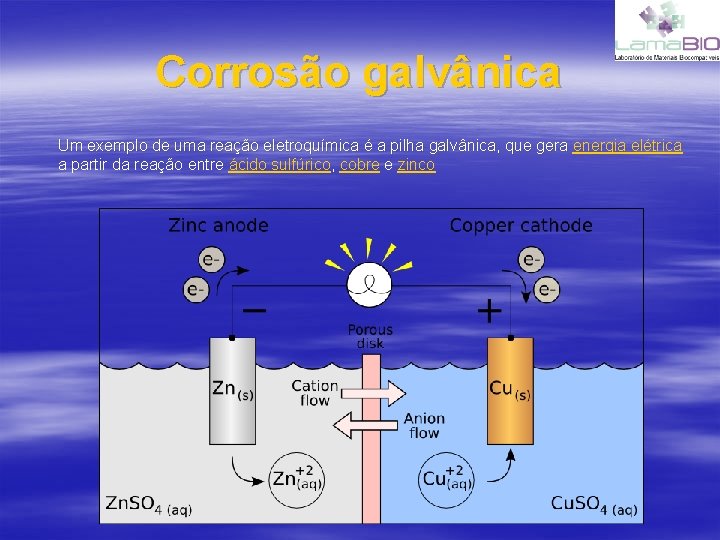
Corrosão galvânica Um exemplo de uma reação eletroquímica é a pilha galvânica, que gera energia elétrica a partir da reação entre ácido sulfúrico, cobre e zinco

Biomateriais Metálicos • Potencial galvânico em um único metal • Filmes passivadores podem limitar a corrosão (camadas de óxidos), mas também podem ser trincadas • Os diagramas de Pourbaix mostram regiões de corrosão, passivação e imunidade e como elas dependem do potencial de eletrodo e do p. H – Logo regiões diferentes do corpo afetam o processo da corrosão diferentemente – Feridas e infecções podem mudar dramaticamente o p. H

Diagrama de Pourbaix para Corrosão

Biomateriais Metálicos § Corrosão e fadiga podem ser efeitos sinérgicos § – Testes devem sempre ser realizados em meios e condições fisiológicas § • Impressão na superfície do metal pode quebrar a passivação § • Pitting é corrosão em uma área localizada (variação da conc. de oxigênio – corrosão galvânica) § • Problema importante é assegurar que parafusos, porcas e chapas sejam do mesmo metal (corrosão galvânica) § • Os cirurgiões devem ter extremo cuidado para não arranhar a superfície do metal

Fim Até a próxima aula
 Siare ufsc
Siare ufsc Universidade federal do rio grande do norte
Universidade federal do rio grande do norte Universidade federal do amazonas
Universidade federal do amazonas Universidade federal de santa catarina
Universidade federal de santa catarina Universidade federal de santa catarina
Universidade federal de santa catarina Universidade federal do rio grande do norte
Universidade federal do rio grande do norte Universidade federal do amazonas medicina
Universidade federal do amazonas medicina Universidade federal de santa catarina
Universidade federal de santa catarina Texto-base adaptada universidade federal de alagoas ufal
Texto-base adaptada universidade federal de alagoas ufal Universidade federal de são paulo campus osasco
Universidade federal de são paulo campus osasco Universidade federal de santa catarina
Universidade federal de santa catarina Universidade federal do amazonas
Universidade federal do amazonas Universidade federal de santa catarina brazil
Universidade federal de santa catarina brazil Da li je nula pozitivan broj
Da li je nula pozitivan broj Amos paran
Amos paran Paran hab
Paran hab Pronomes e coesão textual exercícios
Pronomes e coesão textual exercícios Carlos alberto calixto mattar
Carlos alberto calixto mattar Contabilidade do terceiro setor
Contabilidade do terceiro setor Pastoral familiar setor casos especiais ppt
Pastoral familiar setor casos especiais ppt





































