Universidade Federal do Acre Coordenao de Cincias Agrrias


































- Slides: 36

Universidade Federal do Acre Coordenação de Ciências Agrárias PET-Agronomia Bolsistas: Renato Florestal) (7º Período- Tutor: Prof. Dr. José Rio Branco, Acre 2006 Ribamar

1 – As leis ponderais e Volumétricas Origem Teorias Atômicas – Evolução da Atomística - Modelos Principais leis importantes para o estudo de Cálculo Estequiométrico: Lei de Lavoisier; Lei de Prost; Lei de Dalton; Lei de Richter; Lei de volumétricas de Gay-Lussac SILVA, R. O, 2005 JRTSilva

1 – As leis ponderais Lei de Lavoisier ou Lei de Conservação das Massas Os Elementos de Química, publicado em 1789; A massa total dos reagentes é igual à massa total dos produtos; “Na natureza nada se cria, nada se perde, tudo se transforma”. Ex: A + B AB 2 g 10 g ? Pela Lei de Lavoisier 2 + 10 = 12 g. SILVA, R. O, 2005 JRTSilva

1 – As leis ponderais Lei de Proust ou Lei das Proporções Fixas As massas dos reagentes e produtos são, entre si, diretamente proporcionais; Substâncias Pura Substâncias Mesma Composição Química; Composição Fixa Fórmula Química. SILVA, R. O, 2005 JRTSilva

1 – As leis ponderais Leis Volumétricas de Gay – Lussac (1808). . . conhecido por formular a lei dos gases; . . . nem sempre o volume total dos reagentes é igual ao volume total dos produtos; . . . Reação contração de volume; Os volumes dos reagentes e dos produtos de uma reação envolvendo substâncias gasosas CNTP, obedecem a uma proporção constante. SILVA, R. O, 2005 JRTSilva

1 – As leis ponderais Exemplo 1: Nos carros movidos a hidrogênio, a combustão ocorre nas seguintes proporções: hidrogênio + oxigênio água 2 g 16 g ? Pela Lei de Lavoisier Massa (água) = 2 + 16 = 18 g. Qual massa de água seria produzida na queima de 40 kg de hidrogênio? hidrogênio água 2 g 18 g 40. 000 g x g x = 360. 000 g ou x= 360 kg de água SILVA, R. O, 2005 JRTSilva

1 – As leis ponderais Exemplo 1: Calcular a massa do oxigênio consumido na reação a seguir? hidrogênio + oxigênio água 40 kg y 360 kg Aplicando a Lei de Lavoisier: M. Reagente = M. Produto 40 + y = 360 y = 360 - 40 y = 320 kg Assim, a combustão irá consumir 320 kg de gás oxigênio. SILVA, R. O, 2005 JRTSilva

1 – As leis ponderais Exemplo 2: Determine a composição percentual do dicromato de potássio (K 2 Cr 2 O 7). Resolução: Calcula-se: a massa molar do K 2 Cr 2 O 7? Dados: (K = 39; Cr = 52; O = 16); K 2 Cr 2 O 7 7. 16 = 112 2. 52 = 104 2. 39 = 78 294 MM = 294 u. m. a mol = 294 g Massa Molar = 294 g/mol SILVA, R. O, 2005 JRTSilva

1 – As leis ponderais Exemplo 2: Cont: K 2 Cr 2 O 7 2 K + 2 Cr + 7 O 294 g 78 g 104 g 112 g 100 g x % y % z % Pela Lei de Proust temos: x = 26, 5 % K, y = 35, 4 % Cr e z = 38, 1% O SILVA, R. O, 2005 JRTSilva

2 – Fórmulas Químicas Classificação: Fórmula porcentual (Composição Centesimal) “Porcentagem em massa de cada elemento que forma uma substância”. Ex: H 11, 11 % O 88, 89 % Fórmula mínima “Menor proporção em nos inteiros de átomos (mol) dos elementos que formam uma substância”. Ex: CH 2 O SILVA, R. O, 2005 JRTSilva

2 – Fórmulas Químicas Fórmula molecular “Quantidade de átomos de cada elemento que forma a molécula de uma substância ”. Ex: H 8 C 4 O 2 SILVA, R. O, 2005 JRTSilva

2 – Fórmulas Químicas Exemplo 1: Verifica-se que 4 g de H 2 reagem com gás O 2, produzindo 36 g de água. Qual a composição porcentual da água? Hidrogênio + oxigênio água 4 g x % 36 g 100 g z g y % Pela lei de Lavoisier: 4 + z = 36 z = 32 g Pela lei de Proust: 4 32 = = x y 36 100 x = 11, 11 % H y = 88, 89 % O 2 Fórmula percentual é: H 11, 11 % O 88, 89 % SILVA, R. O, 2005 JRTSilva

2 – Fórmulas Químicas Exemplo 2: Qual a fórmula molecular de um composto que apresenta fórmula porcentual H 9, 09% C 54, 54% O 36, 36% e massa molecular 88 u ? Hidrogênio Carbono Oxigênio 9, 09 g = 9, 09 mols 1 g/mol 54, 54 g = 4, 55 mols 12 g/mol 36, 36 g = 2, 27 mols 16 g/mol Dividimos por 2, 27: Hidrogênio Carbono Oxigênio 9, 09 = 4 2, 27 4, 55 = 2 2, 27 = 1 2, 27 Fórmula mínima (fm) H 4 C 2 O 1 SILVA, R. O, 2005 JRTSilva

2 – Fórmulas Químicas Assim: Fórmula Molecular = (fórmula mínima) x n FM = (fm)n fm = H 4 C 2 O 1 MM = 1 x 4 + 12 x 2 + 16 x 1 = 44 FM = ? MM (FM) = 88 Como: n = 2 Fórmula Molecular: FM = (fm)n FM = (H 4 C 2 O)2 = H 8 C 4 O 2 SILVA, R. O, 2005 JRTSilva

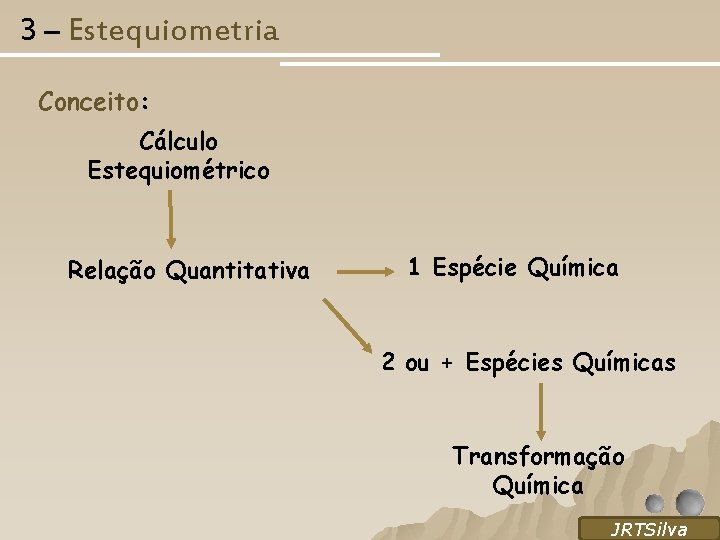
3 – Estequiometria Conceito: Cálculo Estequiométrico Relação Quantitativa 1 Espécie Química 2 ou + Espécies Químicas Transformação Química SILVA, R. O, 2005 JRTSilva

3. 1 – Cálculo Estequiométrico Como podem ser feitos os Cálculos? Estabelecidas as proporções é possível fazer inúmeros cálculos através de simples Regra de Três. Para Elementos: 1 Atg M. A. (g); 6, 02 · 1023 átomos. Para Substâncias: M. M. (g); 1 mol 6, 02 · 1023 moléculas; 22, 4 L (Gás, CNTP). SILVA, R. O, 2005 JRTSilva

3. 2 – Regras para resolver problemas envolvendo cálculo estequiométrico I - Escrever a equação química; II - Balancear a equação; III - Escrever a relação em mols dos reagentes e produtos; IV - Substituir o mol por M. M(g), 6, 02 x 1023 moléculas (átomo) ou 22, 4 L (CNTP), quando for o caso, isto em função do que é “Dado” e pedido para “Calcular”; V - Colocar os dados do problema cálculo. SILVA, R. O, 2005 JRTSilva

3. 3 – Exercícios Resolvidos Exemplo 1: De acordo com a equação Fe + O 2 Fe 2 O 3, calcule: a) O nº de mols de moléculas de O necessário para 2 reagir com 5 mols de átomos de ferro; I II III Fe + O 2 Fe 2 O 3 3 2 Fe 4 Fe + O 2 2 O 3 4 mols 3 mols 2 mols Assim, temos: IV 4 Fe 3 O 2 4 mols 3 mols V 5 mols x mols x = 3, 75 mols Assim, é necessário 3, 75 mols de moléculas de O 2. SILVA, R. O, 2005 JRTSilva

3. 3 – Exercícios Resolvidos Exemplo 1: Cont: b) O nº de moléculas de Fe 2 O 3 que se forma a partir de 3, 01 · 1023 moléculas de O 2. 4 Fe + 3 O 2 2 Fe 2 O 3 IV 3 O 2 2 Fe 2 O 3 3 · 6, 02 · 1023 2 · 6, 02 · 1023 V 3, 01 · 1023 y moléculas 2 y = 2, 0 x 1023 moléculas Formam-se 2, 0 x 1023 moléculas de Fe 2 O 3. SILVA, R. O, 2005 JRTSilva

3. 3 – Exercícios Resolvidos Exemplo 2: Calcular a massa de Ca. O e o volume de CO 2 nas CNTP produzida pela decomposição térmica de 300 g de carbonato de cálcio, de acordo com o processo: Ca. CO 3 Ca. O + CO 2. Dado: 300 g Ca. CO 3; I II IV V Ca. CO 3 1 Ca. CO 3 Calcular: g Ca. O; L CO 2? Ca. O + CO 2 1 Ca. O + 1 CO 2 1 mol Ca. CO 3 Ca. O 100 g 56 g 300 g x g x = 168 g Ca. O IV Ca. CO 3 CO 2 100 g 22, 4 L V 300 g y L y = 67, 2 L CO 2 SILVA, R. O, 2005 JRTSilva

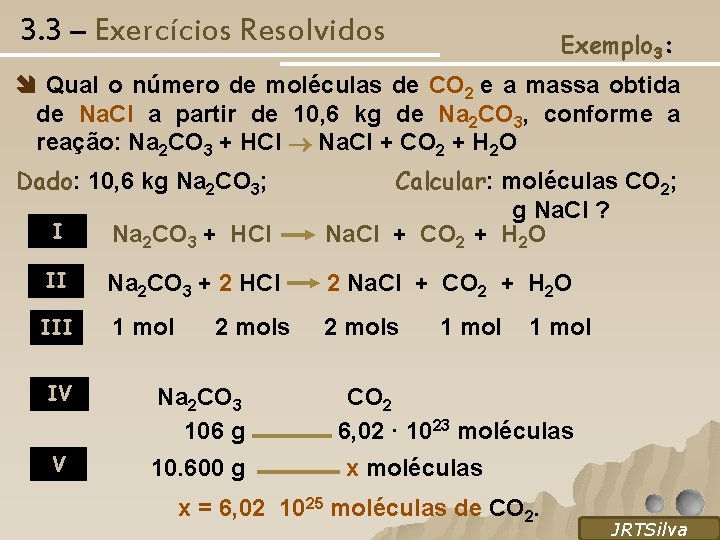
3. 3 – Exercícios Resolvidos Exemplo 3: Qual o número de moléculas de CO 2 e a massa obtida de Na. Cl a partir de 10, 6 kg de Na 2 CO 3, conforme a reação: Na 2 CO 3 + HCl Na. Cl + CO 2 + H 2 O Dado: 10, 6 kg Na 2 CO 3; I Calcular: moléculas CO 2; g Na. Cl ? Na 2 CO 3 + HCl Na. Cl + CO 2 + H 2 O II Na 2 CO 3 + 2 HCl 2 Na. Cl + CO 2 + H 2 O III 1 mol 2 mols 1 mol IV V Na 2 CO 3 CO 2 106 g 6, 02 · 1023 moléculas 10. 600 g x moléculas x = 6, 02 1025 moléculas de CO 2. SILVA, R. O, 2005 JRTSilva

3. 3 – Exercícios Resolvidos Exemplo 3: Cont: Dado: 10, 6 kg Na 2 CO 3; Calcular: g Na. Cl? Na 2 CO 3 + 2 HCl 2 Na. Cl + CO 2 + H 2 O IV Na 2 CO 3 2 Na. Cl 100 g V 10. 600 g 2 · 58, 5 g y = 12. 402 g Na. Cl ou y = 12, 402 kg Na. Cl SILVA, R. O, 2005 JRTSilva

3. 3 – Exercícios Resolvidos Exemplo 4: Calcular o volume de H 2, a 27º C e 2 atm, que se obtém na reação entre 8 g de Ca e quantidade suficiente de H 2 O. Dada a equação: Ca + H 2 O Ca(OH)2 + H 2 Dado: 8 g Ca; 2 atm, 27°C; Calcular: L H 2? I Ca + H 2 O Ca(OH)2 + H 2 II Ca + H 2 2 O Ca(OH)2 + H 2 III 1 mol 2 mols 1 mol IV V Ca H 2 40 g 1 mol x mol 8 g x = 0, 2 mol Assim, obtém-se 0, 2 mol de Hidrogênio. SILVA, R. O, 2005 JRTSilva

3. 3 – Exercícios Resolvidos Dado: 8 g Ca; 2 atm, 27°C; Exemplo 4: Calcular: L H 2? Calculando o volume pela Equação de Clapeyron, temos: PV = n. RT V = 2, 46 L P Portanto, obtém –se 2, 46 L de Hidrogênio Outra forma de calcular o volume: Ca H 2 40 g 22, 4 L 8 g y L y = 4, 48 L (CNTP) P 1 V 1 T 1 = P 2 V 2 T 2 1 atm · 4, 48 L = 273 K V 2 = 2, 46 L H 2 2 atm · V 2 300 K = SILVA, R. O, 2005 JRTSilva

4 – Pureza Grau de Pureza É o quociente entre a massa da substância pura e a massa total da amostra. Porcentagem da Pureza É o porcentagem da massa da substância pura em relação a massa total da amostra. Impureza É a parte inerte da amostra, com relação ao processo químico realizado. SILVA, R. O, 2005 JRTSilva

4 – Pureza Exemplo: Qual a massa de Ca. Cl 2 obtida pela reação de 500 g calcário calcítico (Ca. CO 3) com 90 % de pureza em presença de HCl em excesso? Ca. CO 3 + HCl Ca. Cl 2 + H 2 O + CO 2 Dados: Ca = 40, C = 12, O = 16, Cl = 35, 5 g/mol; Resolução: 500 g Calcário com Pureza = 90 % Quanto reage? 100 g Calcário 90 g Ca. CO 3 500 g Calcário x g Ca. CO 3 x = 450 g Ca. CO 3 SILVA, R. O, 2005 JRTSilva

4 – Pureza Exemplo: Cont: Dado: Ca = 40, C = 12, O = 16; Cl = 35, 5 g/mol; 450 g Ca. CO 3; Calcular: g Ca. Cl 2? I Ca. CO 3 + HCl Ca. Cl 2 + H 2 O + CO 2 II Ca. CO 3 + 2 HCl Ca. Cl 2 + H 2 O + CO 2 1 mol 2 mols 1 mol III IV Ca. CO 3 Ca. Cl 2 100 g 111 g V 450 g y g y = 499, 5 g Ca. Cl 2 SILVA, R. O, 2005 JRTSilva

5 – Rendimento de uma reação Numa reação química, os produtos são obtidos em quantidades menores que as previstas na teoria; . . . o rendimento de uma reação química nunca é 100 %. SILVA, R. O, 2005 JRTSilva

5 – Rendimento de uma reação Exemplo: î A combustão de 42, 5 g de um amoníaco (NH 3) tem um rendimento de 95 %. Calcule a massa, em gramas de H 2 O que se obtém nessa combustão. Dada a equação: NH 3 + O 2 N 2 + H 2 O. Dados: N = 14, H = 1, O = 16 g/mol; NH 3 + O 2 N 2 + H 2 O I II 4 NH 3 + O 3 2 N 2 2 + H 6 2 O III 4 mols 3 mols 2 mols 6 mols IV V 4 NH 3 6 H 2 O 4 · 17 g 6 · 18 g x g x = 67, 5 g de H 2 O 42, 5 g x = Massa de H 2 O num rendimento de 100 %. JRTSilva SILVA, R. O, 2005 JRTSilva

5 – Rendimento de uma reação Exemplo: Cont: Dado: 67, 5 g de H 2 O (rendimento de 100 %). Calcular: g H 2 O com rendimento de 95 %? Assim, temos: Rendimento g H 2 O obtida 100 % 67, 5 g y g 95 % y = 64, 12 g de H 2 O JRTSilva SILVA, R. O, 2005 JRTSilva

6 –Considerações Finais Leis Ponderais; Fórmulas Químicas; Cálculo Estequiométrico; . Equação balanceada; . 1 mol – MM (g) – 6, 02 x 1023 – moléculas – 22, 4 L. JRTSilva SILVA, R. O, 2005

7 – Exercícios Complementares 1. (FUVEST-SP) Uma substância de massa molecular 120 contém 40 % de carbono, 53, 3 % de oxigênio e 6, 7 % de hidrogênio. Qual a sua fórmula molecular? (Dados: H=1, C=12, O=16 g/mol) a ( ) C 2 H 2 O 4 b ( ) C 2 H 4 O 2 c) ( ) CH 2 O d) ( ) C X 4 H 8 O 4 e) ( ) C 4 H 2 O 4 JRTSilva SILVA, R. O, 2005

7 – Exercícios Complementares 2. O sulfato de amônio é um adubo utilizado como fonte de nitrogênio. A porcentagem em massa de nitrogênio, no (NH 4)2 SO 4, é: Dados: N=14, H=1, S=32, O=16 g/mol. X a ( ) 21, 21 % b ( ) 10, 60 % c) ( ) 42, 42 % d) ( ) 36, 00 % e) ( ) 45, 00 % JRTSilva SILVA, R. O, 2005

7 – Exercícios Complementares 3. Qual a massa de óxido de cálcio e o volume de gás carbônico obtido nas CNTP pela decomposição térmica do calcário (Ca. CO 3) considerando um produto com pureza de 80% e um rendimento da reação de 90%. Reação: Ca. CO 3 Ca. O + CO 2 (Dados: Ca =40, C=12, O=16 g/mol). JRTSilva SILVA, R. O, 2005

7 – Exercícios Complementares 4. (UFAC-97) Dentro de um cilindro fechado, ocorre a reação descrita abaixo: 3 H 2(g) + N 2(g) 2 NH 3(g) Qual o volume de amônia que se obtém a partir de 12 g de hidrogênio, quando a reação for submetida a - 23 o. C e 2 atm de pressão? (Dados: H = 1 g, N=14 g, R=0, 082 atm. L/mol. K) JRTSilva SILVA, R. O, 2005

“Mas, buscai primeiro o Reino de Deus e a sua justiça, e todas estas coisas vos serão acrescentadas. ” Mateus: 6 -33 Prof. Dr. José Ribamar Silva