UNIVERSIDAD VERACRUZANA FACULTAD DE CIENCIAS QUIMICAS CAMPUS POZA

















- Slides: 19

UNIVERSIDAD VERACRUZANA FACULTAD DE CIENCIAS QUIMICAS CAMPUS POZA RICA -TUXPAN DESTILACIÓN FLASH ALUMNOS: SELENE JULIET SANTES GOMEZ JOSE ALBERTO SANTIAGO MARTINEZ INGENIERIA QUIMICA

DESTILACION Es la más utilizada en ingeniería química y consiste en separar 2 o más componentes de una mezcla líquida aprovechando sus diferencias en cuanto a la presión de vapor.

La presión de vapor es muy dependiente de la temperatura, a mayor temperatura mayor presión de vapor, hasta que esta se iguale con la presión exterior (1 atmósfera). En este punto el líquido comienza a ebullir. Si la mezcla está constituida por 2 componentes se llama mezcla binaria. Si hay más de 2 componentes se denomina mezcla multicomponente.

DESTILACIÓN INSTATANEA O FLASH Consiste en la vaporización de una fracción definida del liquido, en una manera tal que el vapor que se forma esta en equilibrio con el liquido residual, separando el vapor del liquido y condensando el vapor.

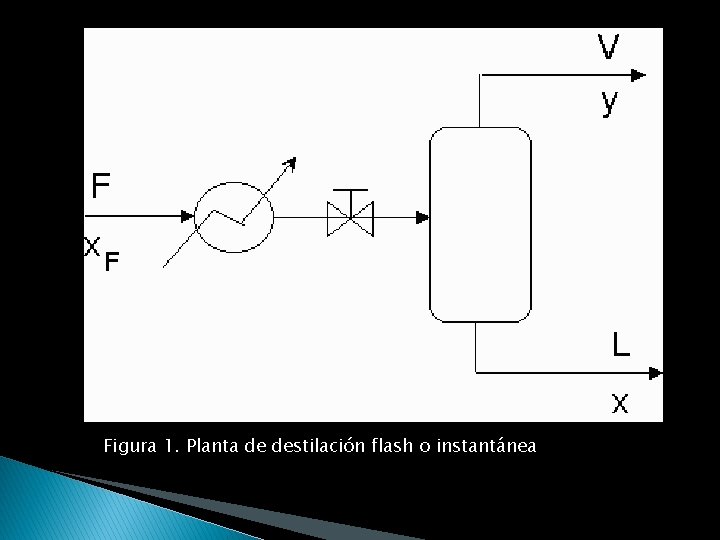
El alimento se introduce a temperatura elevada, se le da calor externamente y se mantiene a una presión elevada pero sin que hierva, entonces se pasa el líquido regulando la entrada en la columna con una válvula. Dentro de la columna se produce una expansión de los componentes más volátiles, y también una fase líquida más rica en los compuestos más volátiles. En este caso no existe caldera. Estarán en equilibrio los componentes de vaporización y líquido dependiendo de las condiciones de entrada. (figura 1)

Figura 1. Planta de destilación flash o instantánea

Los procesos de separación flash son muy comunes en la industria, particularmente en la refinación de petróleo. Aunque se utilicen otros métodos de separación, no es raro encontrar destilaciones instantáneas preliminares para reducir la carga de entrada a los otros procesos. BALANCES DE MASA Y ENERGIA En el esquema que se muestra(figura 1) , F es la mezcla que se desea separar, formada por dos compuestos A y B. Xf es la fracción molar del compuesto más volátil de la mezcla (esta es una convención). V y L son las fases vapor y liquido. X y Y son las composiciones del compuesto más volátil en cada fase. Se considera que estas composiciones están en equilibrio.

De acuerdo con lo anterior y considerando un estado estacionario, el balance de masa general es: y el balance del componente más volátil será: Mientras que el balance de energía es: Donde Hf es la entalpía de la mezcla de alimentación, h la entalpía de saturación de la fase líquida (entalpía en el punto de ebullición o punto de burbuja) , H la entalpía de saturación de la fase vapor (entalpía del punto de rocío) y Q el calor que se suministra en el intercambiador (o el que se retire en el caso en que la alimentación sea un vapor).

Ahora hagamos un par de arreglos a estos balances con el fin de obtener ecuaciones que nos sean útiles Primero se define la fracción vaporizada de la alimentación f= V/F de forma que el balance de masa general se puede escribir así: y entonces el balance de componente nos da: Esta es la ecuación de una línea recta (línea de operación), trazada en una gráfica de equilibrio del sistema ( X vs. Y). Para trazar esta línea basta conocer la fracción vaporizada (para tener la pendiente) y la composición de la alimentación (para conocer el intercepto).

Podemos hacer otro arreglo para examinar las relaciones entre los flujos de masa, las composiciones y las entalpías. Primero resolvamos simultáneamente el balance general de masa y el balance de componente para obtener: Lo que nos lleva a: Que representa la ecuación de una línea recta en coordenadas x contra y. Se puede reordenar esta expresión así:

Los balances de masa y energía se pueden combinar de la misma forma y nos queda: De manera que estas ecuaciones definen la línea de operación del proceso en términos de las composiciones y las entalpías respectivamente.

TECNICAS DE CÁLCULO Para resolver un problema de destilación flash, debemos resolver simultáneamente las ecuaciones de operación y de equilibrio. Estos cálculos se pueden hacer directamente, pero usualmente requieren un proceso iterativo. Las técnicas gráficas son comunes para evitar estos engorrosos procedimientos. A menudo, la elección de la técnica depende de la forma de representar el equilibrio que se encuentre disponible.

� EJEMPLO: Una mezcla de 50% molar de heptano normal y octano normal a 30 C, se alimenta a un proceso de flash continuo a 1 atm. de manera que se vaporice el 60% de la carga original. Cuál será la composición de los productos liquido y vapor? Tenemos que: xf=0. 5, f=0. 6 Base de cálculo: 100 moles de alimentación Si aplicamos el balance de masa: El método de solución realmente depende de la forma en que tengamos representado el equilibrio. Si tenemos una gráfica de equilibrio xy, el problema se puede resolver gráficamente si trazamos la línea de operación en esta grafica.

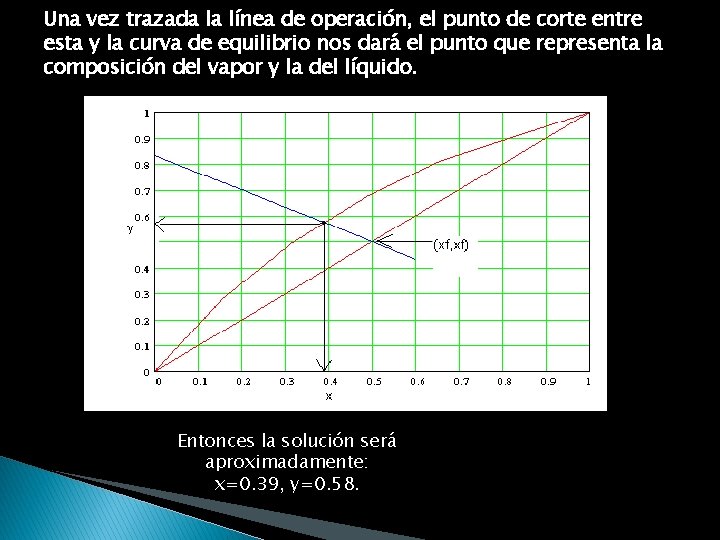
. La línea de operación es: y como la pendiente y el intercepto son conocidos, entonces podemos trazar esa línea. Algunas veces, la escala de el diagrama de equilibrio puede hacer difícil localizar el intercepto. En ese caso, es más fácil utilizar la pendiente y algún otro punto. Ese otro punto puede ser donde nuestra línea de operación corte la línea de 45 grados (y=x). O sea el punto (xf, yf)

Una vez trazada la línea de operación, el punto de corte entre esta y la curva de equilibrio nos dará el punto que representa la composición del vapor y la del líquido. Entonces la solución será aproximadamente: x=0. 39, y=0. 58.

Si se dispone de una expresión analítica para la curva de equilibrio, solo se necesita igualar ambas expresiones (balance de masa y equilibrio) Por ejemplo, supongamos que el sistema tiene una volatilidad relativa constante de 2. 16. Entonces la solución se encuentra cuando se cumple que: Resolviendo se obtiene: x=0. 386, y=0. 576.

CONCLUSION � Que es y para que sirve?

BIBLIOGRAFIA � Operaciones unitarias en ingeniería química. Warren l. Mc. Cabe. Julián C. Smith. Sexta edición. pag. 693

GRACIAS POR SU ATENCION
 Universidad veracruzana campus xalapa
Universidad veracruzana campus xalapa Universidad veracruzana campus minatitlán
Universidad veracruzana campus minatitlán Facultad de ciencias quimicas unach
Facultad de ciencias quimicas unach Facultad de ciencias universidad mayor
Facultad de ciencias universidad mayor Universidad de el salvador facultad de ciencias economicas
Universidad de el salvador facultad de ciencias economicas Universidad de los andes facultad de ciencias
Universidad de los andes facultad de ciencias Unionpyme easy software contable gratuito
Unionpyme easy software contable gratuito Universidad de el salvador facultad de ciencias economicas
Universidad de el salvador facultad de ciencias economicas Universidad veracruzana en linea
Universidad veracruzana en linea Biblioteca universidad veracruzana
Biblioteca universidad veracruzana Facultad de ciencias físicas ucm
Facultad de ciencias físicas ucm Facultad de ciencias medicas y biologicas dr ignacio chavez
Facultad de ciencias medicas y biologicas dr ignacio chavez Facultad de ciencias economicas tucuman
Facultad de ciencias economicas tucuman Bangolou
Bangolou Facultad de ciencias economicas tucuman
Facultad de ciencias economicas tucuman Thick and thin malaria smear
Thick and thin malaria smear Facultad de ciencias agricolas uce
Facultad de ciencias agricolas uce Panam universidad
Panam universidad Universidad de carabobo facultad de odontologia
Universidad de carabobo facultad de odontologia Puño percusion positivo
Puño percusion positivo





































