UNIVERSIDAD NACIONAL AUTNOMA DE MXICO FACULTAD DE QUMICA


















- Slides: 27

UNIVERSIDAD NACIONAL AUTÓNOMA DE MÉXICO FACULTAD DE QUÍMICA ELECTROFORESIS EN GELES DE AGAROSA Arellano Sánchez Claudia Celene Bautista Pérez Sandra Kuri Pineda Antonio Elías Rojas Cortés Jennifer

Fundamento Electroforesis. «Electro» se refiere a la electricidad y «foresis» , del griego phoros, significa «trasladar» . � Separación de moléculas � Matriz tamponada (agarosa, acrilamida, almidón). � Separacion de las moléculas. � Campo eléctrico. � Tamaño y la carga neta que poseen. �

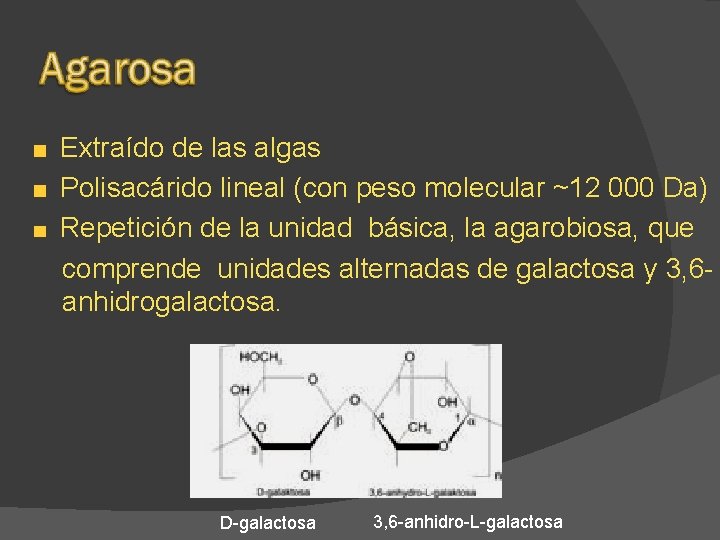
Extraído de las algas Polisacárido lineal (con peso molecular ~12 000 Da) Repetición de la unidad básica, la agarobiosa, que comprende unidades alternadas de galactosa y 3, 6 anhidrogalactosa. D-galactosa 3, 6 -anhidro-L-galactosa

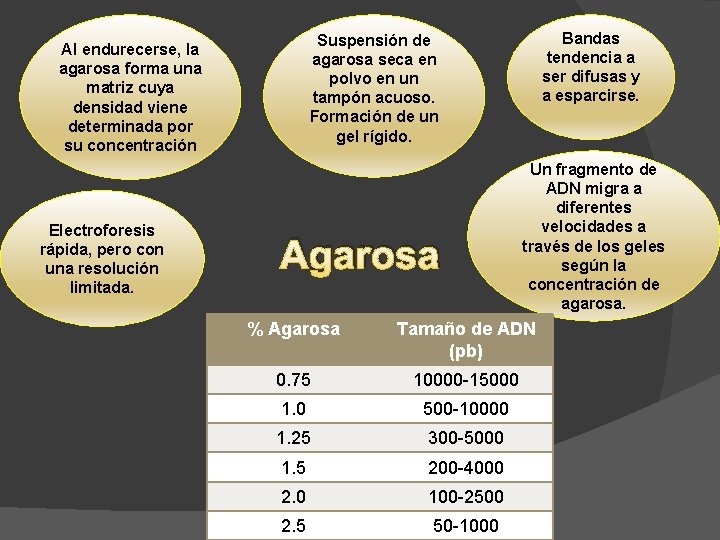
Electroforesis rápida, pero con una resolución limitada. Bandas tendencia a ser difusas y a esparcirse. Suspensión de agarosa seca en polvo en un tampón acuoso. Formación de un gel rígido. Al endurecerse, la agarosa forma una matriz cuya densidad viene determinada por su concentración Agarosa Un fragmento de ADN migra a diferentes velocidades a través de los geles según la concentración de agarosa. % Agarosa Tamaño de ADN (pb) 0. 75 10000 -15000 1. 0 500 -10000 1. 25 300 -5000 1. 5 200 -4000 2. 0 100 -2500 2. 5 50 -1000

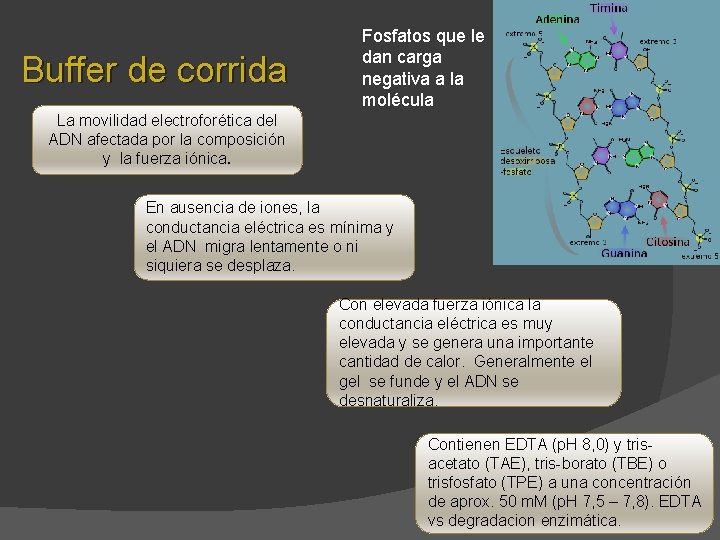
Buffer de corrida Fosfatos que le dan carga negativa a la molécula La movilidad electroforética del ADN afectada por la composición y la fuerza iónica. En ausencia de iones, la conductancia eléctrica es mínima y el ADN migra lentamente o ni siquiera se desplaza. Con elevada fuerza iónica la conductancia eléctrica es muy elevada y se genera una importante cantidad de calor. Generalmente el gel se funde y el ADN se desnaturaliza. Contienen EDTA (p. H 8, 0) y trisacetato (TAE), tris-borato (TBE) o trisfosfato (TPE) a una concentración de aprox. 50 m. M (p. H 7, 5 – 7, 8). EDTA vs degradacion enzimática.

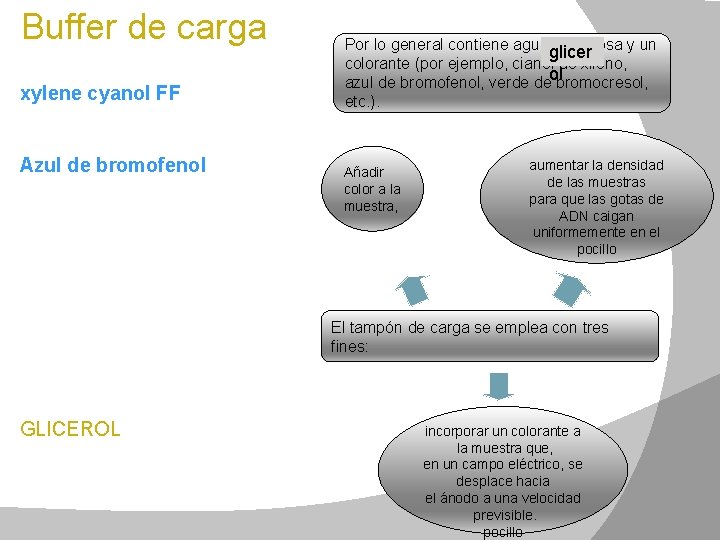
Buffer de carga xylene cyanol FF 1) Migra a aprox 4 Kb; Azul de bromofenol 1) Ayuda a visualizar que la muestra este migrando en el gel 2) migra a una velocidad equivalente a si tuviera un peso de 200 a 400 pb DNA (depende del porcentaje de la agarosa) GLICEROL Añade densidad a la muestra Por lo general contiene agua, sacarosa y un glicer colorante (por ejemplo, cianol de xileno, ol azul de bromofenol, verde de bromocresol, etc. ). Añadir color a la muestra, aumentar la densidad de las muestras para que las gotas de ADN caigan uniformemente en el pocillo El tampón de carga se emplea con tres fines: incorporar un colorante a la muestra que, en un campo eléctrico, se desplace hacia el ánodo a una velocidad previsible. pocillo

Para cuantificar y visualizar el DNA se usan agentes colorantes fluorescentes, los cuales aumentan notablemente su emisión cuando se unen a la doble hélice. Son agentes intercalantes que se introducen entre las bases del DNA. Generalmente son policíclicos aromáticos, hidrofobos y planares: a) BROMURO DE ETIDIO b) SYBR Safe DNA gel staining (invitrogen)

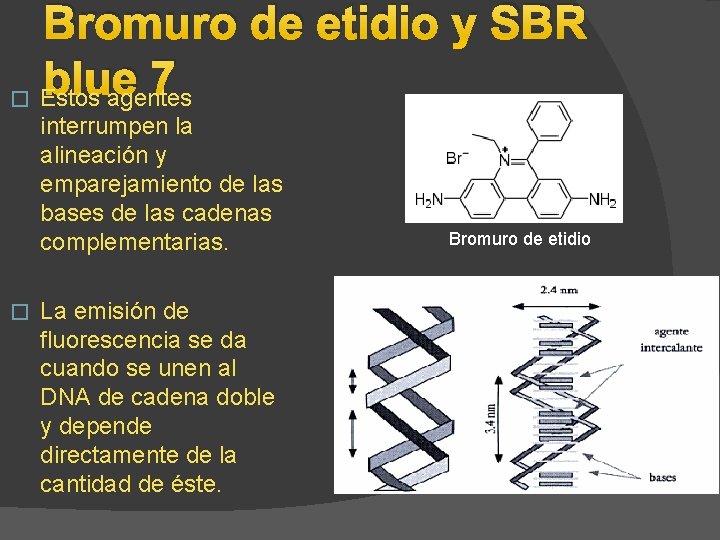
Bromuro de etidio y SBR blue 7 � Estos agentes interrumpen la alineación y emparejamiento de las bases de las cadenas complementarias. � La emisión de fluorescencia se da cuando se unen al DNA de cadena doble y depende directamente de la cantidad de éste. Bromuro de etidio

Bromuro de etidio y SBR blue 7 Generalmente se usa en la detección de DNA de doble cadena en PCR en tiempo real. Es estable a un amplio rango de temperaturas. Es 25 veces más sensible que el bromuro de etidio. Es el más utilizado en biología molecular Teratogénico Puede causar metahemoglobinemia

Se trata de reactivos mutagénicos, por lo que se deben trabajar con equipo de seguridad. El material contaminado con ellos generalmente se trata con nitrito sódico y ácido hipofosforoso para su degradación. También son usados en PCR, citometría de flujo y separación de ácidos nucleicos por ultracentrifugación.

COMPARACIÓN DE ELECTROFORESIS EN GEL DE AGAROSA Y EN GEL DE POLIACRILAMIDA-SDS

Electroforesis en gel Utiliza como soporte un gel de poliacrilamida o agarosa. Las moléculas se separan de acuerdo con su tamaño por su efecto de filtración por geles, y también se separan por su carga. Para teñir a las moléculas sujetas a separación se usan a) colorantes, b) autorradiografía o c) Western blot.

En el DNA, las diferencias de carga no son suficientes para determinar una separación eficaz. ESENCIALMENTE CARGADO NEGATIVAMENTE (FOSTATOS) Electroforesis en gel: la forma y la carga son menos importantes, y la longitud molecular es el determinante crítico de la velocidad de migración. EN PRESENCIA DE SDS

Gel de agarosa Es más frecuentemente usado para separar ácidos nucleicos. Gel de poliacrilamida-SDS Es más frecuentemente usado para separar proteínas.

Cuando se separa DNA Gel de agarosa Gel de poliacrilamida-SDS En ambos casos, el gel se prepara con distintas concentraciones en función del tamaño de los fragmentos de DNA que se quieren separar. � Los fragmentos de DNA que puede separar son de hasta 20 kpb (más grandes). � Se usan para separar fragmentos de ADN más pequeños (aproximadamente hasta 1000 pb), ya que tienen mayor poder de resolución.

Cuando se separan proteínas Gel de poliacrilamida-SDS Gel de agarosa � Separa a la proteína únicamente basado en la carga molecular neta. � No separa proteínas con diferentes tamaños pero con cargas similares. Separa proteínas basado tanto en carga eléctrica como en tamaño molecular. Separa proteínas con diferentes tamaños pero con cargas similares. Mayor resolución que la que se obtiene en un gel de agarosa.

Gel de agarosa Corren en forma horizontal (submarina. ) Gel de poliacrilamida-SDS Suelen emplearse en forma vertical.

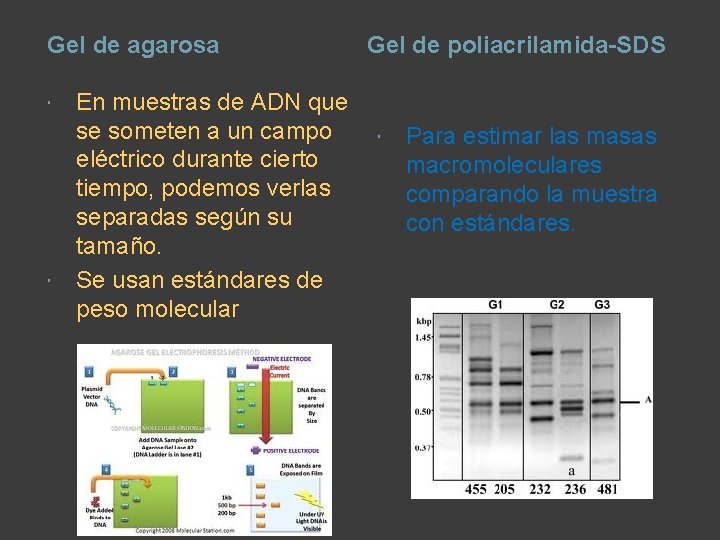
Gel de agarosa En muestras de ADN que se someten a un campo eléctrico durante cierto tiempo, podemos verlas separadas según su tamaño. Se usan estándares de peso molecular Gel de poliacrilamida-SDS Para estimar las masas macromoleculares comparando la muestra con estándares.

Gel de agarosa Aplicaciones: El análisis de fragmentos de polimorfismos de longitud de fragmentos de restricción. Análisis de experimentos de DNA recombinante. Purificación de sondas para ISH. Hibridación por escisión de fragmentos de DNA de un gel seguidos por purificación en minicolumna. Análisis del punto final de PCR. Ensayos RT-PCR (detección de patógenos). Gel de poliacrilamida Aplicaciones: El análisis de fragmentos del punto final de PCR en el cual el tamaño de los fragmentos sea ligeramente diferentes.

Preparación del gel de agarosa Sellar con cinta adhesiva el contorno de la bandeja de gel, colocar el peine. Pesar 0. 42 g de agarosa en un matraz Erlenmeyer, añadir 35 m. L de buffer TAE 1 X. Tapar con algodón y calentar en microondas hasta que la agarosa se disuelva bien o 1 a 3 min. Una vez que la temperatura sea entre 45 y 60°C, añadir 2 μL de bromuro de etidio. Depositar el gel en la bandeja de la cámara y dejar polimerizar. Quitar la cinta adhesiva y colocar la bandeja en la cámara de electroforesis. Añadir el amortiguador TAE.

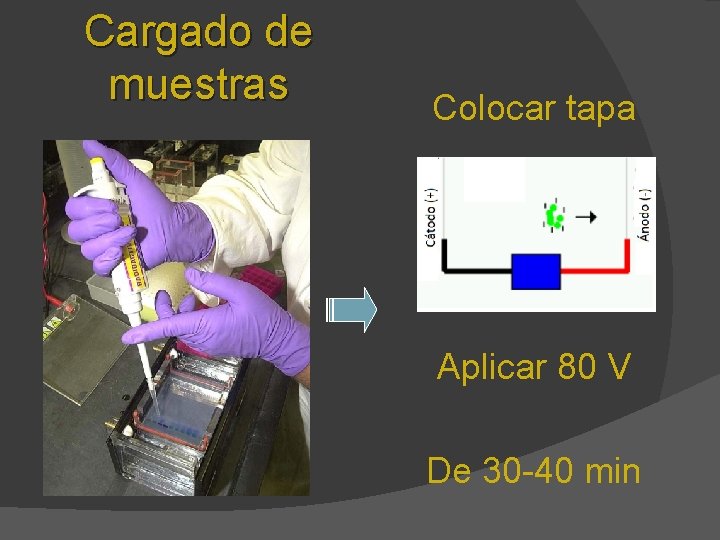
Preparación y cargado de muestras

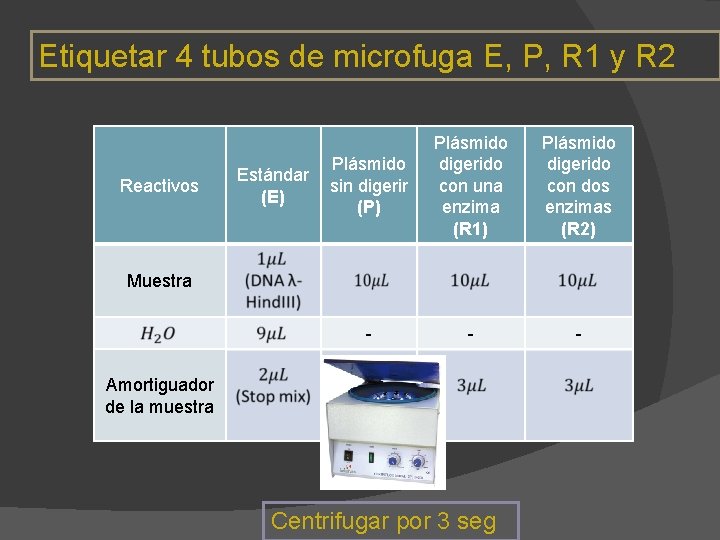
Etiquetar 4 tubos de microfuga E, P, R 1 y R 2 Reactivos Estándar (E) Plásmido sin digerir (P) Plásmido digerido con una enzima (R 1) Plásmido digerido con dos enzimas (R 2) - - - Muestra Amortiguador de la muestra Centrifugar por 3 seg

Cargado de muestras Colocar tapa Aplicar 80 V De 30 -40 min

Detección de las bandas: 1. Colocar gel sobre un transiluminador, encender la lámpara de UV 2. Visualizar bandas de DNA 3. Tomar fotografía 4. Determinar el peso molecular de las bandas

Std de peso molecular: Lambda Hind. III Ladder λ Hind. III DNA Ladder se preparar por restricción del fago seguido de la inactivación de la enzima. Los 7 fragmentos 564 base pairs a 23. 13 kilobases. 564, 2027, 2322, 4361, 6557, 9416, 23130 bp

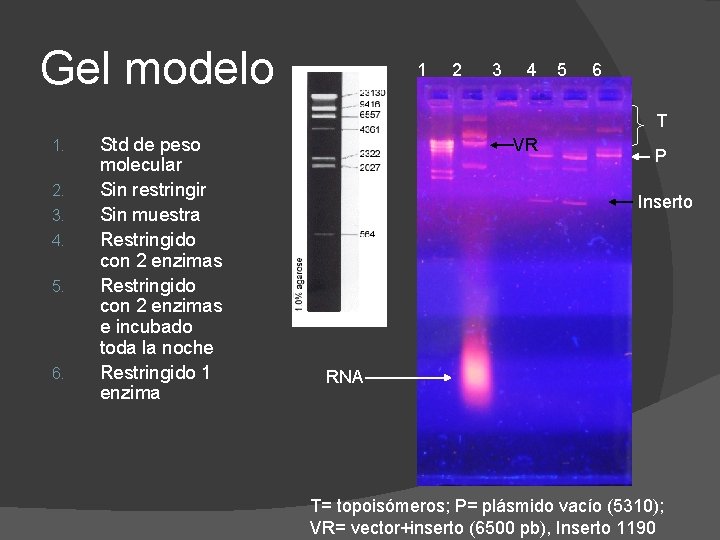
Gel modelo 1 2 3 4 5 6 T 1. 2. 3. 4. 5. 6. Std de peso molecular Sin restringir Sin muestra Restringido con 2 enzimas e incubado toda la noche Restringido 1 enzima VR P Inserto RNA T= topoisómeros; P= plásmido vacío (5310); VR= vector+inserto (6500 pb), Inserto 1190

Bibliografía Lizcano Losada F. ; Fundamentos moleculares en medicina. El manual moderno, España, 2005. p 41 -43. Mendoza DF. Practicas de Laboratorio de Biologia Molecular: Su Aplicación en Genetica Básica. Editorial de Universidad del Rosario, Colombia, 2010. p 58 -62 Luque Cabrera J. Texto ilustrado de biología molecular e ingeniería genética. Elsevier, España, 2001. p 138.
 Estadio azteca mapa virtual
Estadio azteca mapa virtual Universidad de los andes facultad de ciencias
Universidad de los andes facultad de ciencias Holtler
Holtler Universidad austral medicina
Universidad austral medicina Unionpyme easy software contable gratuito
Unionpyme easy software contable gratuito Universidad de carabobo facultad de derecho
Universidad de carabobo facultad de derecho Universidad de carabobo facultad de odontologia
Universidad de carabobo facultad de odontologia Panam universidad
Panam universidad Universidad san martin de porres facultad de derecho
Universidad san martin de porres facultad de derecho Signo de puño percusion
Signo de puño percusion Universidad de el salvador facultad de ciencias economicas
Universidad de el salvador facultad de ciencias economicas Facultad de informatica universidad de panama
Facultad de informatica universidad de panama Facultad de ciencias universidad mayor
Facultad de ciencias universidad mayor Universidad javeriana - facultad de medicina
Universidad javeriana - facultad de medicina Universidad austral de chile medicina
Universidad austral de chile medicina Universidad de el salvador facultad de ciencias economicas
Universidad de el salvador facultad de ciencias economicas Universidad de panama azuero
Universidad de panama azuero Universidad nacional de ingenieria
Universidad nacional de ingenieria Foda de una universidad nacional
Foda de una universidad nacional Universidad nacional de piura postgrado
Universidad nacional de piura postgrado Competencias abet
Competencias abet Angel maria camponeschi
Angel maria camponeschi Universidad nacional de piura maestrias
Universidad nacional de piura maestrias Diplomados universidad nacional de trujillo
Diplomados universidad nacional de trujillo Universidad nacional de piura beca 18
Universidad nacional de piura beca 18 Universidad nacional de tumbes segunda especialidad
Universidad nacional de tumbes segunda especialidad Universidad nacional de loja
Universidad nacional de loja Universidad nacional de ingenieria
Universidad nacional de ingenieria