UNIVERSIDAD DE SAN CARLOS DE GUATEMALA ESCUELA DE













- Slides: 20

UNIVERSIDAD DE SAN CARLOS DE GUATEMALA ESCUELA DE FORMACIÓN DE PROFESORES DE ENSEÑANZA EFPEM CÁTEDRA: QUÍMICA II CATEDRÁTICO: LIC. RAÚL HERNÁNDEZ Manuel Castro Sincú Carné: 200721370 FÍSICA/MATEMÁTICA Plan Sabatino Sección B 28 -07 -07

NOMENCLATURA • Nomenclatura química: Son reglas y regulaciones que rigen la designación de las sustancias químicas.

LOS SISTEMAS DE NOMENCLATURA SE DIVIDEN EN: l Sistema Clásica. l Sistema Estequiométrico. l Sistema Stock.

SISTEMA DE NOMENCLATURA ESTEQUIOMÉTRICA Compuestos formados por: § Dos NO METALES. +4, 2 -2 C o EL mas electronegativo se escribe de lado derecho. Después se cruzan las valencias del primer elementos con el otro y viceversa. C O 2 2 co 2 4 CO co 2 Estos se obtiene didividiendo los cocientes Numéricos en 2 hasta Llegar a su mínima expresión

PREFIJOS UTILIZADO EN LA NOMENCLATURA ESTEQUIOMÉTRICA Mono, di, tri, tetra, penta, hexa, hepta, … NOMBRE GENÉRICO: Óxido.

En el caso anterior del: CO, se le nombra MONOXIDO DE MONOCARBONO (MONOXIDO DE CARBONO) Por estar compuesto de 1 átomo óxigeno y 1 átomo de carbono. Y en el CO 2, se le nombra DIÓXIDO DE MONOCARBONO (Se sustituye Mono al carbono por buena expresión y queda) DIOXIDO DE CARBONO. 2 átomos de oxígeno y 1 de carbono.

Otros ejemplos: +3 -2 N O N 2 O 3 Trióxido de Dinitrógeno (3 átomos de oxígeno y 2 de nitrógeno) o +5 -2 NO N 2 O 5 Pentaóxido de dinitrógeno. (5 átomos de oxígeno y 2 de nitrógeno) +3 -1 P Cl 3 Tricloruro de fósforo. (3 átomos de cloro y 1 de fósforo) +5 -1 P Cl 5 Pentacloruro de fósforo. (5 átomos de cloro y 1 de fósforo)

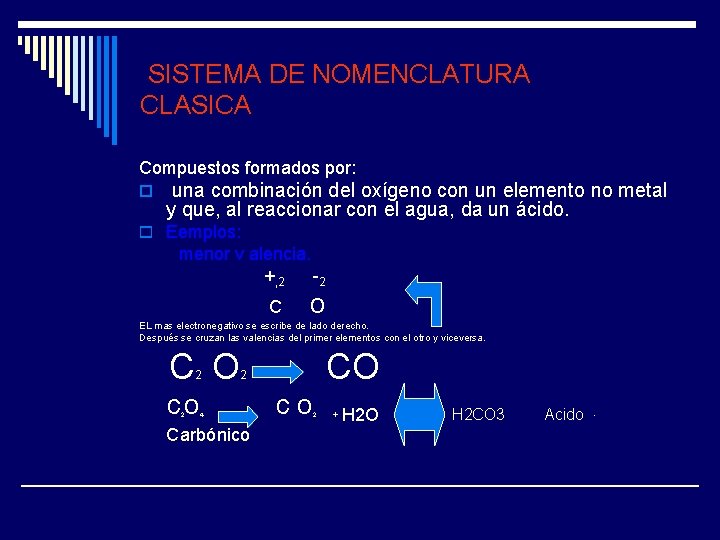
SISTEMA DE NOMENCLATURA CLASICA Compuestos formados por: o una combinación del oxígeno con un elemento no metal y que, al reaccionar con el agua, da un ácido. o Eemplos: menor v alencia. +, 2 -2 C o EL mas electronegativo se escribe de lado derecho. Después se cruzan las valencias del primer elementos con el otro y viceversa. C O 2 co 2 CO 2 4 Carbónico co 2 + H 2 O H 2 CO 3 Acido -

ESTADOS DE OXIDACIÓN QUE FORMAN ANHÍDRIDOS C+2 N+3 +5 o F S+4 +6 Cl+1+3 +5 +2 As+3 +5 Se+4 +6 Br Sb+3 +5 Te+4 +6 I P+3 + 5

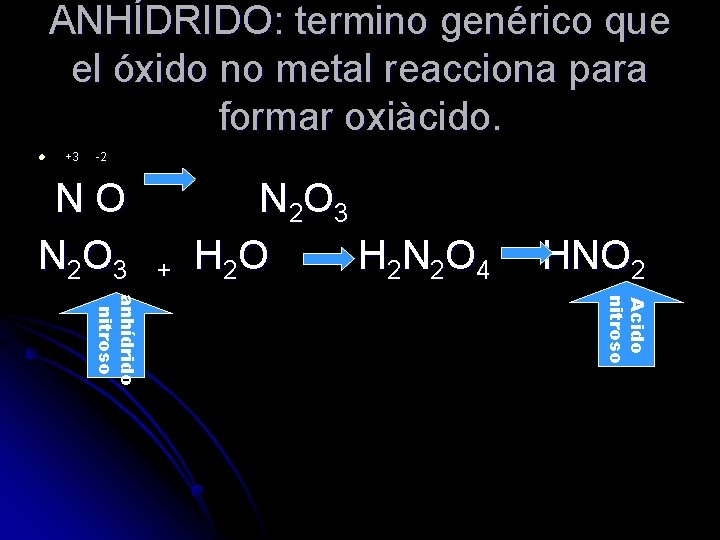
ANHÍDRIDO: termino genérico que el óxido no metal reacciona para formar oxiàcido. l +3 -2 NO N 2 O 3 + N 2 O 3 H 2 O H 2 N 2 O 4 HNO 2 Acido nitroso anhídrido nitroso

FORMULA GENERAL DE UN OXIÁCIDO. HIDROGENO H NO METAL X? OXÍGENO O

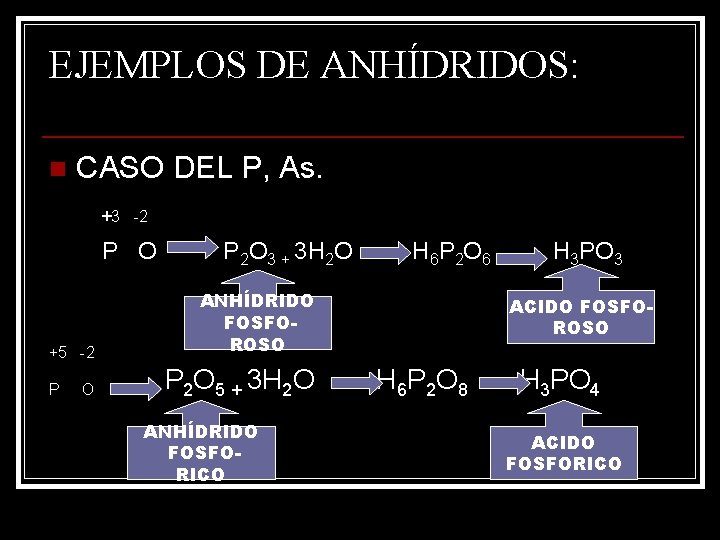
EJEMPLOS DE ANHÍDRIDOS: n CASO DEL P, As. +3 -2 P O +5 -2 P O P 2 O 3 + 3 H 2 O H 6 P 2 O 6 ANHÍDRIDO FOSFOROSO P 2 O 5 + 3 H 2 O ANHÍDRIDO FOSFORICO H 3 PO 3 ACIDO FOSFOROSO H 6 P 2 O 8 H 3 PO 4 ACIDO FOSFORICO

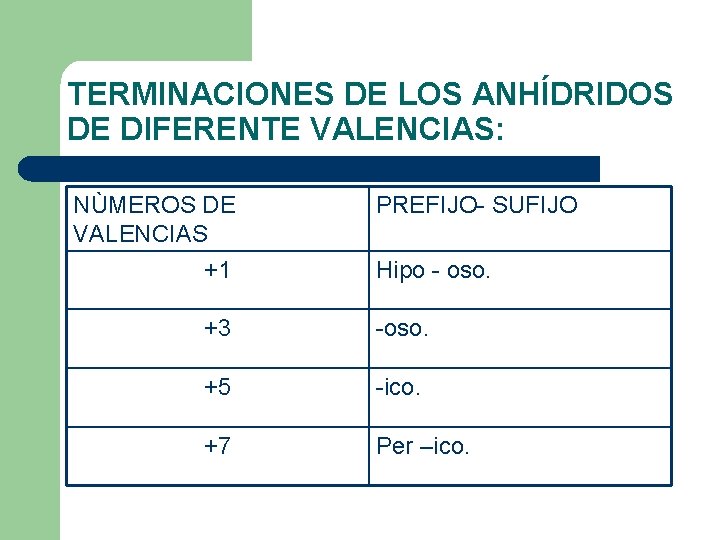
TERMINACIONES DE LOS ANHÍDRIDOS DE DIFERENTE VALENCIAS: NÙMEROS DE VALENCIAS PREFIJO- SUFIJO +1 Hipo - oso. +3 -oso. +5 -ico. +7 Per –ico.

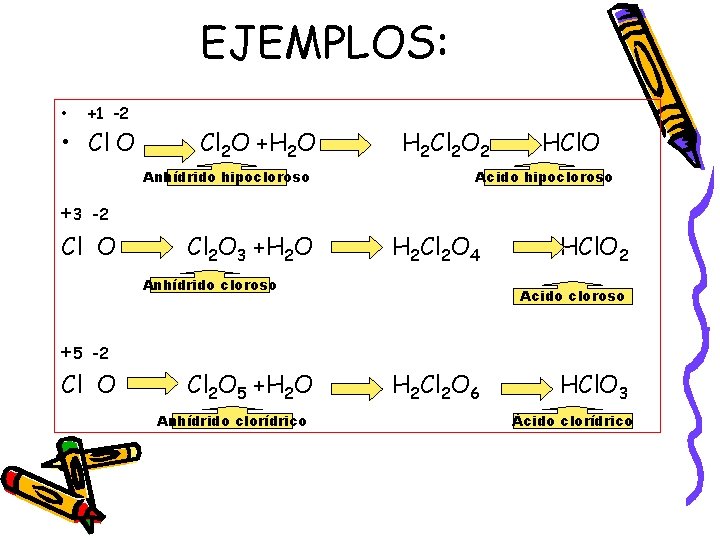
EJEMPLOS: • +1 -2 • Cl O Cl 2 O +H 2 O Anhídrido hipocloroso +3 -2 Cl O Cl 2 O 3 +H 2 O H 2 Cl 2 O 2 Acido hipocloroso H 2 Cl 2 O 4 Anhídrido cloroso +5 -2 Cl O Cl 2 O 5 +H 2 O Anhídrido clorídrico HCl. O 2 Acido cloroso H 2 Cl 2 O 6 HCl. O 3 Ácido clorídrico

SISTEMA DE NOMENCLATURA STOCK En la nomenclatura de Stock no se utilizan los prefijos: al nombre del metal se le añade su valencia, aunque ésta se omite cuando es única; por ejemplo, Mg(OH)2, hidróxido de magnesio.

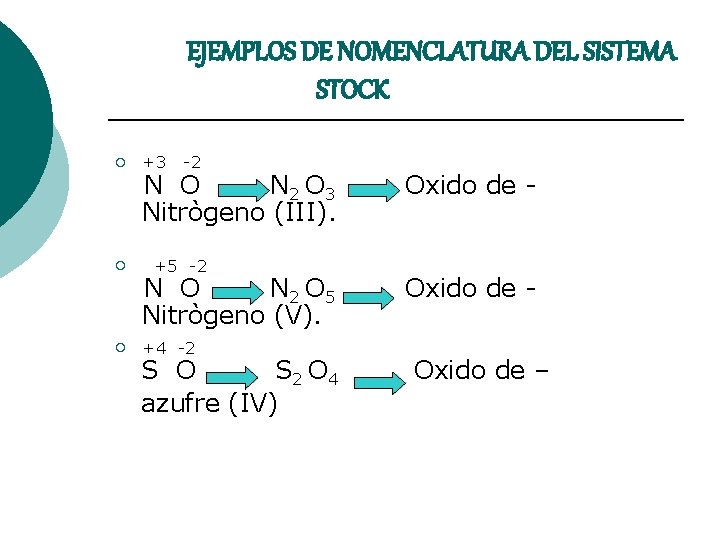
EJEMPLOS DE NOMENCLATURA DEL SISTEMA STOCK ¡ ¡ ¡ +3 -2 N O N 2 O 3 Nitrògeno (III). +5 -2 N O N 2 O 5 Nitrògeno (V). +4 -2 S O S 2 O 4 azufre (IV) Oxido de - Oxido de –

COMPUESTOS BINARIOS FORMADOS POR: METAL + NO METAL. n n 1. Metal Con Estado de Oxidación Fijo. Metal Con Estado de Oxidación variable. M. E. O. Fijo: Estos elementos pertenece a los elementos del grupo: IA +1 IIA +2

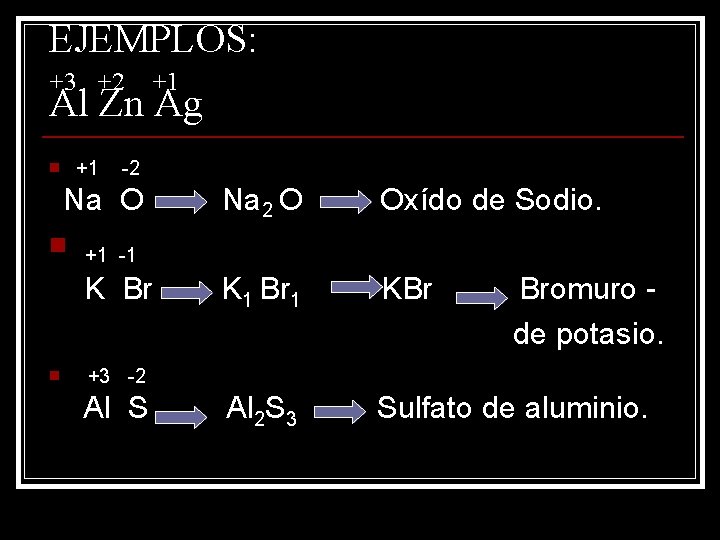
EJEMPLOS: +3 +2 +1 Al Zn Ag n +1 -2 Na O Na 2 O Oxído de Sodio. K 1 Br 1 KBr Al 2 S 3 Sulfato de aluminio. n +1 -1 K Br n Bromuro de potasio. +3 -2 Al S

ESTADO DE OXIDACION VARIABLE: EJEMPLOS: l +2 +3 +6 Fe +2 -1 Fe Cl +3 Fe Cl 2 -1 Fe Cl 3 Cloruro de Hierro (II) ó Cloruro ferroso. Cloruro de Hierro (III) ó Cloruro Ferrico.

Fin de presentación de diapositiva espero que te haya gustado y aprendido bastante … n recuerde que el tiempo avanza… apresure aproveche las oportunidades que se presenta cada dia… n
 Himno universitario gaudeamus igitur letra
Himno universitario gaudeamus igitur letra Glucósidos propiedades
Glucósidos propiedades Escudo de universidad de san carlos
Escudo de universidad de san carlos Universidad san carlos
Universidad san carlos Universidad san carlos
Universidad san carlos Escuela de enfermeria san pedro claver
Escuela de enfermeria san pedro claver Escuela dominical asambleas de dios 2021 guatemala
Escuela dominical asambleas de dios 2021 guatemala Escuela internacional de posgrado universidad de sevilla
Escuela internacional de posgrado universidad de sevilla Escuela internacional posgrado sevilla
Escuela internacional posgrado sevilla Escuela de postgrado universidad andina del cusco
Escuela de postgrado universidad andina del cusco Escuela secundaria carlos marx 214
Escuela secundaria carlos marx 214 Hacer de una escuela una buena escuela
Hacer de una escuela una buena escuela Caracteristicas pedagogia tradicional
Caracteristicas pedagogia tradicional Escuela nueva y escuela tradicional
Escuela nueva y escuela tradicional Didactica tradicional
Didactica tradicional Cideh universidad de san buenaventura
Cideh universidad de san buenaventura Persona trabajando en fabrica
Persona trabajando en fabrica Universidad pedagogica sps
Universidad pedagogica sps Logo universidad mayor de san andres
Logo universidad mayor de san andres Aulica don bosco san luis
Aulica don bosco san luis Himno de la universidad nacional mayor de san marcos
Himno de la universidad nacional mayor de san marcos