UNIVERSIDAD AUTONOMA DE CHIHUAHUA FACULTAD DE CIENCIAS QUIMICAS























- Slides: 39

UNIVERSIDAD AUTONOMA DE CHIHUAHUA. FACULTAD DE CIENCIAS QUIMICAS. BIOLOGIA MOLECULAR. Replicación del ADN en Procariotas 3. 2. 1 JOSE ALFREDO SOTO ALONSO 212679

INDICE Mecanismos general Propiedades Replicacion en procariotas Mecanismo Maquinaria enzimatica Inicio, enlongacion, replisoma y terminacion Mecanismos de reparacion Replicacion de ADN in vitro

Es el proceso en la cuál una molécula de ADN de doble hélice da lugar a otras dos moléculas de ADN con la misma secuencia de bases

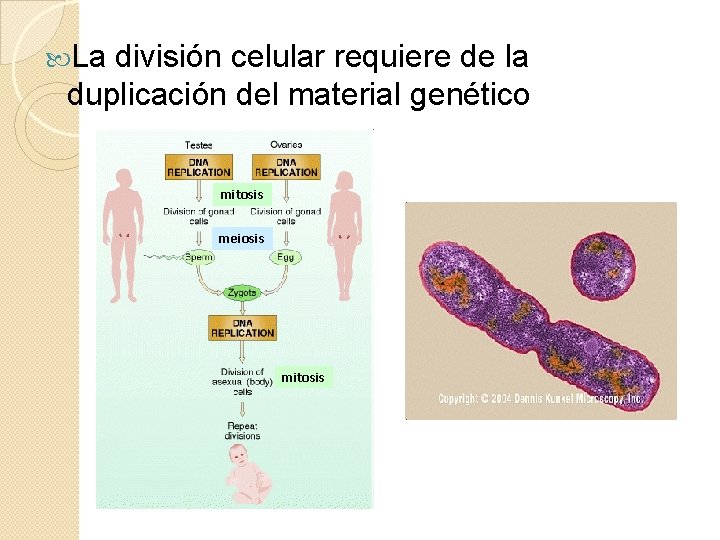
La división celular requiere de la duplicación del material genético mitosis meiosis mitosis

Mecanismo general La misma estructura del ADN sugirió un mecanismo de replicación de la información ◦ Cada hebra sirve como molde para replicar la complementaria

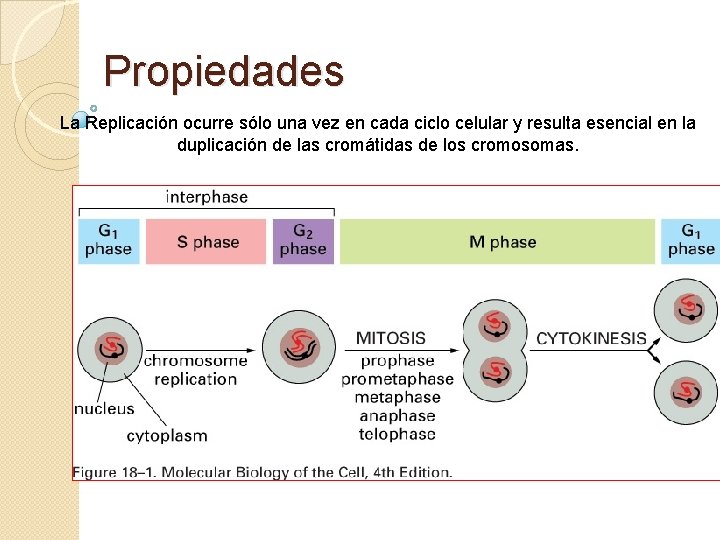
Propiedades La Replicación ocurre sólo una vez en cada ciclo celular y resulta esencial en la duplicación de las cromátidas de los cromosomas.

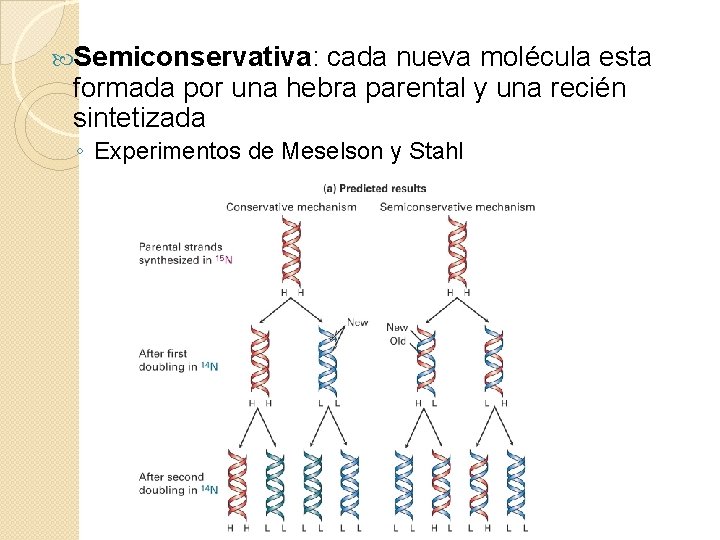
Semiconservativa: cada nueva molécula esta formada por una hebra parental y una recién sintetizada ◦ Experimentos de Meselson y Stahl

Ø Se utilizaron bacterias de Escherichia coli cultivadas en medio con isótopos de N (N 15 y N 14). Ø Se purificó ADN utilizando una gradiente de densidad (Cs. Cl)

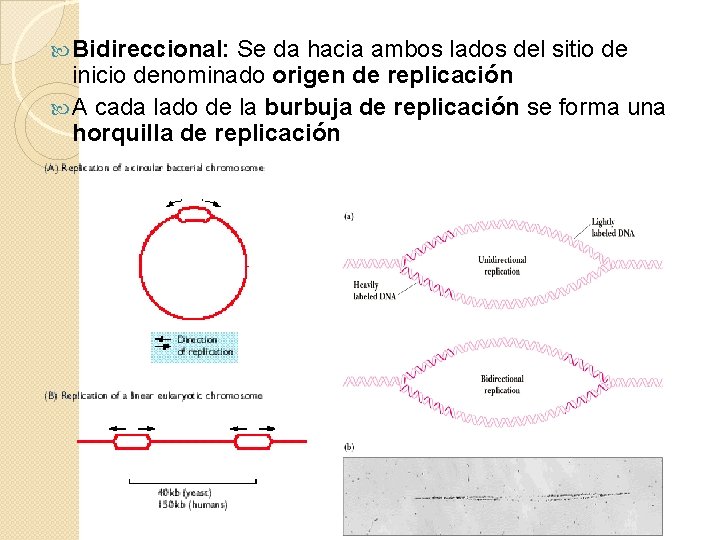
Bidireccional: Se da hacia ambos lados del sitio de inicio denominado origen de replicación A cada lado de la burbuja de replicación se forma una horquilla de replicación

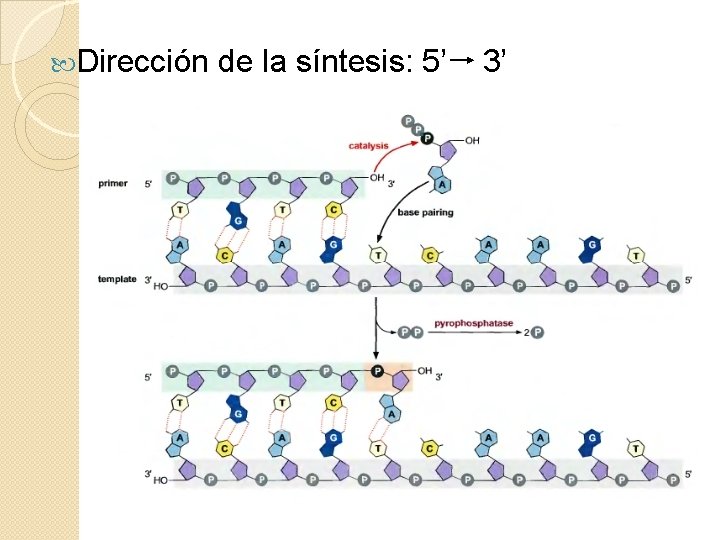
Dirección de la síntesis: 5’ 3’

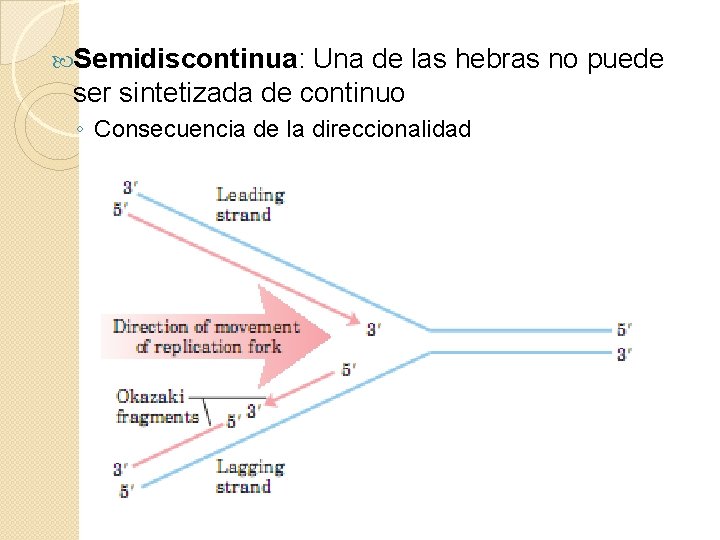
Semidiscontinua: Una de las hebras no puede ser sintetizada de continuo ◦ Consecuencia de la direccionalidad

Replicación en procariotas

Mecanismo Inicio ◦ Reconocimiento de orígenes de replicación. ◦ Separación de hebras. ◦ Posicionamiento de maquinaria transcripcional. Elongación ◦ Crecimiento bidireccional de las horquillas de replicación. ◦ Replicación semiconservativa, semidiscontinua, coordinada. Terminación ◦ Reconocimiento de señales de terminación. ◦ Desensamble de replisomas.

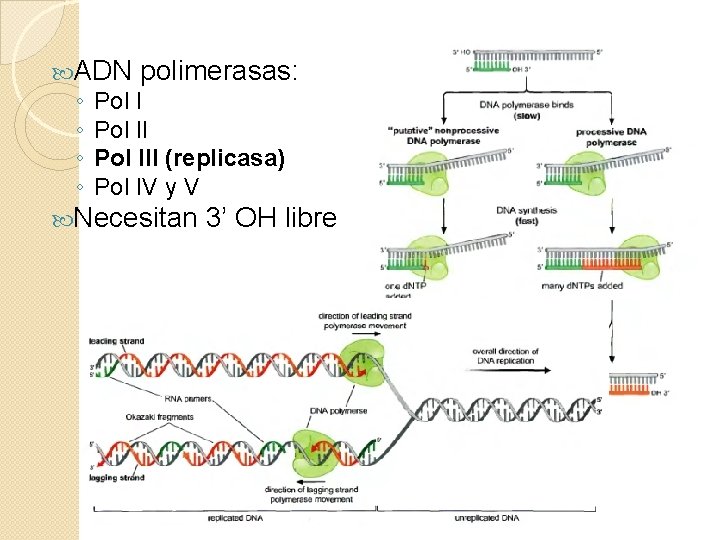
ADN polimerasas: ◦ Pol III (replicasa) ◦ Pol IV y V Necesitan 3’ OH libre

DNA POLIMERASA II Con actividad exonucleasa 3’ 5’ está involucrada en procesos de reparación de DNA frente a un daño térmico o por radiación. DNA POLIMERASA III Esta es la enzima que realiza el proceso replicativo, su función es la síntesis de DNA. También cuenta con actividad revisora, 3’ 5’


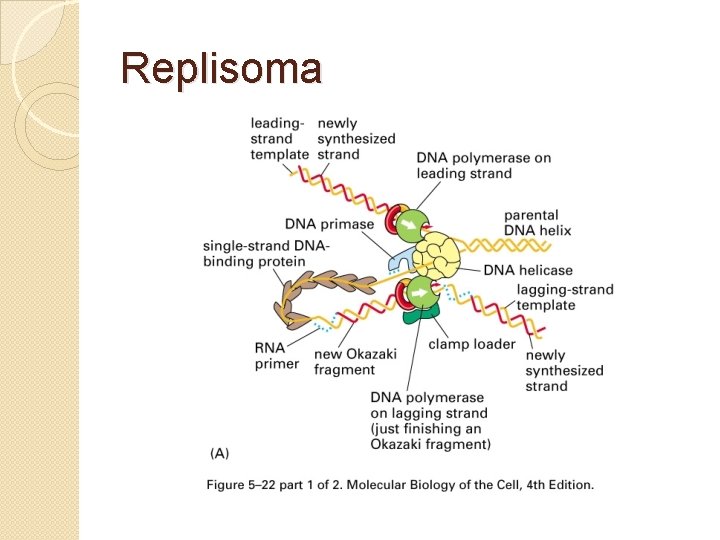
Maquinaria enzimática ADN polimerasas: Síntesis de ADN Primasas: Generación 3’OH libres Ligasas: Unión los fragmentos de Okazaki Helicasas: Separación de hebras Topoisomerasas: Mantenimiento del grado de superenrollamiento SSBs: Mantenimiento de simples hebras

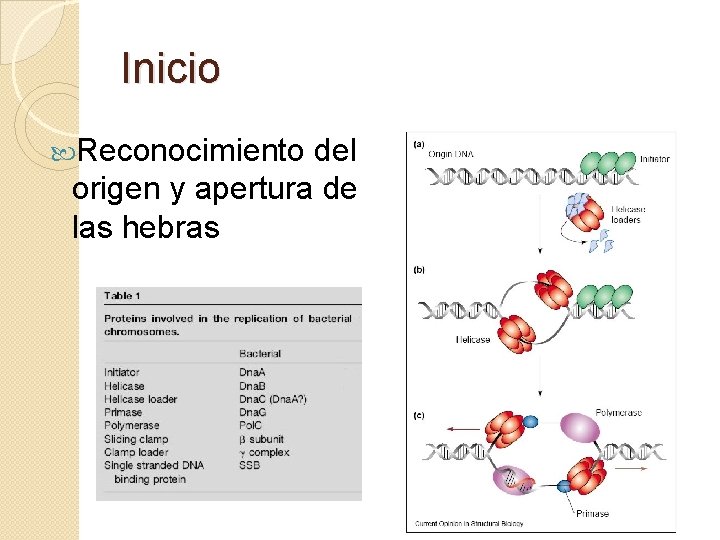
Inicio Reconocimiento del origen y apertura de las hebras

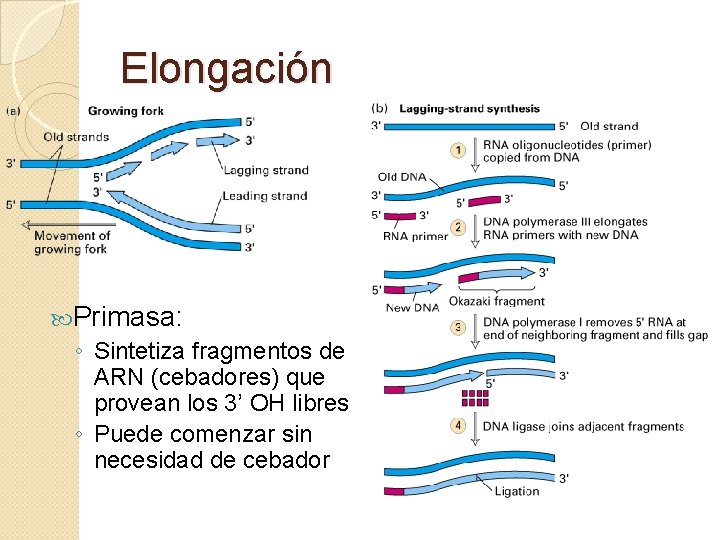
Elongación Primasa: ◦ Sintetiza fragmentos de ARN (cebadores) que provean los 3’ OH libres ◦ Puede comenzar sin necesidad de cebador

Replisoma

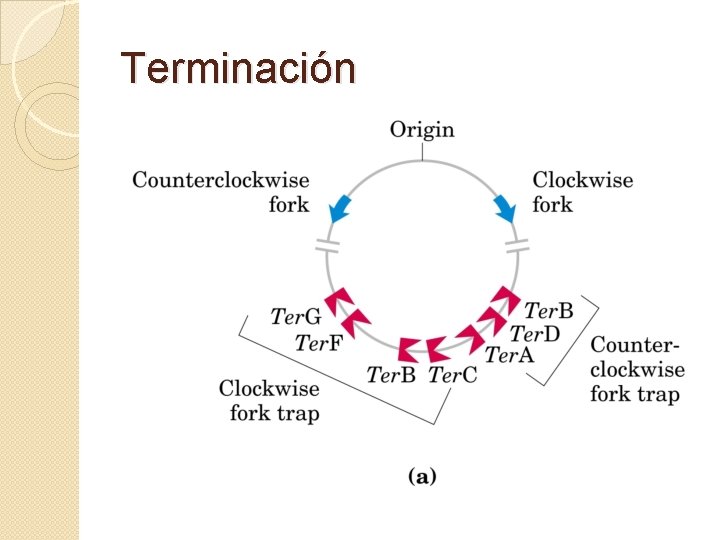
Terminación

Mecanismos de reparación Las propias replicasas son capaces de reparar sus errores durante la elongación: ◦ actividad correctora de prueba (proofreading) ◦ Implica una actividad exonucleasa 3’ 5’

Mecanismos de reparación

Replicación de ADN in-vitro: PCR Permite la amplificación de un fragmento de ADN de interés Algunas aplicaciones: ◦ ◦ ◦ Clonado acelular de moléculas de ADN Detección de secuencias sin purificación previa Análisis de expresión génica Secuenciación de ácidos nucleicos Amplificación de ADN para su posterior clonación celular Aplicaciones en medicina: Diagnostico de enfermedades hereditarias/infecciosas Diagnóstico parental (amniocentesis, vellosidades coriónicas) Tipado de tejidos para transplantes Detección de células tumorales Estudios de asociación genotipo-fenotipo ◦ Técnicas forenses: huellas genéticas (Identificación de polimorfismos) Identificación individual Tests de paternidad ◦ Filogenia ◦ Análisis de genética poblacional

Reacción de replicación invitro: Molde ADN polimerasa: Taq polimerasa (termoestable) Cebadores: ◦ 3’ OH libre ◦ Definen la región a amplificar d. NTPs (A, C, G, T) Condiciones para el funcionamiento de la enzima: ◦ Buffer ◦ Mg++ (cofactor de la enzima)

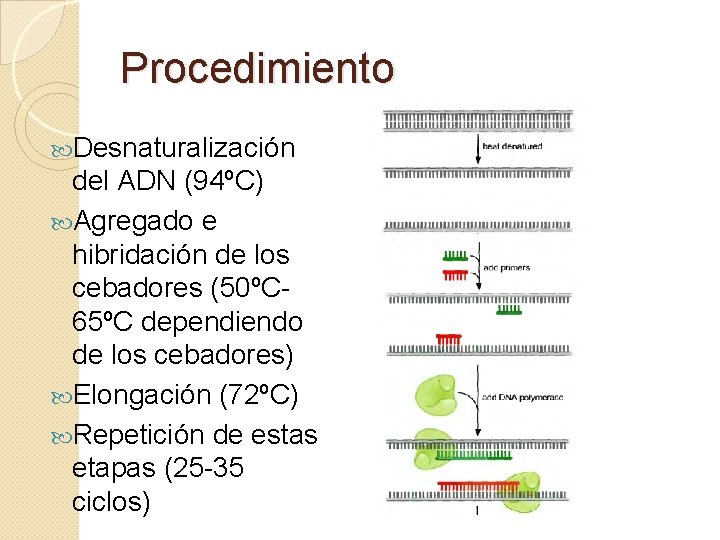
Procedimiento Desnaturalización del ADN (94ºC) Agregado e hibridación de los cebadores (50ºC 65ºC dependiendo de los cebadores) Elongación (72ºC) Repetición de estas etapas (25 -35 ciclos)

Luego de terminados los ciclos se obtienen millones de moléculas de la región blanco La hace una técnica extremadamente sensible ◦ Ventaja: se puede amplificar ADN partiendo de muy poco material ◦ Desventaja: Contaminaciones

Variantes del método rt- PCR: ◦ Se usa una transcriptasa reversa para pasar una muestra de ARN a ADN obteniendose ADN copia (ADNc) ◦ Se realiza un PCR para amplificar el ADNc de interés ◦ Estudios de expresión génica ◦ Clonado de genes eucariotas (eliminación de intrones)

PCR cuantitativo (real time PCR, q. PCR): ◦ Se diferencia en que en cada ciclo de amplificación se cuantifica la cantidad de ADN obtenida ◦ Permite inferir la cantidad de moléculas de molde que existía originalmente en la muestra: Cuantificación de la expresión génica Cuantificación de microorganismos

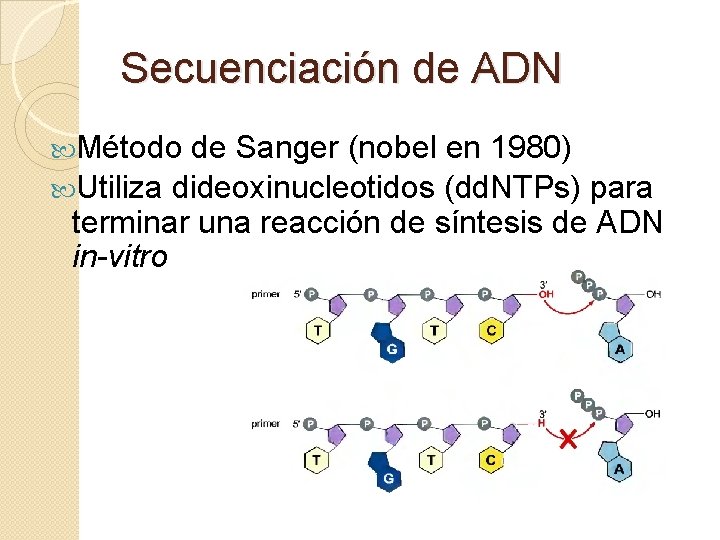
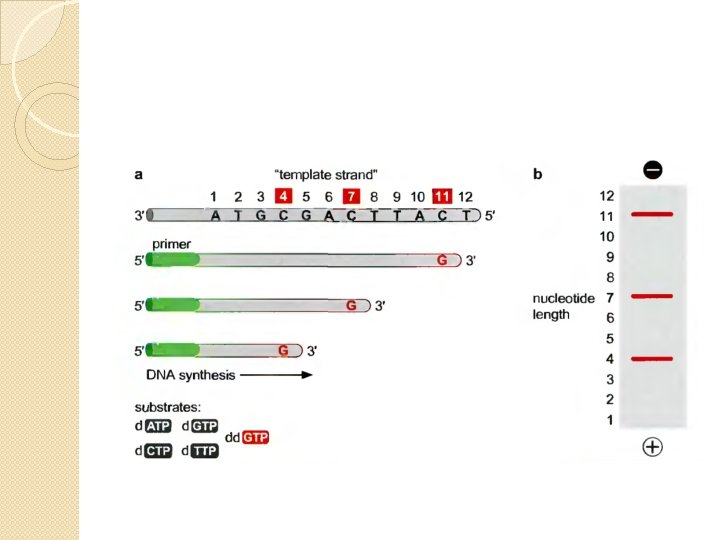
Secuenciación de ADN Método de Sanger (nobel en 1980) Utiliza dideoxinucleotidos (dd. NTPs) para terminar una reacción de síntesis de ADN in-vitro


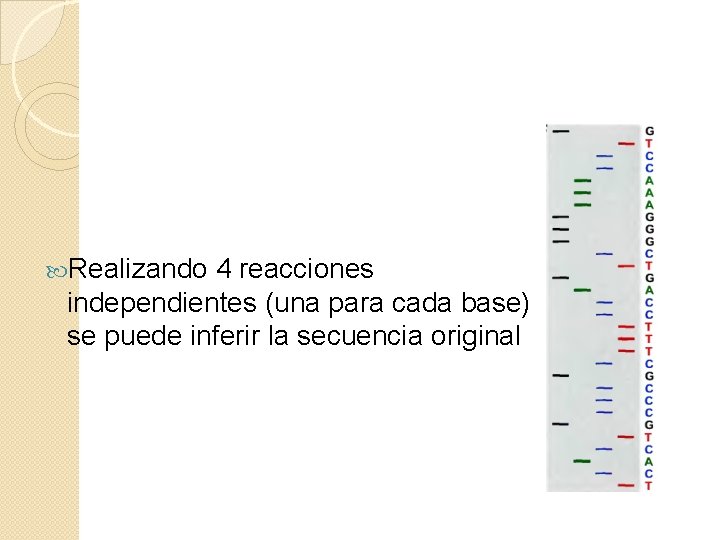
Realizando 4 reacciones independientes (una para cada base) se puede inferir la secuencia original

Secuenciación automática Sigue el mismo principio A diferencia del método anterior cada dd. NTP se marca con una molecula fluorescente diferente Esto permite realizar una unica reaccion en la cual estan presentes los 4 dd. NTPs marcados Los fragmentos obtenidos se separan por electroforesis capilar La detección se realiza en un punto fijo al final de la corrida


Secuenciación de genomas Cada reacción de secuencia es capaz de leer unas 500 pb Como se obtuvo la secuencia continua del conjunto de los cromosomas humanos? Cada cromosoma tiene en promedio 150 Mb (genoma completo 109)

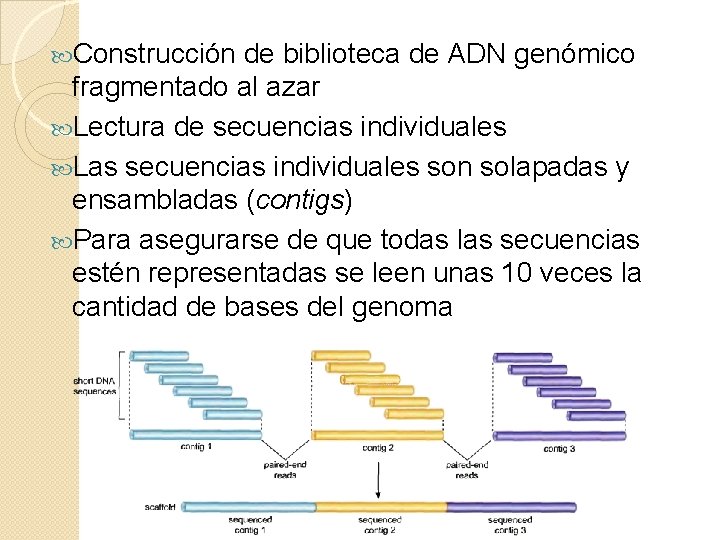
Construcción de biblioteca de ADN genómico fragmentado al azar Lectura de secuencias individuales Las secuencias individuales son solapadas y ensambladas (contigs) Para asegurarse de que todas las secuencias estén representadas se leen unas 10 veces la cantidad de bases del genoma

La velocidad de producción de las secuencias ha ido en. Recaumentoientemente se dio un salto en este sentido con el desarrollo de los secuenciadores de “próxima generación” No usan terminación de cadena Se coloca una base cada vez y se detecta cual fue incorporada a cada molécula que se esta secuenciando Producen en una única reacción de secuencia millones de lecturas de fragmentos diferentes (paralelización) 108 1010 bases por corrida (menos de 1 día) De esta forma se secuencio el genoma entero de Watson en menos de 1 mes a un “bajo” costo

CONCLUSION • La capacidad de las células de mantener un elevado grado de orden dentro de un universo caótico, depende de la información genética que se expresa, se mantiene y a veces mejora, mediante los procesos genéticos básicos la síntesis de proteínas y del RNA, la reparaci 6 n de l DNA, la replicaci 6 n del DNA y la recombinaci 6 n genética. • En estos procesos, que producen y mantienen las proteínas y los ácidos nucleicos de una célula la información de una secuencia lineal de nucleótidos se utiliza para especificar otra cadena lineal de nucleótidos (una molécula de DNA o de RNA) o una cadena lineal de aminoácidos (una molécula proteica).

BIBLIOGRAFIA Donald Voet, Judith G. Voet, Charlotte W. Pratt. Fundamentos de Bioquímica. 2º edición. Buenos Aires: Médica Panamericana. Thomas M. Devlin, Ph. D. Bioquímica. 4º edición. Editorial Reverté, S. A. M. Zafri Humayun. Department of Microbiology and Molecular Genetics, UMDNF_ New Jersey Medical School, 185 South Orange Avenue, Newark, NJ 07103 -2714, USA. Molecular Microbiology (1998)30(5), 905 -910. http: //www. tesisenxarxa. net/TESIS_UAB/AVAILABLE/TDX-0714105180036//mjr 3 de 9. pdf http: //www. ucm. es/info/genetica/grupod/Mutacion/mutacion. htm http: //www 2. uah. es/biomolq/BM/Esquemas/Tema 4. htm http: //www. pakosimarro. com/paraimprimir/diversidad/ampliacionbio 2 bto/unid
 Facultad de ciencias quimicas unach
Facultad de ciencias quimicas unach Universidad de el salvador facultad de ciencias economicas
Universidad de el salvador facultad de ciencias economicas Universidad de los andes facultad de ciencias
Universidad de los andes facultad de ciencias Universidad de el salvador facultad de ciencias economicas
Universidad de el salvador facultad de ciencias economicas Universidad de el salvador facultad de ciencias economicas
Universidad de el salvador facultad de ciencias economicas Facultad de ciencias universidad mayor
Facultad de ciencias universidad mayor Universidad autonoma de manizales
Universidad autonoma de manizales Universidad autonoma de nuevo leon odontologia
Universidad autonoma de nuevo leon odontologia Facultad de ciencias medicas y biologicas dr ignacio chavez
Facultad de ciencias medicas y biologicas dr ignacio chavez Facultad de ciencias administrativas unmsm
Facultad de ciencias administrativas unmsm Facultad de ciencias economicas tucuman
Facultad de ciencias economicas tucuman Facultad de ciencias economicas tucuman
Facultad de ciencias economicas tucuman Facultad de ciencias agricolas uce
Facultad de ciencias agricolas uce Facultad de ciencias de la salud uma
Facultad de ciencias de la salud uma Facultad de ciencias físicas ucm
Facultad de ciencias físicas ucm Universidad austral de chile facultad de medicina
Universidad austral de chile facultad de medicina Universidad de carabobo facultad de derecho
Universidad de carabobo facultad de derecho Universidad javeriana - facultad de medicina
Universidad javeriana - facultad de medicina Hipertrofia pilorica
Hipertrofia pilorica Holtler
Holtler Universidad san martin de porres facultad de derecho
Universidad san martin de porres facultad de derecho Facultad de informatica universidad de panama
Facultad de informatica universidad de panama Facultad de arquitectura universidad de panama
Facultad de arquitectura universidad de panama Universidad de carabobo facultad de odontologia
Universidad de carabobo facultad de odontologia Infección tracto urinario
Infección tracto urinario Universidad de ciencias medicas sancti spiritus
Universidad de ciencias medicas sancti spiritus Invatarea autonoma
Invatarea autonoma Moral autónoma ejemplos
Moral autónoma ejemplos Capacidad autonoma
Capacidad autonoma Autonoma y heteronoma
Autonoma y heteronoma Familia uniparametrica
Familia uniparametrica 1936
1936 Estado estacionario ecuaciones diferenciales
Estado estacionario ecuaciones diferenciales Corporacion universitaria autonoma del cauca
Corporacion universitaria autonoma del cauca Cocodrilo es grave o aguda
Cocodrilo es grave o aguda El cuarzo mas grande del mundo
El cuarzo mas grande del mundo Laboratorio john dalton chihuahua
Laboratorio john dalton chihuahua Mapa mental
Mapa mental Don't get treed by a chihuahua
Don't get treed by a chihuahua Expediente clinico integral chihuahua
Expediente clinico integral chihuahua