Unidade 7 Estrutura atmica Unidade 7 Estrutura atmica



- Slides: 12

Unidade 7 Estrutura atómica

Unidade 7 Estrutura atómica 7. 2 Modelo da nuvem eletrónica

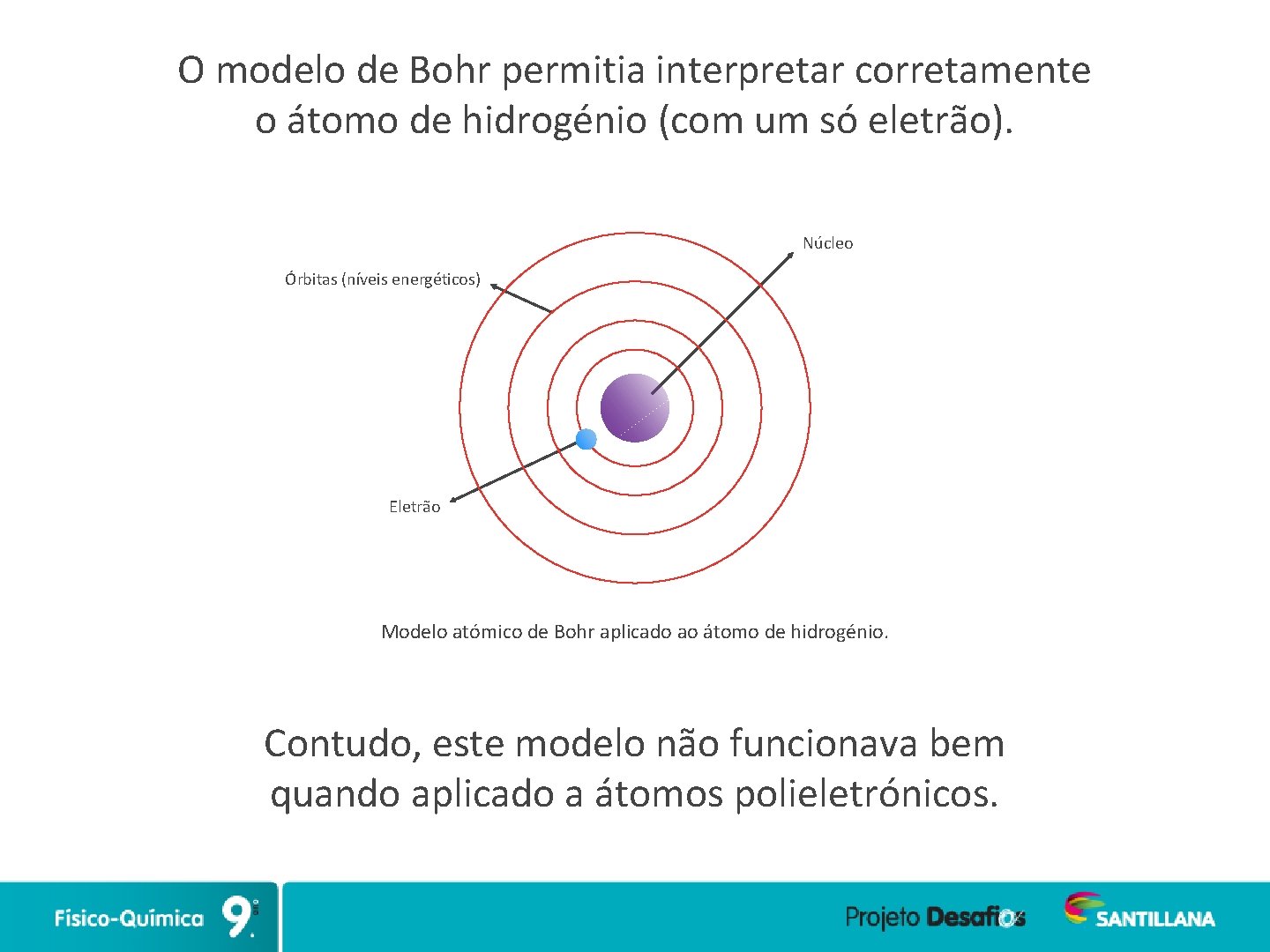
O modelo de Bohr permitia interpretar corretamente o átomo de hidrogénio (com um só eletrão). Núcleo Órbitas (níveis energéticos) Eletrão Modelo atómico de Bohr aplicado ao átomo de hidrogénio. Contudo, este modelo não funcionava bem quando aplicado a átomos polieletrónicos.

No final do século XIX e início do século XX, sucederam-se descobertas relacionadas com a constituição do átomo. Essas descobertas contribuíram para o desenvolvimento de um modelo atómico mais ajustado às evidências experimentais. Max Planck James Chadwick Descoberta da descontinuidade na emissão de radiação eletromagnética. Confirmação da existência de uma partícula no núcleo sem carga elétrica — o neutrão. (1858 -1947) (1891 -1974) Louis de Broglie (1892 -1987) Descoberta do comportamento ondulatório do eletrão. W. Heisenberg (1901 -1976) Desenvolvimento de uma equação que relaciona as incertezas da posição e da velocidade de uma partícula. E. Schrödinger (1887 -1961) Desenvolvimento de uma equação que permite determinar a energia dos eletrões nos átomos.

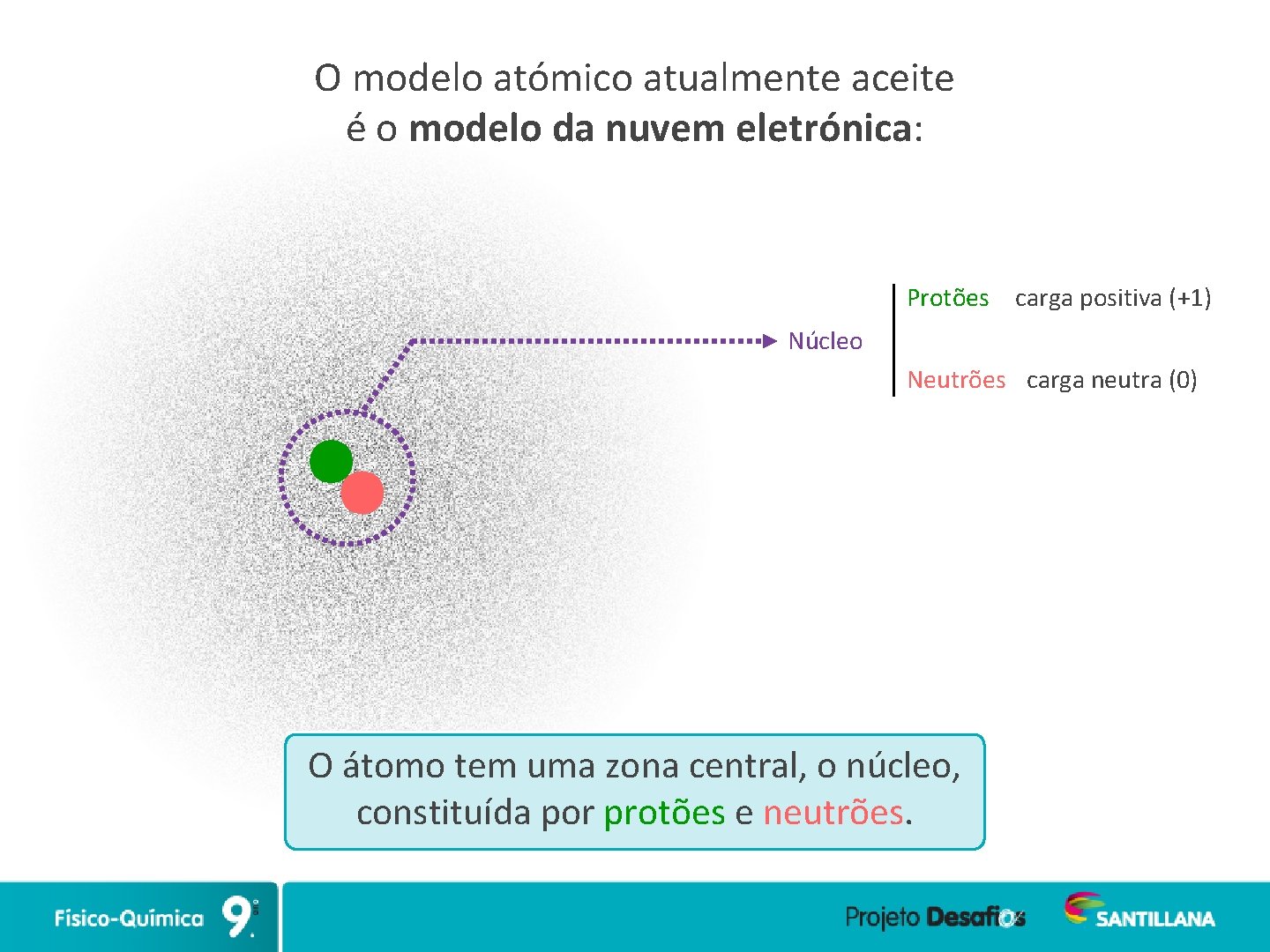
O modelo atómico atualmente aceite é o modelo da nuvem eletrónica: Protões carga positiva (+1) Núcleo Neutrões carga neutra (0) O átomo tem uma zona central, o núcleo, constituída por protões e neutrões.

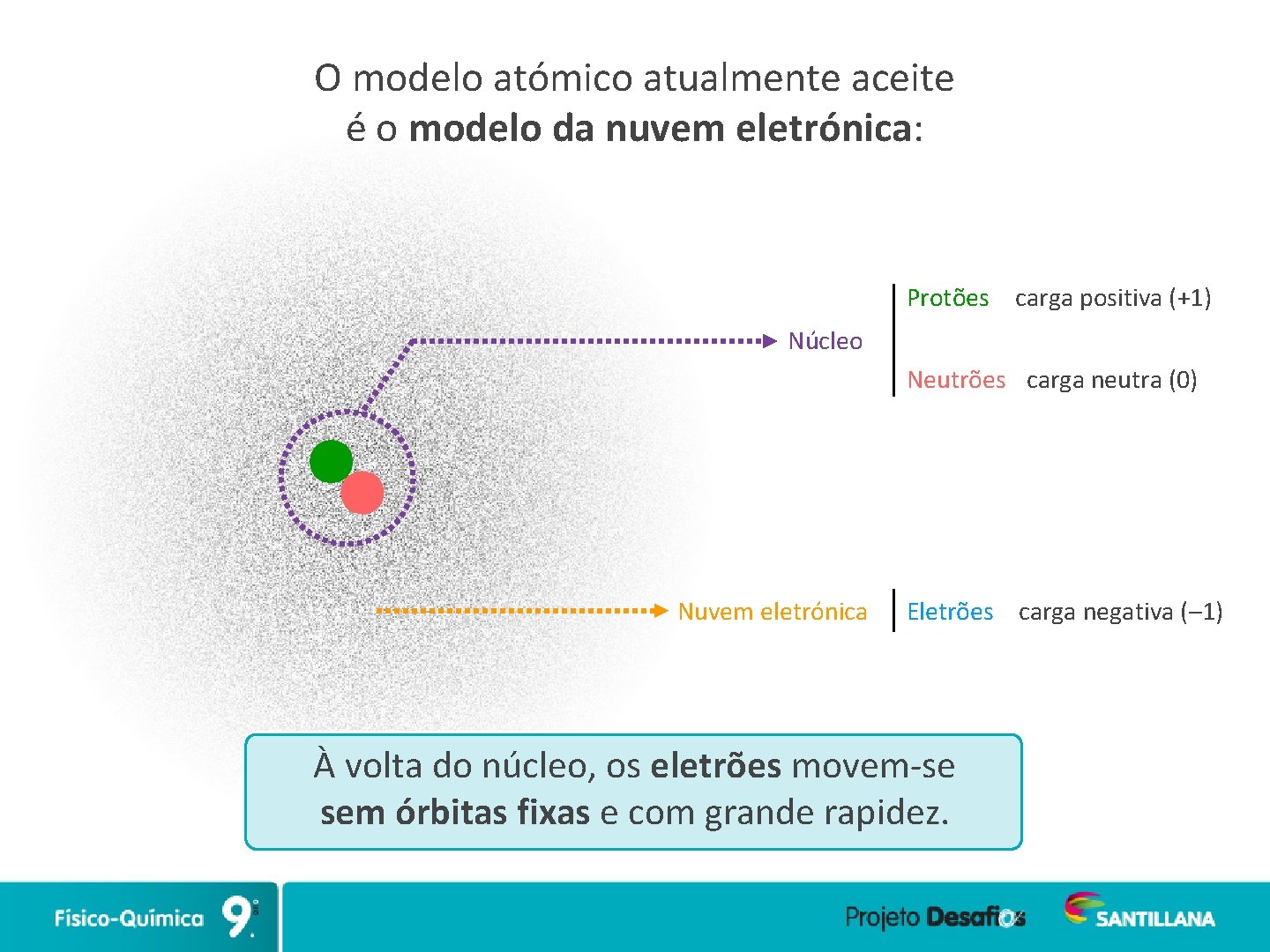
O modelo atómico atualmente aceite é o modelo da nuvem eletrónica: Protões carga positiva (+1) Núcleo Neutrões carga neutra (0) Nuvem eletrónica Eletrões carga negativa (– 1) À volta do núcleo, os eletrões movem-se sem órbitas fixas e com grande rapidez.

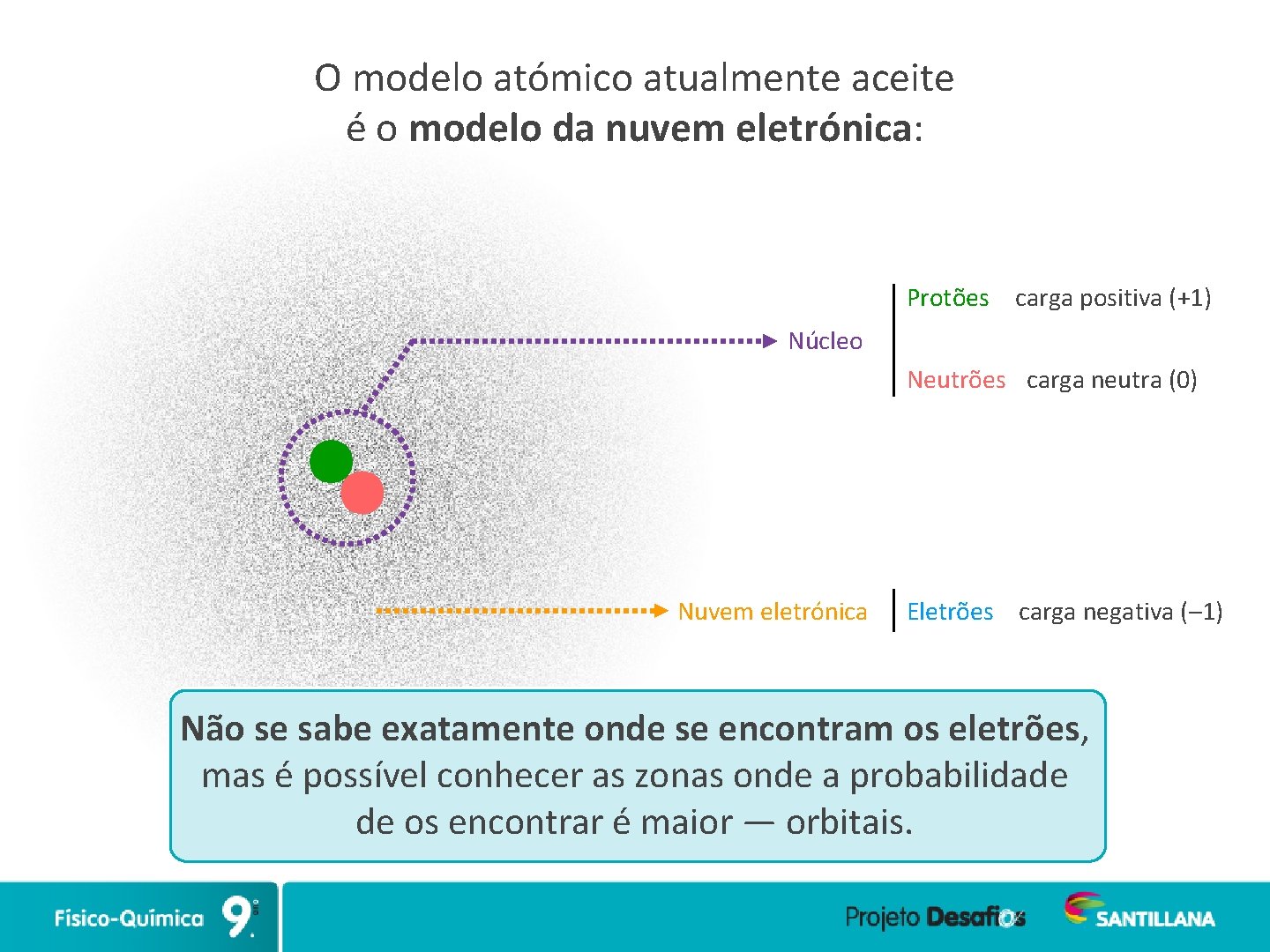
O modelo atómico atualmente aceite é o modelo da nuvem eletrónica: Protões carga positiva (+1) Núcleo Neutrões carga neutra (0) Nuvem eletrónica Eletrões carga negativa (– 1) Não se sabe exatamente onde se encontram os eletrões, mas é possível conhecer as zonas onde a probabilidade de os encontrar é maior — orbitais.

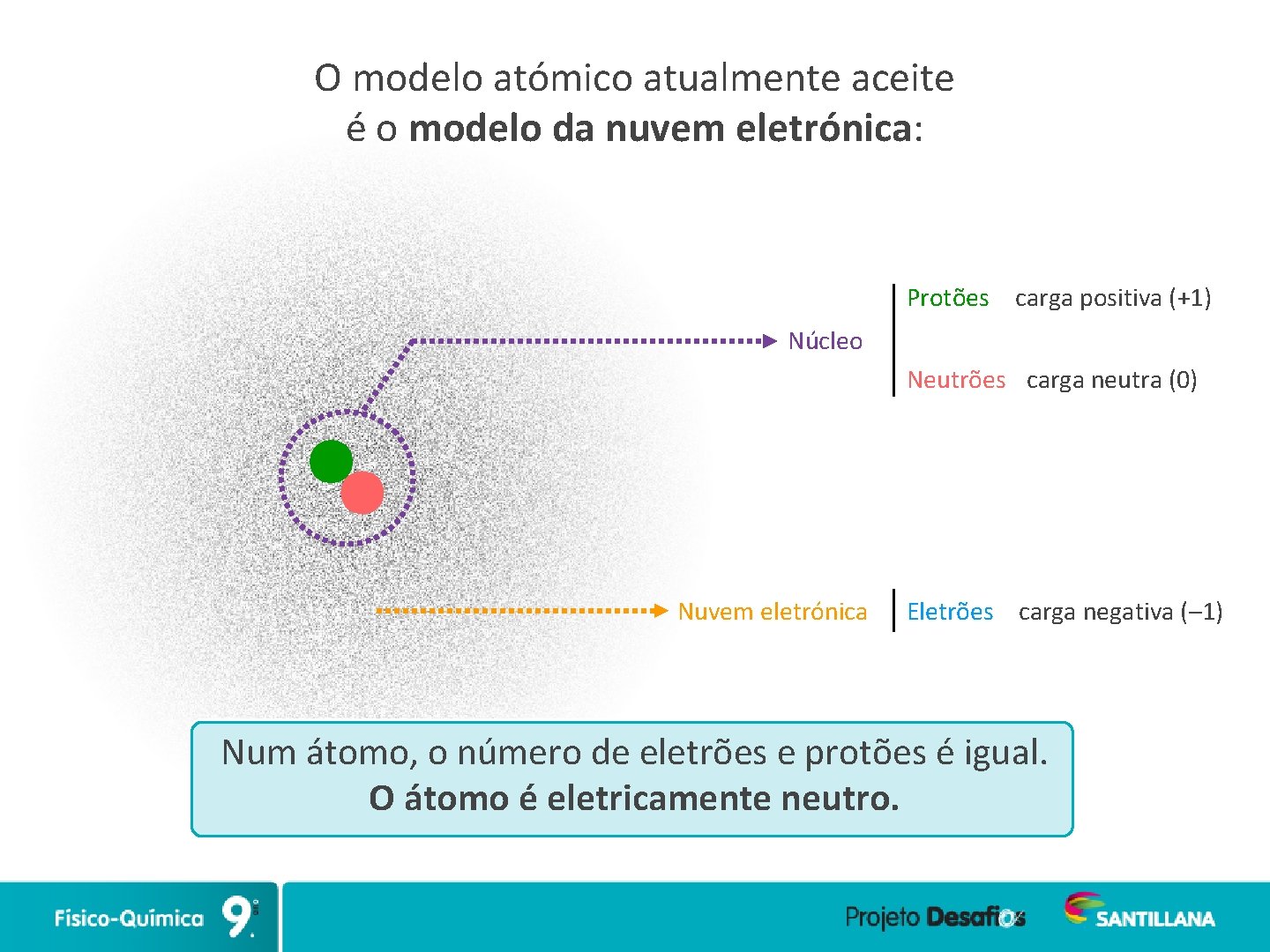
O modelo atómico atualmente aceite é o modelo da nuvem eletrónica: Protões carga positiva (+1) Núcleo Neutrões carga neutra (0) Nuvem eletrónica Eletrões carga negativa (– 1) Num átomo, o número de eletrões e protões é igual. O átomo é eletricamente neutro.

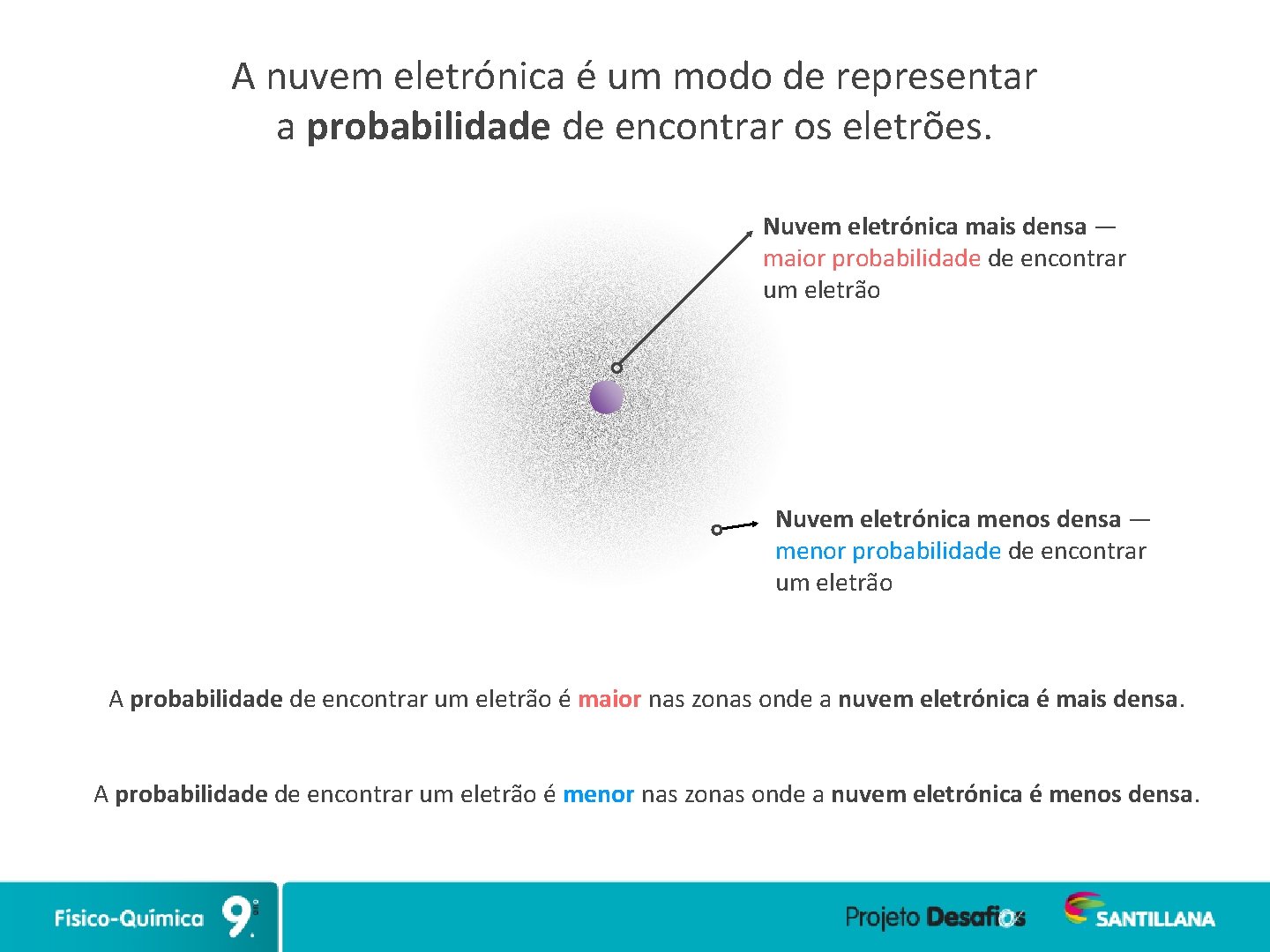
A nuvem eletrónica é um modo de representar a probabilidade de encontrar os eletrões. Nuvem eletrónica mais densa — maior probabilidade de encontrar um eletrão Nuvem eletrónica menos densa — menor probabilidade de encontrar um eletrão A probabilidade de encontrar um eletrão é maior nas zonas onde a nuvem eletrónica é mais densa. A probabilidade de encontrar um eletrão é menor nas zonas onde a nuvem eletrónica é menos densa.

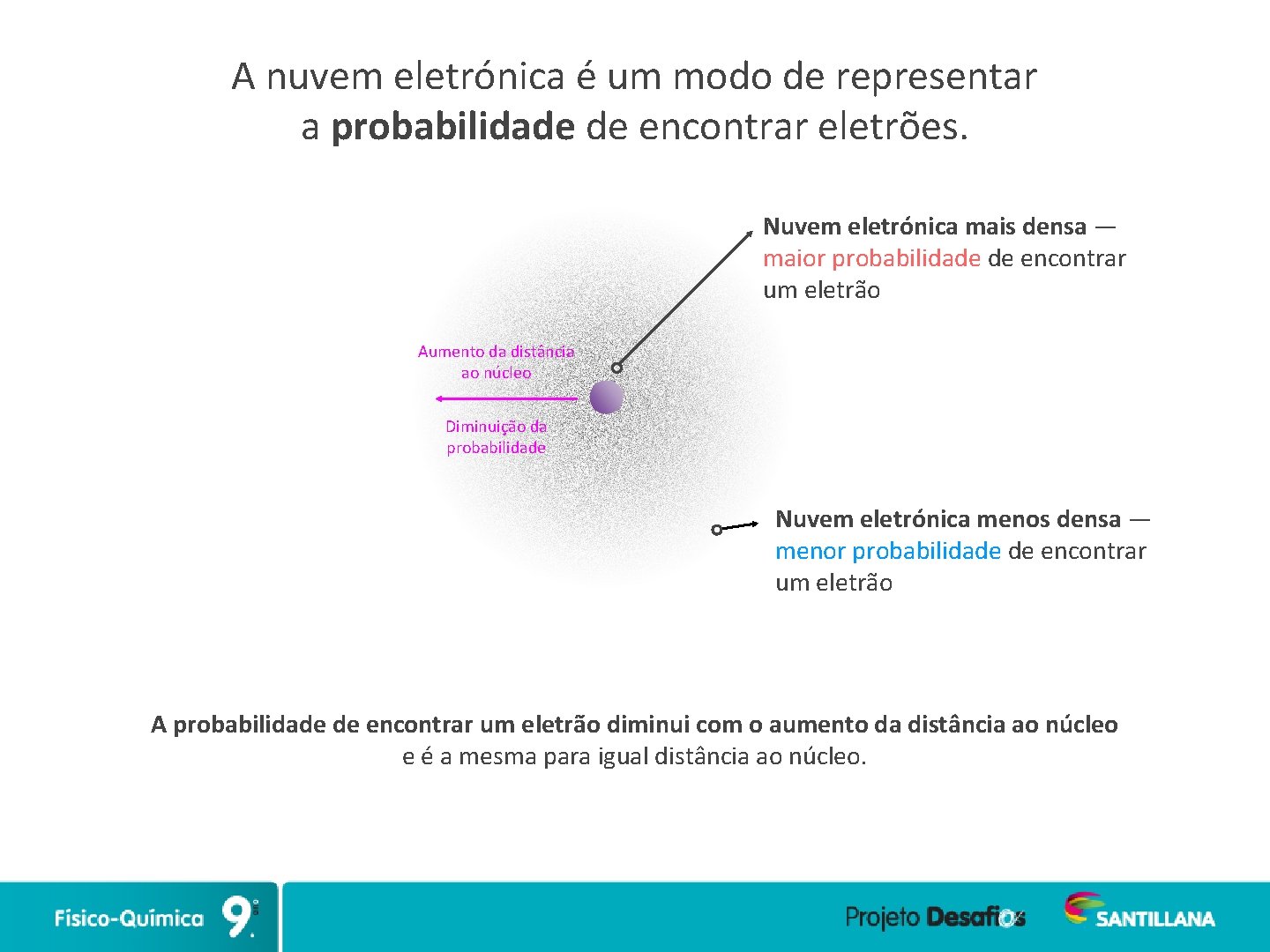
A nuvem eletrónica é um modo de representar a probabilidade de encontrar eletrões. Nuvem eletrónica mais densa — maior probabilidade de encontrar um eletrão Aumento da distância ao núcleo Diminuição da probabilidade Nuvem eletrónica menos densa — menor probabilidade de encontrar um eletrão A probabilidade de encontrar um eletrão diminui com o aumento da distância ao núcleo e é a mesma para igual distância ao núcleo.

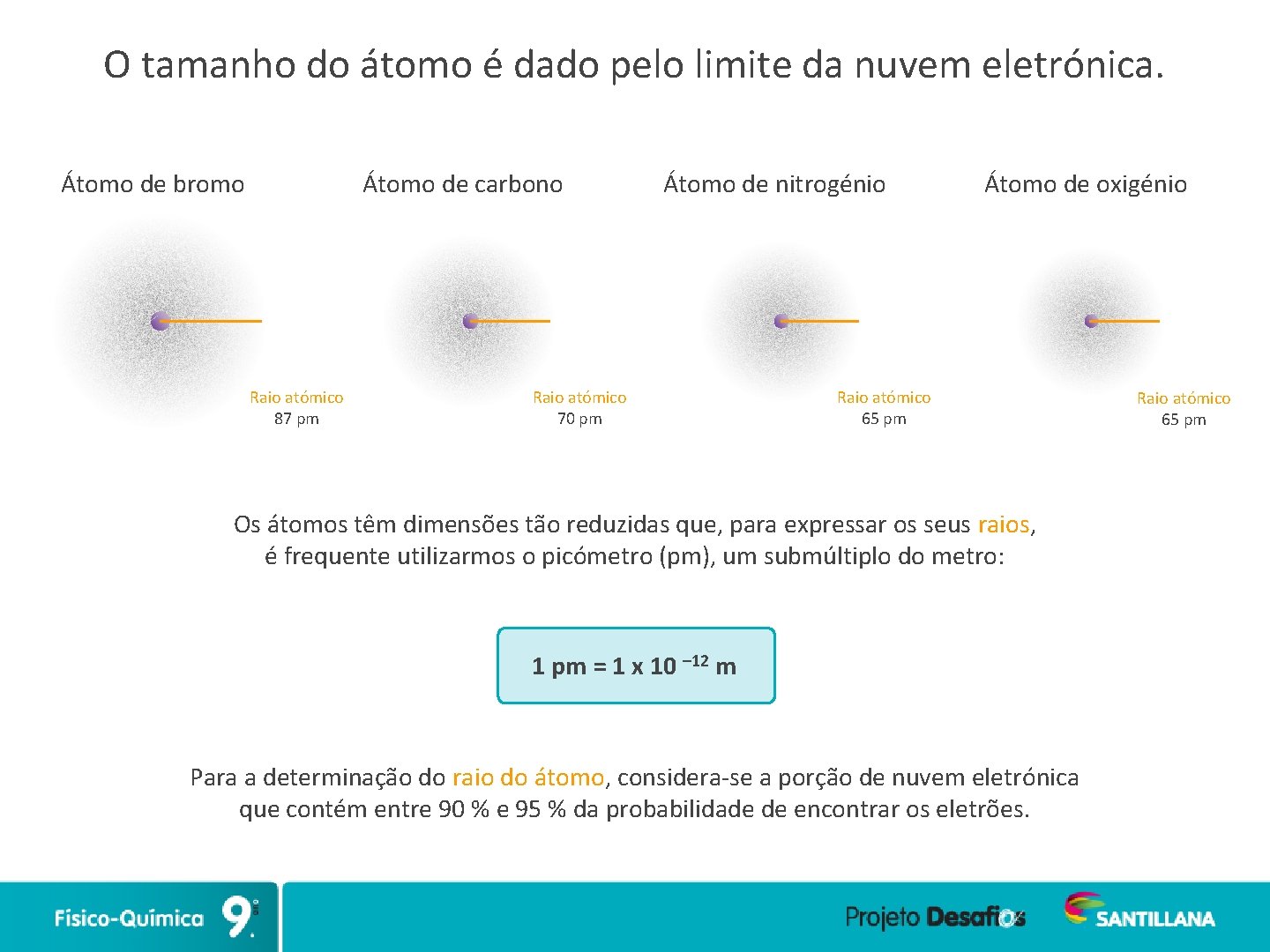
O tamanho do átomo é dado pelo limite da nuvem eletrónica. Átomo de bromo Átomo de carbono Raio atómico 87 pm Átomo de nitrogénio Raio atómico 70 pm Átomo de oxigénio Raio atómico 65 pm Os átomos têm dimensões tão reduzidas que, para expressar os seus raios, é frequente utilizarmos o picómetro (pm), um submúltiplo do metro: 1 pm = 1 x 10 – 12 m Para a determinação do raio do átomo, considera-se a porção de nuvem eletrónica que contém entre 90 % e 95 % da probabilidade de encontrar os eletrões. Raio atómico 65 pm

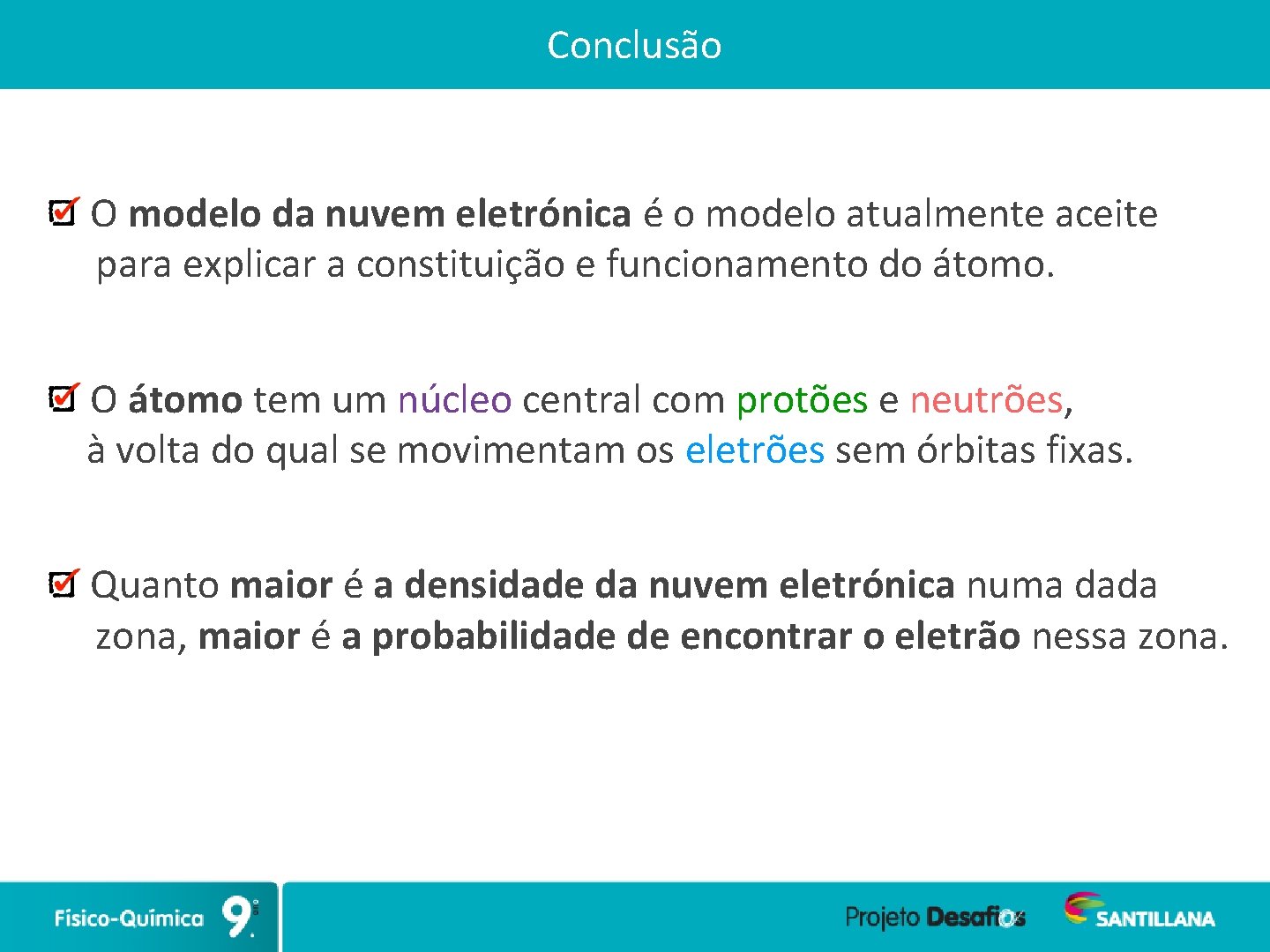
Conclusão O modelo da nuvem eletrónica é o modelo atualmente aceite para explicar a constituição e funcionamento do átomo. O átomo tem um núcleo central com protões e neutrões, à volta do qual se movimentam os eletrões sem órbitas fixas. Quanto maior é a densidade da nuvem eletrónica numa dada zona, maior é a probabilidade de encontrar o eletrão nessa zona.