UIC I Gntique Cours 6 LES MALADIES CHROMOSOMIQUES










































- Slides: 44

UIC I Génétique - Cours 6 LES MALADIES CHROMOSOMIQUES 1

I – LES MALADIES CHROMOSOMIQUES Les maladies chromosomiques sont produites par des anomalies chromosomiques – numérique ou de structure – visibles au microscope (inclusiv par FISH) → ≥ 4 Mb v sdr. Down (trisomie 21); v sdr. Turner (monosomie X); v sdr. Velo-Cardio-Facial (del 22 q 11). v Les maladies chromosomiques sont des maladies génétiques mais (avec rares exceptions) NE sont PAS héréditaires 2

I – LES MALADIES CHROMOSOMIQUES A/ Fréquence des anomalies chromosomiques – Nouveaux-nés vivants → 0, 7 – 1 % (>1: 120) (Hook et al, 1992= 0, 83% + sdr avec microdeletions) – – Gamètes (hommes/femmes normales): → 10 % (spz) + 25 % (ovules) Embryons (à la conception) → 25 % embryons 5 -8 semaines (avortements spontanés) → 50 – 60 % Nouveaux-nés morts → 10% TOTAL : 8 ~ 10% des grossesses 3

I – LES MALADIES CHROMOSOMIQUES B/ Types des anomalies chromosomiques Anomalies chromosomiques: – constitutionnelles ou acquises; – numériques (aneuploidies et polyploidies) – structurelles: • del, r, dup, i, dic, der • inv, t (TRE; rob), ins. – homogènes ou en mosaïque – autosomique ou gonosomique. Conséquences phénotypiques: Ø Non-équilibrées = toutes an. num. + struct. nonéquilibrées → phenotype ANORMAL Ø équilibrées (sans modif. quantitatives) → phenotype NORMAL 4

U. M. F IAŞI I – LES MALADIES CHROMOSOMIQUES C/ Les causes des anomalies chromosomiques 1) Anomalies chromosomiques numériques v Sont produites par erreures de distribution (nondisjonction et retard anaphasique – aneuploidies) v Les causes des erreures = inconnues Ø l’âge maternel ↑ risque de ND(méiose I) : • 1: 1000 – < 25 de ans • 1: 100 – la 37 ans • 1: 10 – la 45 ans Explication : particularites de la méiose à la femme (“les ovules ont l’âge de la femme”) Ø Sûrement existent d’autres causes: seulement 25% des enfants avec trisomie 21 ont des mères > 35 ans • les facteurs externes sont exclus • gènes des nondisjonction • Des “accidents” méiotiques 5

U. M. F IAŞI I – LES MALADIES CHROMOSOMIQUES C/ Les causes des anomalies chromosomiques 2) Anomalies chromosomiques de structure – La “rupture” des chrs (agents clastogènes) + la réunion anormal des extrémités → chrs. dérivatifs – Erreurs de recombinaison (Méiose I) ← CO inégal 6

I – LES MALADIES CHROMOSOMIQUES D) Les dates générales • Les anomalies numériques ou de structure nonéquilibrées → phénotype anormal → plusieurs fois létal → avortement spontanné ou nouveau-né mort. • L’incidence des anomalies chromosomiques nonéquilibrées chez n. n. = 1/250 → des syndrômes chromosomiques – Trisomies complètes – Monosomie X – Trisomies partielles – Monosomies partielles. 7

I – LES MALADIES CHROMOSOMIQUES D) Les dates générales • Toutes les anomalies chromosomiques nonéquilibrées viables présentent une série de caractéristiques communes: – des troubles de la croissance et du développement pré- et postnatale; – retard psycho-moteur; – troubles de la reproduction: stérilite et/ou infertilité (avortements répétés ou enfants plurimalformés morts ou vivants); – syndrome plurimalformatif spécifique a chaque anomalie en part. 8

I – LES MALADIES CHROMOSOMIQUES D) Les dates générales • Les conséquences des anomalies chromosomiques nonéquilibrées numériques et structurales dépendent de plusieurs facteurs: – le type d’anomalie, – la quantité de materiel génétique actif présent sur le chromosome impliqué – La taille du deséquilibré génique; – Le type de chromosome affecté (autosome ou gonosome) – Le nombre de cellules affectées; 9

II - Trisomies autosomales A/ Le syndrome de DOWN • Déterminé par trisomie 21 • L’incidence - 1: 650 n. n vivants (1, 5‰). • Chez nouveau-né et enfant: – Taille et poid ↓, – hypotonie musculaire, – dysmorphie faciale - fentes palpébrales mongoloïdes, nez petit avec des narines antévertées, protusion linguale, – court, avec l’excés de peau sur nuque, – Des mains courtes et larges, avec brachydactilie, pli palmaire transvers unique (pli simien) – Des malformations viscérales (atrésie duodenale, imperforation anal, défauts cardiaques); – retard mental et du développement 10

Les signes cardinaux pour le diagnostic du syndrome Down Signes Fréquence (%) Reflexe Moro reduit 85 Hypotonie musculaire 80 Profil facial plat 90 Fentes palpébrales obliques en haut et en dehors 80 Des oreilles petites, rondes et situées basse 60 Excés de peau sur nuque 80 Pli simien 45 Hyperlaxité articulaire 80 Changements morphologiques pelviens à l’examen radiographique 70 Hypoplasie de la phalange moyenne de l’auriculaire 60 Minimum 6 signes présents = sdr. Down 11

II - Trisomies autosomales A/ Le syndrome de DOWN • Chez adulte: – retard mental sévère, – hypostature, – obesité, – fentes palpébrales mongoloïdes, – Taches Brushfield (taches brunes sur iris) – Lèvres grosses et éversées, – brachicéphalie, – microtie, – Cou court 12

II - Trisomies autosomales A/ Le syndrome de DOWN • Etiopatogénie: – trisomie 21 libre homogène (47, XX, +21 ou 47, XY, +21) - 92%; – translocation Robertsonienne non-équilibrée entre chromosomes 21 [46, XY, -21, +rob(21 q 21 q)] ou non-homologues [46, XX, 14, +rob(14 q 21 q)] - 5%; – mosaïque chromosomique 47/46 (47, XY, +21/46, XY) 3%. – trisomie 21 partielle <0, 1%. 13

II - Trisomies autosomales A/ Le syndrome de DOWN • le syndrome de Down peut etre dépisté par screening et diagnostic prénatal – Le triple test dans le sang maternel + ultrasonographie foetale: • α-foetoprotéine ↓ • la gonadotrophine chorionique humaine ↑ • l’oestriol nonconjuguée ↓ • la confirmation du diagnostic nécessite l’examen cytogénétique sur les amniocytes ou villosités chorioniques. 14

II - Trisomies autosomales A/ Le syndrome de DOWN • Le risque de récurrence du sdr. Down aux grossesses suivantes d’une femme qui a un enfant avec sdr. Down est dépendant du type de trisomie 21: – Non-significatif en trisomies par mosaïque (<0, 1%) – réduit en trisomie 21 libre homogène (~1%) – si un des parents a une translocation Robertsonienne équilibrée: • modéré en trisomie 21 par translocation Robertsonienne entre chromosomes nonhomologues (10%) • total en trisomie 21 par translocation Robertsonienne entre chromosomes 21 (100%) – si l’enfant a une translocation Robertsonienne, mais les parents ont un caryotype normal – risque réduit ~1% 15

II - Trisomies autosomales B/ Le syndrome de PATAU • • Determiné par la trisomie 13; Incidence 1/5000 -10. 000 naissances; Mortalité ↑ – 98% meurent en première année de la vie; Phénotype: – holoprosencéphalie - défaut de la ligne médiane (hémisphère cérébrale unique, agénésie du corpum calosum, ventricule cérébrale unique, microphtalmie/ anophtalmie, cyclopie, nez avec narine unique) – Retard du développement intra-utérin (L, P↓) – défaut du scalpe, – polydactilie, – Des ongles minces et convexes. – Des malformations cardiaques et cérébrales – Screening et diagnostic prénatal cytogénétique – triple test + ultrasonographie foetale + amniocentèse 16

II - Trisomies autosomales C/ Le syndrome d’EDWARDS • • Determiné par la trisomie 18; Incidence 1/5000 -8000 naissances; Mortalité ↑ – 98% meurent en première année de vie; Phénotype: – – dolicocéphalie avec os occipital proéminent, dysmorphie faciale avec front aplati, microrétrognatie, implantation basse des oreilles, avec l’hypoplasie de la partie antérieure (“oreilles de faune") – Des mains avec des doigts flectes, enchevétrés, – Des pieds deformés “en piolet”. – Des malformations cardiaques et cérébrales, – Screening et diagnostic prénatal cytogénétique – triple test + ultrasonographie foetale + amniocentèse 17

III - Monosomies autosomales partielles A/ Des syndrômes produits par délétions microscopiques 1) Le syndrome de WOLF-HIRSCHHORN • • • Monosomie 4 p Incidence 1/50 000 naissances Phénotype – Hypotrophie saturale et pondérale sévère – Dysmorphie cranio-faciale • • • Microcéphalie Hypertélorisme Arcades sourcillaires proéminentes Racine nasale large Bouche avec des coins « tombés » Des anomalies auriculaires – Des anomalies cardiaques • Retard sevère – Interventriculaire • Retard mental sévère • • Region critique – 4 p 16 Espérance de vie limitée, 1/3 des cas meurent en première année de vie 18

III - Monosomies autosomales partielles A/ Des syndrômes produits par délétions microscopiques 1) Le syndrome du CRI DU CHAT • • Monosomie partielle 5 p Incidence 1/50 000 naissances 1% des enfants avec retard mental sévère Signes cliniques nouveau-né : pleurs caractéristiques (miaulement de chatons), microcéphalie, dysmorphie crânio-faciale avec facies rond, hypertélorisme, épicanthus, des oreilles placées basses • Signes cliniques enfant grand (adulte) dysmorphie faciale : faciès mince, macrognathie, hypo stature • Retard mental sévère (QI=20) • Des malformations cardiaques et anomalies génito-urinaires 19

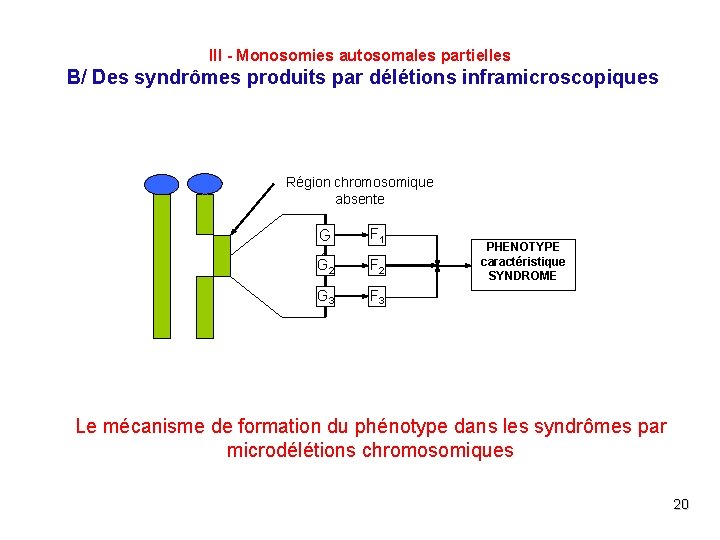
III - Monosomies autosomales partielles B/ Des syndrômes produits par délétions inframicroscopiques Région chromosomique absente G 1 F 1 G 2 F 2 G 3 F 3 PHENOTYPE caractéristique SYNDROME Le mécanisme de formation du phénotype dans les syndrômes par microdélétions chromosomiques 20

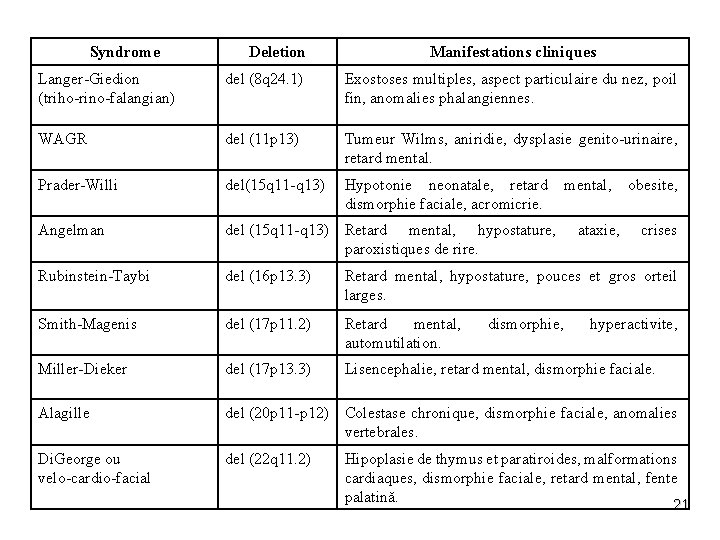
Syndrome Deletion Manifestations cliniques Langer-Giedion (triho-rino-falangian) del (8 q 24. 1) Exostoses multiples, aspect particulaire du nez, poil fin, anomalies phalangiennes. WAGR del (11 p 13) Tumeur Wilms, aniridie, dysplasie genito-urinaire, retard mental. Prader-Willi del(15 q 11 -q 13) Hypotonie neonatale, retard dismorphie faciale, acromicrie. Angelman del (15 q 11 -q 13) Retard mental, hypostature, paroxistiques de rire. Rubinstein-Taybi del (16 p 13. 3) Retard mental, hypostature, pouces et gros orteil larges. Smith-Magenis del (17 p 11. 2) Retard mental, automutilation. Miller-Dieker del (17 p 13. 3) Lisencephalie, retard mental, dismorphie faciale. Alagille del (20 p 11 -p 12) Colestase chronique, dismorphie faciale, anomalies vertebrales. Di. George ou velo-cardio-facial del (22 q 11. 2) dismorphie, mental, ataxie, obesite, crises hyperactivite, Hipoplasie de thymus et paratiroides, malformations cardiaques, dismorphie faciale, retard mental, fente palatină. 21

III - Monosomies autosomales partielles B/ Des syndromes produits par délétions infra-microscopiques 1) Le syndrôme VELO-CARDIO-FACIAL • Micro-délétion 22 q 11. 2 • clinique: – Dysmorphie faciale caractéristique (nez allongé avec le pointe bulbeuse, philtrum long, facies allongé, bouche petite, oreilles petites) – Fente palatine ou insuffisance vélo-pharyngienne → des difficultés de phonation – Des malformations cardiaques (défauts septales, tétralogie Fallot) – Des difficultés d’apprentissage – Hypocalcémie 22

III - Monosomies autosomales partielles B/ Des syndromes produits par délétions infra-microscopiques 1) Le syndrôme VELO-CARDIO-FACIAL Etiologie • Classique – Délétion microscopique 22 q 11 - 15 -20% • FISH – Délétion inframicroscopique 22 q 11. 2 - 63% – L’absence de la délétion - 17% • Région critique minimale - 480 kb • 5 gènes candidats • dans 10 -15% des cas, la délétion est héritée d’aprés un model DA → risque de récurrence 50% 23

III - Monosomies autosomales partielles B/ Des syndromes produits par délétions infra-microscopiques 1) Le syndrôme de PRADER-WILLI • • • • 1/10. 000 -1/20. 000 n. n. microdélétion/délétion 15 q 11 -q 13 Hypotonie sévère en pèriode du nouveau-né Des difficultés d’alimentation → gavage Hyperphagie après l’âge d’ 1 an → croissance rapide du poids → Obésite hypotalamique Dysmorphie craniofaciale: diamètre bifrontal petit; des yeux en “amande”; bouche avec des coins tombés Hypostature; Hypogonadisme: Hypoplasie génitale Puberté retardée Infertilité Développement psychocomportamental déficitaire→ retard mental + anomalies de apprentissage Acromicrie 24

III - Monosomies autosomales partielles B/ Des syndromes produits par délétions infra-microscopiques 1) Le syndrôme de PRADER-WILLI • modifications génétiques: – délétion paternelle 15 q 11 -q 13 de novo présent dans 75% des cas l’absence d’un segment chromosomique de 3 -4 Mb – La disomie uni parentale maternelle du chromosome 15 20% des cas (conséquence de la “sauvegarde” d’une trisomie 15) – Mutation du centre d’empreintage, qui contrôle les modifications epigénétiques des gènes de la région 15 q 11 -q 13 - 1% des cas. 25

Les aneuploidies gonosomiques 26

III – LES ANEUPLOIDIES GONOSOMIQUES A/ Le Syndrome de TURNER • La monosomie X - la seule monosomie viable: – – – – – Monosomie X homogène; Monosomie X e. La monosomie X - la seule monosomie viable: Monosomie X homogène; Monosomie X en mosaïque; Monosomie X partielle par délétion du X, chromosome X annulaire, isochromosome X. 1/2500 -1/5000 nouveaux-nés filles, Produit par l’haploinsuffisance des gènes du chromosome X qui échappent a l’inactivation n mosaïque; Monosomie X partielle par délétion du X, chromosome X annulaire, isochromosome X. • 1/2500 -1/5000 nouveaux-nés filles, • Produit par l’haploinsuffisance des gènes du chromosome X qui échappent a l’inactivation 27

III – LES ANEUPLOIDIES GONOSOMIQUES A/ Le Syndrome de TURNER • Clinique – A la naissance • Fillette avec taille réduite, • lymphoedeme (dur, non-douloureux, transitoire) au niveau des mains et pieds, • Cou court, avec excés de peau sur nuque et/ou pterygium coli • distance intermammelonaire ↑ – Post-pubère • La triade: hypostature – aménorrhée primaire - caractères sexuels secondaires féminins déficitaires. • stérilité primaire et définitive. • glandes mammaires moins développées, • pillosité axilaire absente, • pillosite pubienne réduite. • organes génitaux externes infantiles, • utérus hypoplasique 28

III – LES ANEUPLOIDIES GONOSOMIQUES A/ Le Syndrome de TURNER • Autres signes cliniques – dysmorphie cranio-faciale - facies triangulaire, épicantus, fentes palpébrales antimongoloides, palais en voute. – ligne basse d’insertion de la chevelure sur nuque, terminée en trident, – diamètre biacromiale > diamètre bitrochanterien, – distance intermammelonaire ↑, – cubitus valgus – malformations congénitales rénales ou cardiaques. – Intelligence normale ou à la limite infèrieure de la normale 29

III – LES ANEUPLOIDIES GONOSOMIQUES A/ Le Syndrome de TURNER • Traitement – – Le déficit de croissance: 2 -10 ans – doses ↑ de STH Le traitement doit être initier précocément et maintenu continuellement. La thérapie avec STH n’a pas d’ utilité apres 10 ans quand les récèpteures pour l’hormone ne repondent pas aux doses augmentées; – Après 11 ans (l’âge de début de la puberté des filles) thérapie avec oxandrolon (androgène faible) pour 1 an – 1 an et demi qui stimule la croissance en longueur des os; – Apres 12 -13 ans - thérapie substitutive avec hormones sexuelles féminines (pilules contraceptives) qui augmente la taille et corrige le deficit de sexualisation 30

III – LES ANEUPLOIDIES GONOSOMIQUES B/ Le Syndrome de KLINEFELTER • Maladie génétique déterminée par la trisomie XXY • La plus fréquente anomalie gonosomique du sexe masculin → 1/1000 nn ♂ • En trisomies XXY homogènes ← le chromosome X supplémentaire maternel • Corrélation statistique entre le risque de syndrome de Klinefelter et l’âge maternel avancé au moment de la conception. • Les particularités cliniques sont déterminées par la présence supplémentaire du chromosome X. • La présence en excès des gènes du chromosome X → des anomalies de formation des testicules → dysgénésie testiculaire → la manque de la sécrétion d’androgènes + azoospermie → stérilité masculine primaire et définitive. 31

III – LES ANEUPLOIDIES GONOSOMIQUES B/ Le Syndrome de KLINEFELTER Diagnostic post-pubère ← retard du développement des caractères sexuels secondaires masculins. • Signes cliniques: – – – Haute stature, micro testicules + pénis normal (dissociation péno-orhitique), stérilité masculine inadaptabilité sociale. sexualisation masculine déficitaire: pillosité faciale, axillaire et tronculaire absente pillosité pubienne réduite avec aspect gynoïde, corps avec conformation féminine (les hanches plus larges que les épaules), Voix haute, adiposité avec disposition gynoïde. azoospermie gynécomastie 32

IV - TROUBLES DE LA REPRODUTION DE CAUSE CHROMOSOMIQUE • La stérilité - l’impossibilité d’un individu de former des gamètes fécondants • L’infertilité – la terminaison d’une grossesse par avortement ou la naissance d’un enfant anormal. – Des avortements spontanés répétés – La naissance d’enfants morts plurimalformés – La naissance d’enfants vivants plurimalformés – L’association de ces cas 33

IV - TROUBLES DE LA REPRODUTION DE CAUSE CHROMOSOMIQUE A/ Stérilité de cause chromosomique • 10 -15% des couples sont stériles → stérilité: – masculine (20%) – feminine (38%) – de couple (27%) – idiopathique (15%). • Les facteurs impliqués en stérilité sont: – génétiques, – endocrines, – anatomiques, – immunologiques – d’environnement. – psychologiques. 34

IV - TROUBLES DE LA REPRODUTION DE CAUSE CHROMOSOMIQUE A/ Stérilité de cause chromosomique • stérilité peut etre: – hypothalamique hypogonadisme hypogonadotrope – hypophysaire – Gonadique → hypogonadisme hypergonadotrope – Postgonadique – sans hypogonadisme • Stérilité gonadique: – définitive – déterminée par mutations: • chromosomiques • géniques. 35

IV - TROUBLES DE LA REPRODUTION DE CAUSE CHROMOSOMIQUE B/ Stérilité chromosomique Féminine Le syndrome de Turner • La monosomie X → insuffisance ovarienne → ↑ FSH et LH + ↓ oestrogènes et progestérone → stérilité primaire et définitive Le syndrome de triple X • Rarement produit stérilité Les translocations X-autosome • 50% des femmes sont stériles 36

IV - TROUBLES DE LA REPRODUTION DE CAUSE CHROMOSOMIQUE C/ Stérilité chromosomique Masculine Le syndrome de Klinefelter • trisomie XXY → la principale cause de stérilité masculine. • La présence supplémentaire d’un chromosome X → dysgénésie testiculaire → la disparition progressive des cellules germinales → azoospermie. Les hommes XYY • Rarement ont stérilité Les trisomies autosomales • trisomie 21 + trisomie 8 en mosaïque → stérilité masculine Les hommes XX • 1/10000 – 1/20000 des hommes • La translocation du gène SRY (Sex-determing Region of chromosome Y) sur le chromosome X en spermatogénèse. • phénotype du syndrome de Klinefelter + taille normale. • L’absence des gènes du bras long du chromosome Y → atrophie testiculaire → stérilité 37

IV - TROUBLES DE LA REPRODUTION DE CAUSE CHROMOSOMIQUE C/ Stérilité chromosomique Masculine Les anomalies structurales du chromosome Y • 15% des patients avec azoospermie • Les anomalies les plus fréquentes - les microdélétions Yq (region critique Yq 11. 23 nommée AZF (AZoospermia Factor)) • Les microdélétions Y → des changements anatomopathologiques testiculaires (l’absence complète des cellules germinales ↔ le bloquage de la spermatogénèse). • Le diagnostic moléculaire par la technique PCR 38

IV - TROUBLES DE LA REPRODUTION DE CAUSE CHROMOSOMIQUE D/ Infertilité chromosomique Les avortements spontanés • La perte inexplicable d’une grossesse, avant la 20ème semaine de gestation • La fréquence des avortements spontanés - 12 - 50% des grossesses. • La plupart des grossesses se finissent par avortement entre les semaines 7 et 11 de gestation. 39

IV - TROUBLES DE LA REPRODUTION DE CAUSE CHROMOSOMIQUE D/ Infertilité chromosomique Avortements spontanés • • toutes les types d’anomalies chromosomiques nonéquilibrées. La trisomie 16 est plus fréquente trisomie - 26, 9% des trisomies Monosomie X - 1/4 des aneuploïdies. Trisomies gonosomales - 0, 2% des avortements → séverité ↓. Triploïdie - 15% des avortements. Tétraploïdie - 5% des avortements spontanés. Les anomalies chromosomiques structurales nonéquilibrées - 2% des avortements spontanés (1/2 de novo). 40

V - LES INDICATIONS PRATIQUES DE L’ETUDE DES CHROMOSOMES • En étapes intersexuels – pour établir une concordance entre le sexe génétique et le sexe civil (rarement on decouvre des anomalies chromosomiques). • En syndrômes plurimalformatifs (≥ 3 malformations) ± retard mental → anomalie chromosomique nonéquilibrée; – L’analyse chromosomique est nécessaire même si le diagnostic clinique est cert (ex. Sdr. Down) → le type d’anomalies → conseil génétique correct. • En retard mental (± troubles de comportament) → anomalie chromosomique structurale nonéquilibrée 41

V - LES INDICATIONS PRATIQUES DE L’ETUDE DES CHROMOSOMES • Le développement anormal des caractères sexuels secondaires (des garcons avec pilosité sexuelle réduite et voix haute ou des filles avec hypostature et aménorrhée primaire) → anomalie gonosomale (trisomie XXY ou monosomie X ) • Couples avec stérilité primaire → anomalie gonosomique ou anomalie structurale équilibrée (inversion ou translocation) • Couples avec des avortements spontanés répétés ou des enfants morts nés → anomalie chromosomique équilibrée • Les produits de l’avortements → anomalie chromosomique nonéquilibrée (numérique ou structurale) létale. 42

V - LES INDICATIONS PRATIQUES DE L’ETUDE DES CHROMOSOMES • Chez parents des enfants avec des anomalies nonéquilibrées (maladies chromosomiques) → anomalie chromosomique structurale équilibrée • Chez proches parents des individus avec des anomalies chromosomique équilibrées → la même anomalie → conseil génétique • Personnes exposées a l’action des agents mutagènes (radiations ionisantes, agents chimiques) → anomalies chromosomiques structurales nonéquilibrées acquises (chromosomes annulaires ou dicentriques). 43

V - LES INDICATIONS PRATIQUES DE L’ETUDE DES CHROMOSOMES • En cancer → anomalies chromosomiques nonéquilibrées ou apparemment équilibrées → évaluer le prognostique – leucémie myéloide chronique → chromosome Philadelphia 1 (t(9; 22)) – Rétinoblastome - deletion 13 q – tumeur Wilms (néphroblastome) - deletion 11 p • Diagnostic prénatal → anomalies chromosomiques numériques ou structurales nonéquilibrées → la terminaison de la grossesse – couples avec risque ↑ (un parent avec une anomalie chromosomique équilibrée, couple qui ont eu des enfants avec anomalies chromosomiques, l’âge maternel ≥ 35 ans). – Sur cellules des villosités chorioniques, cellules amniotiques ou cellules du sang. 44
 Ps2 practice management
Ps2 practice management Les anticoagulants cours ifsi
Les anticoagulants cours ifsi Les suites du cours
Les suites du cours Approche gar
Approche gar Cours sur les antennes
Cours sur les antennes Les incoterms cours
Les incoterms cours Les helminthes cours
Les helminthes cours Compteur synchrone modulo 6
Compteur synchrone modulo 6 Cours sur les lysosomes
Cours sur les lysosomes Cours sur les trames
Cours sur les trames üiç
üiç Continuing medical education
Continuing medical education Cs 583 uic
Cs 583 uic Uic extranet
Uic extranet üiç
üiç Ece 465
Ece 465 Isabel f. cruz
Isabel f. cruz Uic cs 411
Uic cs 411 Karşılıklı kenar çiftlerinden en az biri paraleldir
Karşılıklı kenar çiftlerinden en az biri paraleldir David hofman uic
David hofman uic Housing dock uic
Housing dock uic Bing liu uic
Bing liu uic Uic healthcare administration
Uic healthcare administration Uic cs flowchart
Uic cs flowchart Ece 368
Ece 368 Andrew b. kahng
Andrew b. kahng Data extraction table example
Data extraction table example Bing liu uic
Bing liu uic Kevin cisner
Kevin cisner Uic rrc
Uic rrc Uic cyber security
Uic cyber security Drc uic
Drc uic John lillis uic
John lillis uic Carlo naldi politecnico torino
Carlo naldi politecnico torino Uic
Uic Bing liu uic
Bing liu uic Extranet uic
Extranet uic Inaccommodate
Inaccommodate Ccts uic
Ccts uic Parts de la fulla
Parts de la fulla Résumé de la nouvelle la ficelle
Résumé de la nouvelle la ficelle Les mots qu'on ne dit pas sont les fleurs du silence
Les mots qu'on ne dit pas sont les fleurs du silence Grand corps malade voyage en train lyrics
Grand corps malade voyage en train lyrics Parts de la flor
Parts de la flor Chant quand le ciel est bleu mon garçon
Chant quand le ciel est bleu mon garçon