TUMORE DELLO STOMACO TUMORI MALIGNI DELLO STOMACO Classificazione






































- Slides: 46

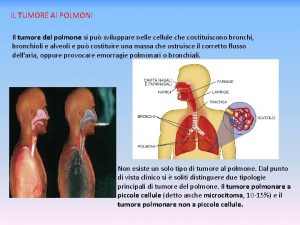
TUMORE DELLO STOMACO

TUMORI MALIGNI DELLO STOMACO Classificazione e Prevalenza • ADENOCARCINOMA • • • LINFOMA LEIOMIOSARCOMA / FIBROSARCOMA CARCINOIDE TUMORE STROMALE (GIST) METASTASI ALTRO 90% < < 5% 2% 1% 1%

CLASSIFICAZIONE ISTOLOGICA Adenocarcinoma di tipo: “intestinale” (sec. Lauren, 1965) “espansivo” (sec. Ming, 1977) Adenocarcinoma di tipo: “diffuso” (sec. Lauren, 1965) “infiltrativo” (sec. Ming, 1977) Early gastric cancer

CLASSIFICAZIONE ISTOLOGICA (sec. Lauren, 1965) Adenocarcinoma di tipo “intestinale” Lesione organizzata in strutture di tipo ghiandolare ben differenziate, simili a quelle che normalmente costituiscono la mucosa gastrica Preceduto da precancerosi

CLASSIFICAZIONE ISTOLOGICA (sec. Lauren, 1965) Adenocarcinoma di tipo “intestinale” • più frequente • età avanzata (>40 anni) • prevalente localizzazione antrale/cardiale • prognosi migliore • aree ad elevato rischio

CLASSIFICAZIONE ISTOLOGICA (sec. Lauren, 1965) Adenocarcinoma di tipo “diffuso” Lesione costituita da cellule aggregate o singole che infiltrano la parete gastrica, anche negli strati profondi, senza organizzazione in strutture definite Non preceduto da precancerosi

CLASSIFICAZIONE ISTOLOGICA (sec. Lauren, 1965) Adenocarcinoma di tipo “diffuso” • • meno frequente non localizzazione prevalente prognosi peggiore prevalenza sovrapponibile in tutto il mondo

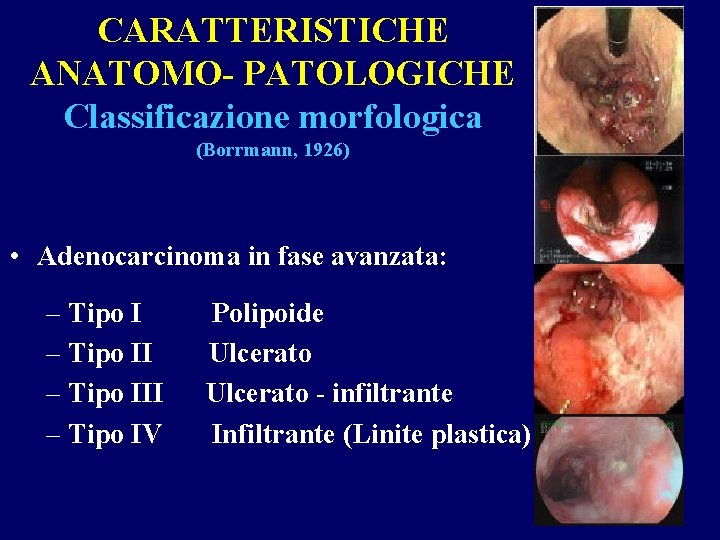
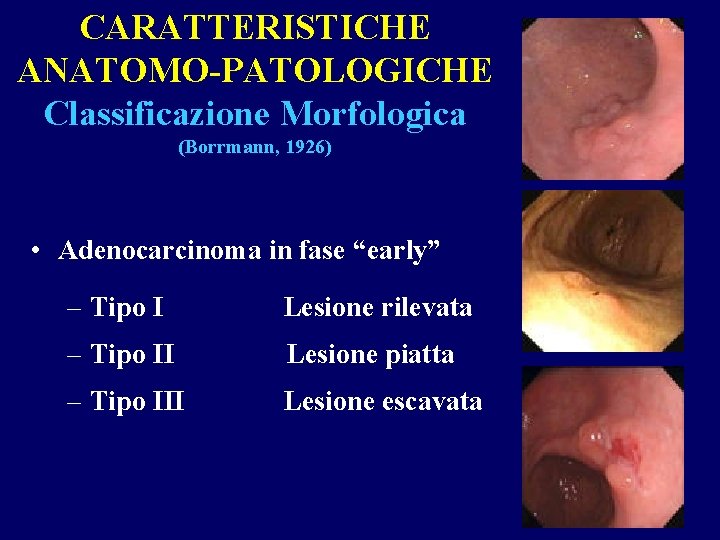
CARATTERISTICHE ANATOMO- PATOLOGICHE Classificazione morfologica (Borrmann, 1926) • Adenocarcinoma in fase avanzata: – Tipo III – Tipo IV Polipoide Ulcerato - infiltrante Infiltrante (Linite plastica)

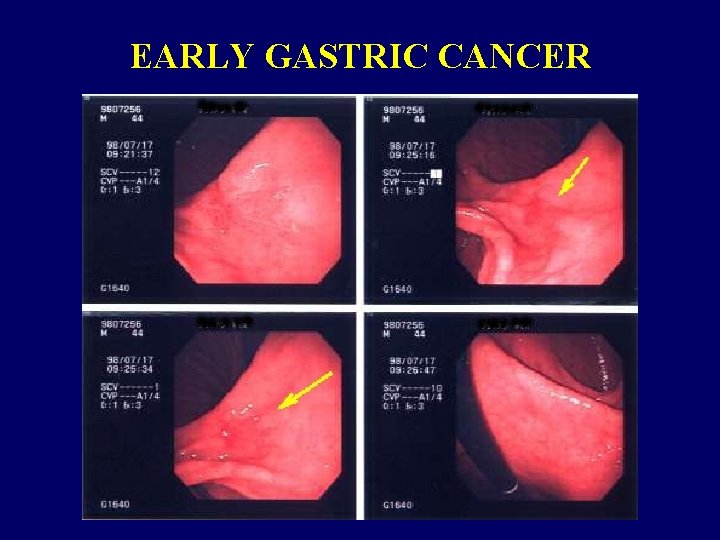
CLASSIFICAZIONE ISTOLOGICA Early gastric cancer Entità anatomo-clinica caratterizzata da una neoplasia localizzata nella mucosa e sottomucosa, senza infiltrazione della muscolaris propria

EARLY GASTRIC CANCER

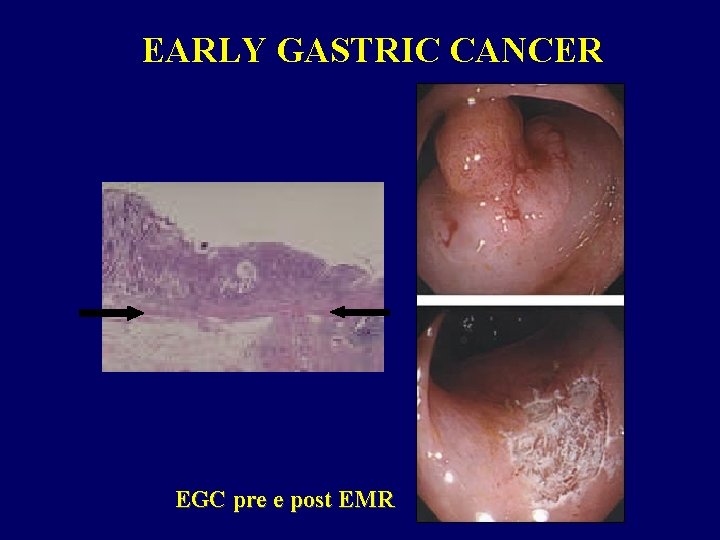
EARLY GASTRIC CANCER EGC pre e post EMR

CARATTERISTICHE ANATOMO- PATOLOGICHE Early gastric cancer Prevalenza : Europa –USA = 10 -20% Giappone = 50% Interessamento linfonodale presente nel 5% - 20% dei casi Sopravvivenza a 5 anni superiore al 90%, dopo asportazione

CARATTERISTICHE ANATOMO-PATOLOGICHE Classificazione Morfologica (Borrmann, 1926) • Adenocarcinoma in fase “early” – Tipo I Lesione rilevata – Tipo II Lesione piatta – Tipo III Lesione escavata

PROGNOSI Fattori legati alla neoplasia • Tipo istologico - tipo “intestinale” = migliore - tipo “diffuso” = peggiore (alterazioni genetiche e/o del contenuto di DNA) • Localizzazione antro = migliore • Profondità di invasione della mucosa metastasi linfonodali e a distanza

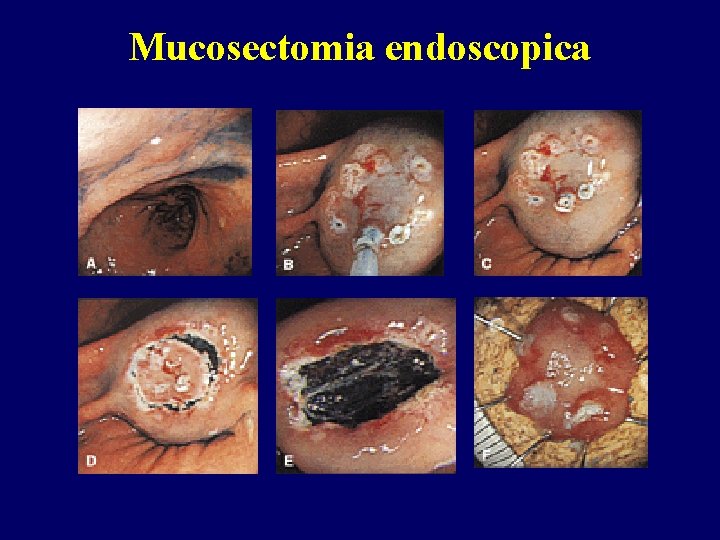
Mucosectomia endoscopica

ADENOCARCINOMA INTESTINALE EPIDEMIOLOGIA Prevalenza variabile nelle diverse aree geografiche • Elevata: – Giappone (70 / 100. 000 / anno - maschi) – Cina – Colombia - Perù – Finlandia – Cecoslovacchia - Polonia

ADENOCARCINOMA INTESTINALE EPIDEMIOLOGIA Prevalenza variabile nelle diverse aree geografiche • Ridotta: – America del Nord – Europa Occidentale – Australia / Nuova Zelanda – Israele

ADENOCARCINOMA INTESTINALE EPIDEMIOLOGIA Prevalenza geografica in Italia Maschi : 35 / 100. 000 / anno Femmine : 25 / 100. 000 / anno Italia centro – nord prevalenza doppia rispetto Italia sud e isole Regioni a maggior prevalenza : San Marino (80 / 100. 000 / anno) Toscana Emilia-Romagna Lombardia orientale

ADENOCARCINOMA INTESTINALE EPIDEMIOLOGIA Modificazioni della prevalenza di sede negli ultimi 30 anni Diminuzione della localizzazione gastrica (antro-corpo) Aumento della localizzazione a livello della giunzione gastro - esofagea (40% dei casi)

ADENOCARCINOMA EZIOLOGIA – Fattori ambientali (tipo intestinale) – Fattori genetici (tipo diffuso) – Fattori di rischio (tipo intestinale) Fattori ambientali e socio-economici > Fattori genetici nell’eziologia dell’adenocarcinoma di tipo “intestinale”

PROTOCOLLO DI FOLLOW-UP Timing dell’endoscopia • Gastrite Cronica atrofica + M. I. (età < 60 anni) – 2 - 3 anni • Ulcera gastrica benigna (dopo 1 a endoscopia) – 3 - 6 mesi • Polipi gastrici (dopo asportazione) – 2 anni • Gastroresezione ( a 15 anni dall’intervento) – 2 anni

PROTOCOLLO DI FOLLOW-UP • Gastropatia di Menetrier – 2 - 3 anni • Displasia epiteliale gastrica – Basso grado 6 - 12 mesi – Alto grado Chirurgia

CLINICA Stadio pre-neoplastico • • SINTOMI: Aspecifici (Dispepsia) o Assenti SEGNI: Obiettività negativa LABORATORIO: Normale RISCONTRO DI CONDIZIONI O LESIONI PRECANCEROSE

CLINICA Stadio precoce • SINTOMI: Aspecifici o Assenti • SEGNI: Obiettività negativa • LABORATORIO: – Riduzione emoglobina – Sideropenia – Positività sangue nelle feci – Elevati livelli di CEA e/o CA 19 -9

CLINICA Stadio tardivo • SINTOMI: – Dolore epigastrico, sazietà precoce, disfagia – Nausea, vomito alimentare – Melena / Ematemesi

CLINICA Stadio tardivo • LABORATORIO: – Anemia – Sideropenia – Positività sangue occulto nelle feci – Incremento degli indici di flogosi – Incremento degli indici di colestasi – Elevati livelli di CEA e/o CA 19 -9

CLINICA Stadio tardivo • TECNICHE DI IMMAGINE: - Invasione loco-regionale - Metastasi epatiche / polmonari - Metastasi peritoneali e ossee 90% 50% 10% • ANTIGENE CARCINO-EMBRIONARIO (CEA): - Non specifico - Scarsa utilità diagnostica - Utile nel follow-up

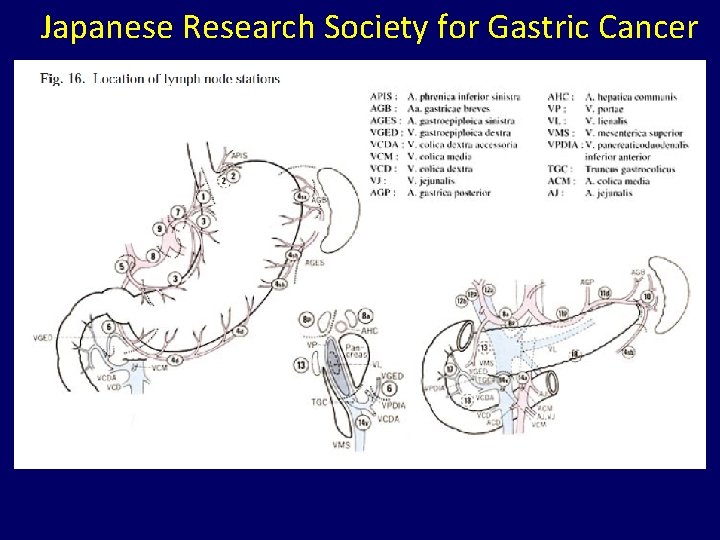
Japanese Research Society for Gastric Cancer

Lymph node station numbers according to the Japanese classification of gastric cancer of the 14 th edition.

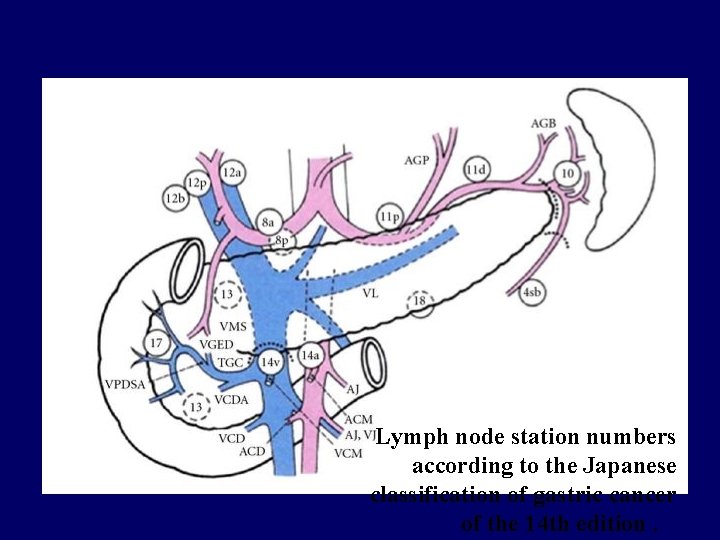
Japanese Research Society for Gastric Cancer

Lymph node station numbers according to the Japanese classification of gastric cancer of the 14 th edition.

PROGNOSI Stadiazione della neoplasia • Classificazione TNM per stadiazione della neoplasia: • T (T 1 -T 4) Tumore primitivo : estensione locale della lesione • N (N 0 -N 3) Linfonodi loco-regionali : interessamento linfonodale • M (M 0 -M 1) Metastasi a distanza

PROGNOSI Fattori legati al paziente • Età (giovani e anziani = peggiori) • Patologie associate

LINFOMA GASTRICO • Maggiore frequenza nella popolazione maschile • Maggiore frequenza dopo i 50 anni di età • Alta e bassa malignità • Sintomatologia sovrapponibile a quella dell’adenocarcinoma • Associazione con infezione da Helicobacter pylori ( MALToma)

LINFOMA MALT Mucosal-Associated Linfoid Tissue • Linfoma di tipo B non-Hodgkin, a basso grado di malignità • Prevalenza sovrapponibile nei due sessi • Ruolo eziologico dell’Helicobacter pylori: massiva infiltrazione linfocitaria (iperplasia follicolare) della mucosa gastrica • Assenza di tessuto linfatico organizato (MALT) nella mucosa gastrica normale

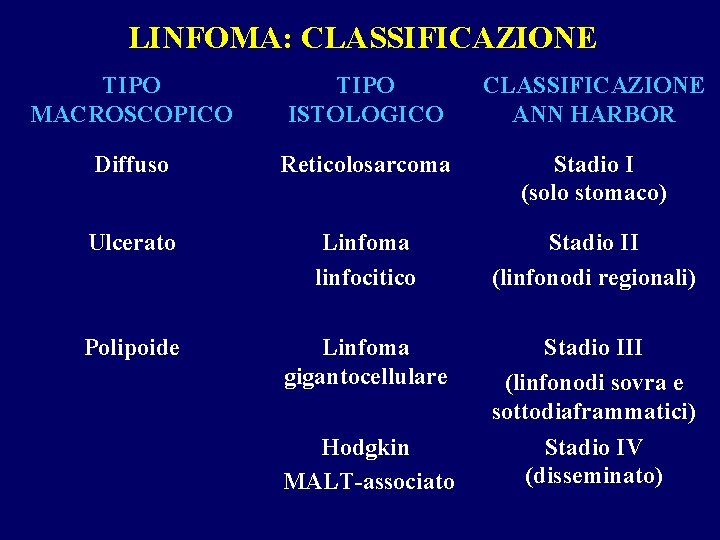
LINFOMA: CLASSIFICAZIONE TIPO MACROSCOPICO TIPO ISTOLOGICO CLASSIFICAZIONE ANN HARBOR Diffuso Reticolosarcoma Stadio I (solo stomaco) Ulcerato Linfoma linfocitico Stadio II (linfonodi regionali) Polipoide Linfoma gigantocellulare Stadio III (linfonodi sovra e sottodiaframmatici) Hodgkin MALT-associato Stadio IV (disseminato)

DIAGNOSTICA STRUMENTALE Diagnosi di lesione • RADIOLOGIA CON DOPPIO MEZZO DI CONTRASTO – – Scarsa distensibilità della parete gastrica Lesioni escavate irregolari ed asimettriche Lesioni protrudenti irregolari Irregolarità delle pliche gastriche – Sensibilità diagnostica = 80% – Scarsa sensibilità per lesioni <10 mm. – Difficile diagnosi differenziale con ulcera peptica e linfoma

DIAGNOSTICA STRUMENTALE Diagnosi di lesione • ENDOSCOPIA – Visione diretta della mucosa gastrica – Possibilità di prelievi bioptici mirati – Possibilità di citologia con Brushing – Sensibilità diagnostica = 96% - 99% – Diagnosi di lesioni in fase “early”

STADIAZIONE DELLA MALATTIA • ECOTOMOGRAFIA DELL’ADDOME – Metastasi epatiche – Ascite – Linfonodi loco-regionali – Parete gastrica • TOMOGRAFIA COMPUTERIZZATA (TAC) – Infiltrazione loco-regionale – Metastasi peritoneali – Metastasi S. N. C.

STADIAZIONE DELLA MALATTIA • RADIOLOGIA STANDARD DEL TORACE – Metastasi polmonari • SCINTIGRAFIA OSSEA – Metastasi ossee • ULTRASONOGRAFIA ENDOSCOPICA – Lesioni in fase precoce – Profondità di infiltrazione della lesione

TERAPIA Chirurgia radicale • Indicata in assenza di metastasi a distanza guarigione completa è possibile in meno del 50% dei casi • Gastrectomia: – Subtotale (60% dello stomaco): antro – Subtotale allargata (90% dello stomaco): corpo – Totale: corpo-fondo, linite plastica • Asportazione dei linfonodi loco-regionali

TERAPIA Chirurgia palliativa • Sopravvivenza media di 8 -12 mesi • Indicata in caso di: – Ostruzione, – Sanguinamento, – Dolore intrattabile

TERAPIA Endoscopia palliativa • • Neodimium-yag laser per lesioni vegetanti Argoni Laser per lesioni sanguinanti Inserzione di endoprotesi per lesioni ostruttive Gastrostomia percutanea per mantenimento della nutrizione • Minore morbidità, migliore tollerabilità rispetto alla chirurgia palliativa

TERAPIA Chemioterapia • Recidiva neoplastica nel 30% di pazienti operati con successo è efficace nel ridurre la massa tumorale • Risultati parziali nel 20%-50% dei casi a 6 mesi • Risposta completa in meno del 10% dei casi

TERAPIA Chemioterapia • Coadiuvante: nel periodo post-operatorio per il trattamento delle micrometastasi • Neoadiuvante: nel periodo pre-operatorio per ridurre il rischio di metastasi

PROGNOSI Sopravvivenza a 5 anni del 5% - 15% nei pazienti dopo la prima diagnosi di adenocarcinoma
 Tumore filloide classificazione
Tumore filloide classificazione Ostruzione dotti biliari
Ostruzione dotti biliari Stomaco
Stomaco Classificazione lauren stomaco
Classificazione lauren stomaco Bartolomeo pepe patologie
Bartolomeo pepe patologie Tumore prostata gleason 3+3
Tumore prostata gleason 3+3 Stadiazione tnm
Stadiazione tnm Duodenocefalopancreasectomia sopravvivenza
Duodenocefalopancreasectomia sopravvivenza Kraniofaringeom
Kraniofaringeom Epifiza osoasa
Epifiza osoasa Istituto toscano tumori
Istituto toscano tumori Batterio nello stomaco
Batterio nello stomaco Intestino crasso cieco
Intestino crasso cieco Incisura angolare stomaco
Incisura angolare stomaco Posizione stomaco
Posizione stomaco Polipo iperplastico stomaco
Polipo iperplastico stomaco Il viaggio del cibo scuola primaria
Il viaggio del cibo scuola primaria Esofago bovino anatomia
Esofago bovino anatomia Mappa concettuale sui carboidrati
Mappa concettuale sui carboidrati Chou pei suan ching
Chou pei suan ching Segno dell'otturatorio
Segno dell'otturatorio Sublimazione esperimento
Sublimazione esperimento La gestione per conto dello stato corso sicurezza
La gestione per conto dello stato corso sicurezza Il processo di formazione dello stato moderno
Il processo di formazione dello stato moderno Nervi
Nervi Il popolo è l'elemento
Il popolo è l'elemento Divisa rfi
Divisa rfi Occhiello giornale
Occhiello giornale Frutti dello spirito santo
Frutti dello spirito santo Istituto comprensivo palazzolo dello stella
Istituto comprensivo palazzolo dello stella Sezioni di solidi con piani inclinati
Sezioni di solidi con piani inclinati Ordinamento della repubblica
Ordinamento della repubblica Paola di blasio
Paola di blasio Donato calista dermatologo
Donato calista dermatologo Giustificazione dello schiavismo versione greco
Giustificazione dello schiavismo versione greco Panateri
Panateri Taccuino dello scrittore attivatori
Taccuino dello scrittore attivatori Il popolo è l'elemento materiale dello stato
Il popolo è l'elemento materiale dello stato Effetto dello ione comune
Effetto dello ione comune Conto economico e stato patrimoniale
Conto economico e stato patrimoniale Profilo dello studente
Profilo dello studente Gestione dello stress lavorativo
Gestione dello stress lavorativo Caratteristiche dello statuto albertino
Caratteristiche dello statuto albertino Le funzioni dello scheletro
Le funzioni dello scheletro Sottostruttura ottima
Sottostruttura ottima Tecnica dello sceneggiato
Tecnica dello sceneggiato Schema della fabula
Schema della fabula