Tumor immunoterpia a tumorspecifikus immunits kivltsa TUMOR Tumor


















- Slides: 31

Tumor immunoterápia: a tumor-specifikus immunitás kiváltása

TUMOR Tumor (neoplázia): növekedési kontrol (immunosurveillance) alól elszabadult sejtek csoportja Benignus (jóindulatú) korlátozott növekedés Malignus (rosszindulatú) korlátlan növekedés (rák) Metastasis: áttét Carcinoma: embrionális ektoderma, vagy endoderma eredetű Sarcoma: mezodermális kötőszövet (szövet, csont) „ Leukémia: hematopoietikus sejt eredetű Limfóma: csontvelői hematopoetikus sejtekből A sejtek malignus transzformációja: • Kémiai karcinogén anyagok • Besugárzás • Vírusok mutáció , transzformáció

Tumorsejtek immun-átszerkesztése és szelekciója fejlődő tumor sejtek túlélő tumor sejt variánsok Nem transzformált sejtek Ellenőrzés alól elszabadult osztódó tumorsejtek, újabb variánsok

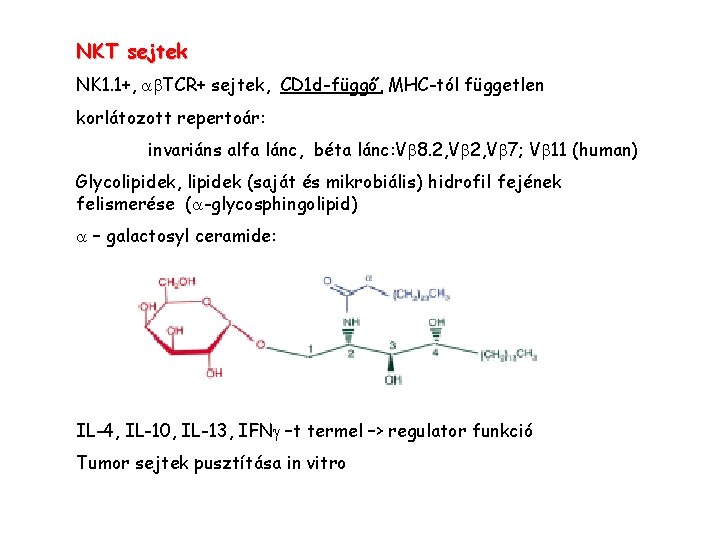
NKT sejtek NK 1. 1+, a TCR+ sejtek, CD 1 d-függő, MHC-tól független korlátozott repertoár: invariáns alfa lánc, béta lánc: V 8. 2, V 7; V 11 (human) Glycolipidek, lipidek (saját és mikrobiális) hidrofil fejének felismerése (a-glycosphingolipid) a – galactosyl ceramide: IL-4, IL-10, IL-13, IFNg –t termel –> regulator funkció Tumor sejtek pusztítása in vitro

NKT sejtek által közvetített tumor ellenes hatás modellje a-gal-cer anti-metastatikus hatása: indirekt hatás NK sejtekre, - T sejtek ? B sejtek? ? Fas. L-, TRAIL -, TNF- hiányos egérben, anti-IL 4 mellett nincs hatás. Prolifeláció és vascularizáció gátlása, tumor hypoxia

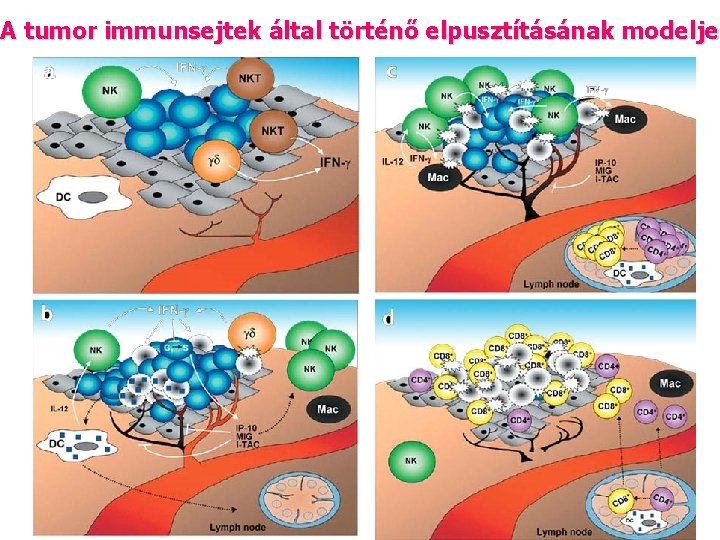
A tumor immunsejtek által történő elpusztításának modelje

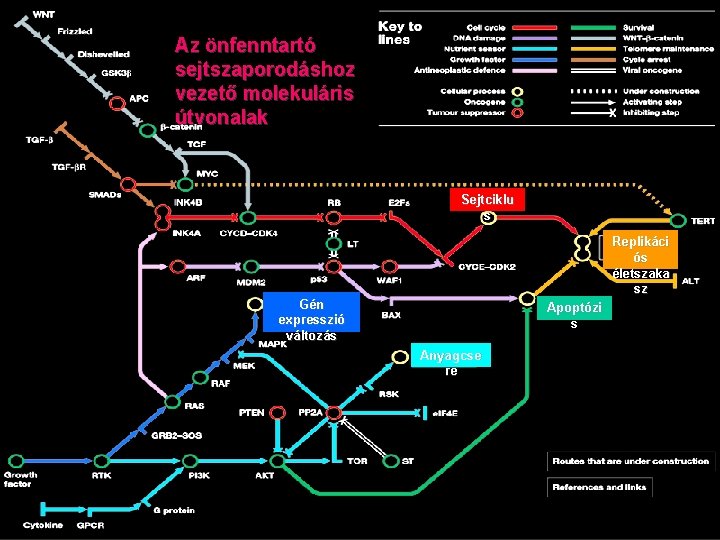
Az önfenntartó sejtszaporodáshoz vezető molekuláris útvonalak Sejtciklu s Replikáci ós életszaka sz Gén expresszió változás Apoptózi s Anyagcse re

Sejt ciklus: tumor szuppresszor fehérjék ellenőrzése alatt áll G 1 fázisban külső+belső jelek alapján döntenek a nyugvó állapot vagy a sejtciklusba lépés között További ellenőrzési pontok későbbi fázisban Tumor szuppressziós útvonalak gátoltak • retonoblastoma (RB) út: E 2 F transzkripciós faktorok által ellenőrzött gének(sejtciklus) expresszióját gátolja, foszforilációtól függően inaktiválódik, cyclin dependens kinázok szabályozzák • P 53 út: apoptózist aktivál, gátolja a sejtciklusba lépést (CDK inhibitort aktivál) Normális sejt: RAS út tartós aktiválása aktiválja az RB és p 53 utat> befagyasztja a sejtciklust - védekező mechanizmus TGF út: ser/thr kinázok aktiválása -> SMAD transzkripciós faktorok aktiválása sejtciklust szabályozó gének (CDK gátlók, Myc onkogén).

Tumor kialakulásában szerepet játszó gének: tumor gének Ø 291 tumor gént azonosítottak, ez több mint 1 %-a a teljes genomnak ØEzek 90 %-a szomatikus mutáción esett át, 20 % embrionális mutációt, 10 % mindkettőt tartalmaz ØKromoszóma transzlokáció a leggyakoribb – kiméra gén ØA legtöbb tumor gént azonosították leukémia, limfóma és szarkóma esetében. Ezek csak 10 %-át adják az összes tumoros betegségeknek ØA legközönségesebb domén, amely a tumor gének által kódolt: protein kináz 2004 -es felmérés

Kromoszóma transzlokáció Burkitt limfómában EBV fertőzés: c-myc az áthelyeződik az Ig H lánc enhancer régiójához – B sejtek korlátlan növekedése

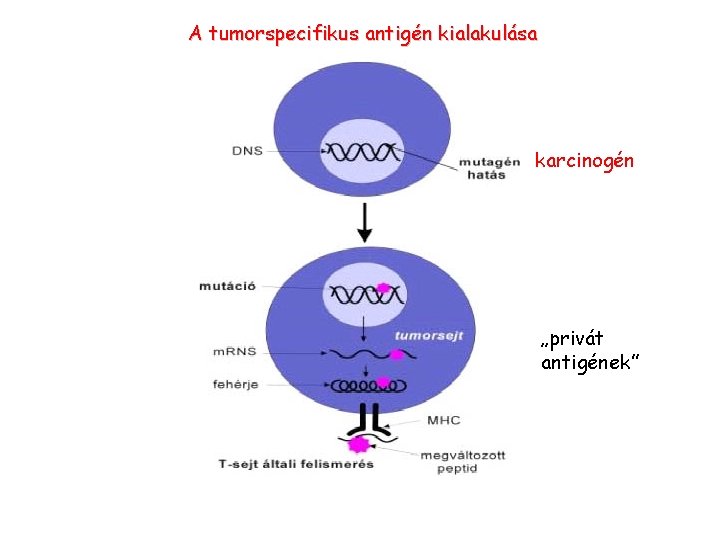
A tumorspecifikus antigén kialakulása karcinogén „privát antigének”

Onkogén: a sejttranszformációt kiváltó fehérjét kódoló gén 1910: Rous sarcoma virus: v-src (c-src) 1966 Nobel díj (csirke szarkóma sejtek szűrlete RNS vírust tartalmaz) Normális sejtekben: proto-onkogének, proto-onkogének a sejtproliferációt, sejtciklust, túlélést, illetve apoptózist szabályozó fehérjék Mutáció, transzlokáció következtében megváltozik: Øaktivitásuk, Ømennyiségük, Øfunkciójuk

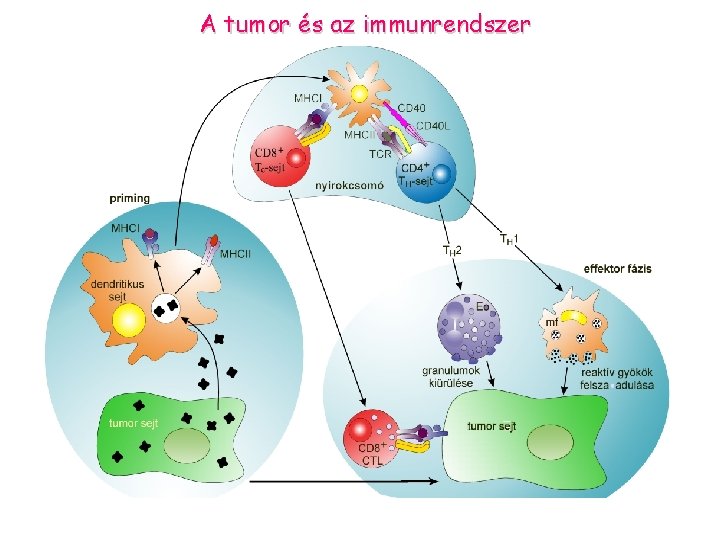
A tumor és az immunrendszer

Tumor „megszökése” az immunrendszer elől: Ø· alacsony MHCI expresszió, csökkent prezentáció Ø· nincs MHCII expresszió - TH sejteket nem aktivál Ø· kostimulátor molekulák (B 7) hiánya Ø· tumorsejt terméke elnyomja immunválaszt (TGF , IL-10) Ø· a gazdaszervezet toleranciája Ø· mutáns tumor sejtek elszaporodása, amelyek nem expresszálnak peptid- MHCI komplexet Ø· antigén moduláció: tumor antigének elveszitése, vagy elrejtése ellenanyagok által Ø· rezisztens tumor kialakulása Ø· tumor antigének elfedése sziálsav tartalmu mukopoliszaharidok által „antigen masking”

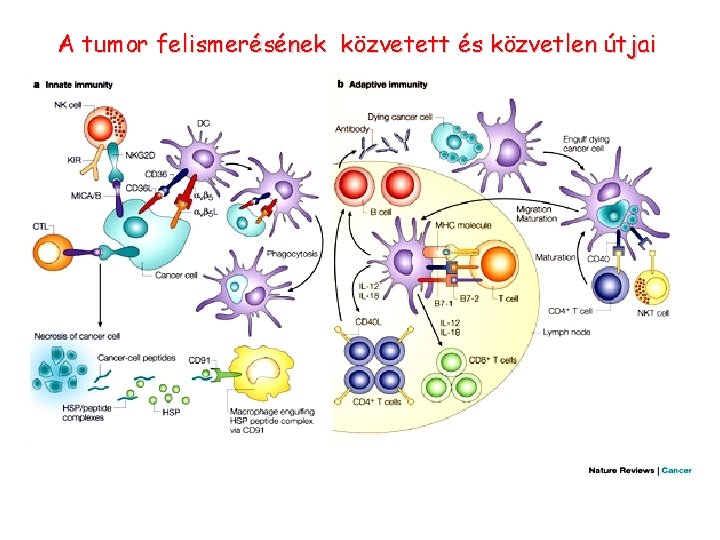
A tumor felismerésének közvetett és közvetlen útjai

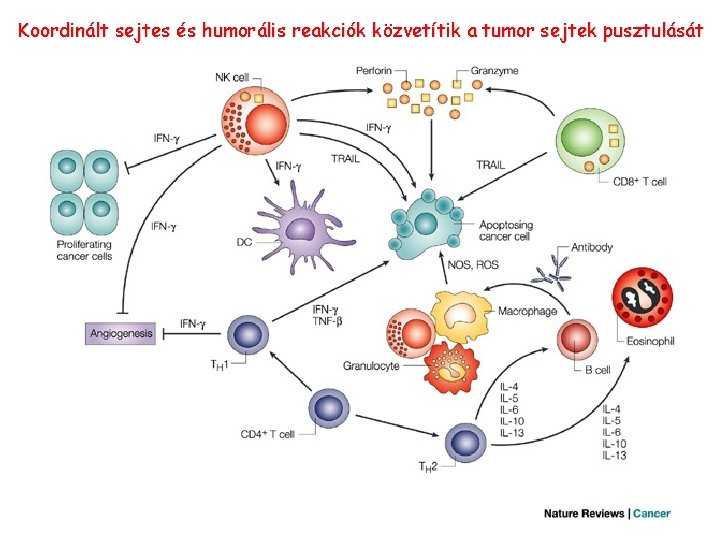
Koordinált sejtes és humorális reakciók közvetítik a tumor sejtek pusztulását

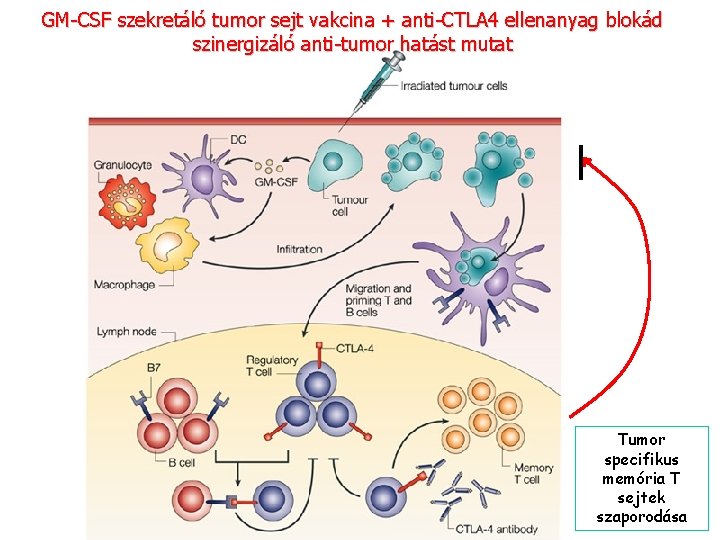
GM-CSF szekretáló tumor sejt vakcina + anti-CTLA 4 ellenanyag blokád szinergizáló anti-tumor hatást mutat Tumor specifikus memória T sejtek szaporodása

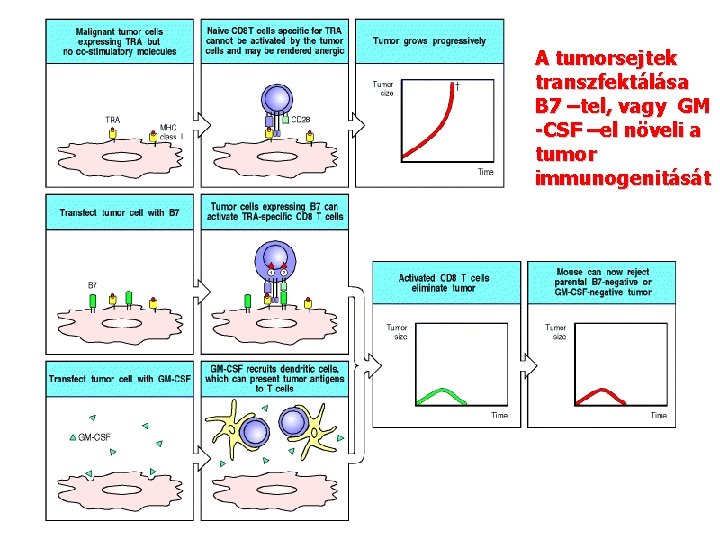
A tumorsejtek transzfektálása B 7 –tel, vagy GM -CSF –el növeli a tumor immunogenitását

• A tumor antigéneket felismerheti mind a természetes, mind a szerzett immunrendszer. • A gazdaszervezet citokin termelése elnyomhatja a tumor képződést az infekció, gyulladás és az immunválasz szabályozása révén • A tumor sejtek felhasználhatják a gazda citokinjeit a szaporodás elősegítésére, az apoptózistól való megmenekülésre és a szétterjedésre • Citokinek szisztémás alkalmazása anti-tumor hatású, de súlyos toxikus mellékhatásokkal jár, mint pl. infekció, ez behatárolja az alkalmazást. • Tumor sejteket genetikai manipulációval módosítani lehet immunstimuláló citokinek termelésére, ezek tumor vakcinák alapjait képezhetik • CTLA-4 blokkoló receptor gátlása ellenanyaggal ígéretes stratégia a tumor vakcina hatékonyságának növelésére, de rizikó faktor –saját antigénekkel szembeni toleranciát is elnyomhatja.

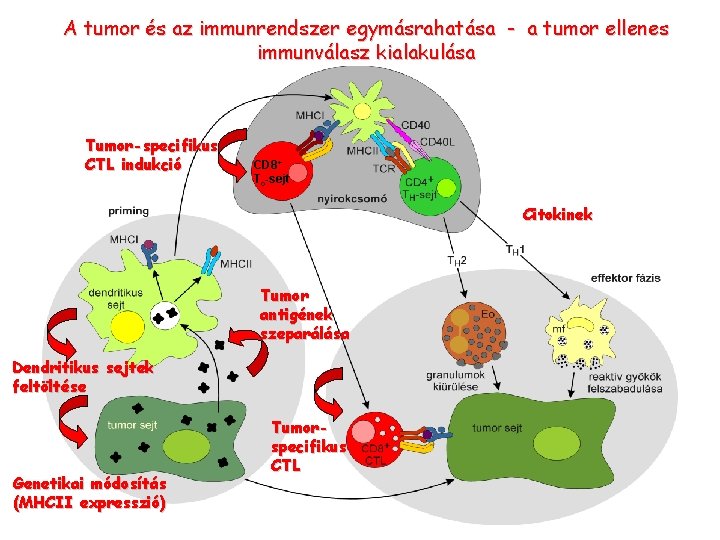
A tumor és az immunrendszer egymásrahatása - a tumor ellenes immunválasz kialakulása Tumor-specifikus CTL indukció CD 8+ Tc-sejt Citokinek Tumor antigének szeparálása Dendritikus sejtek feltöltése Genetikai módosítás (MHCII expresszió) Tumorspecifikus CTL


IMMUNTERÁPIA CÉL: a gazdaszervezet tumorspecifikus immunválaszának fokozása Tumor antigének: Tumor sejtekben a mutációk gyakorisága nagy => fehérje expresszió a normálistól eltér Oncogén virusok által indukált tumor: vírus fehérjék expressziója (CTL aktiválás) Abnormális szerkezetű lipidek, szénhidrátok szintézise (B sejtek aktiválása) Tumor specifikus antigének -normális sejten nincs Tumor asszociált antigének - normális sejten is van -tolerogén

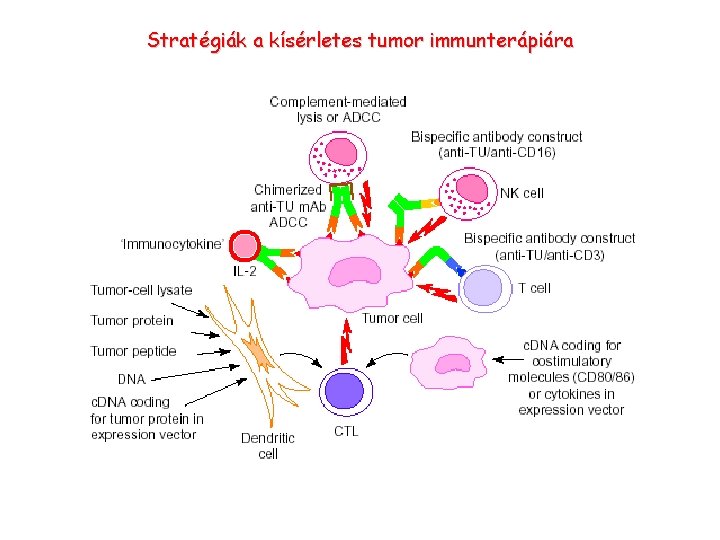
Stratégiák a kísérletes tumor immunterápiára

TUMOR ANTIGÉNEK Tumor ellen gazdaszervezet immunválasszal reagál: Ølimfocita függő ØSpecifikus Øtumor ellenes ellenanyagok Ømemória van „Immunsurveilance” - tumor elpusztítására Øtumor specifikus antigének (TSA) - csak az adott tumorra jellemző MHC-hez kötődött peptidek Øtumorhoz asszociált antigének (TAA) - embrionális gének termékeimennyiségi növekedés 50 x- 100 x Tumor antigének izolálása: c. DNS könyvtárból - CTL segítségével, tumor sejtek felszínéről savas elucióval

Citotoxikus T sejt klónok előállítása: in vitro: melanoma sejt tenyészet (tumorból) + limfociták (betegből) Tumor specifikus CTL Tumor c. DNS könyvtár transzfektálás MHCI+ célsejtekbe : Tumor antigént bemutató sejtek Együtt tenyésztés, amelyik sejt elpusztult az tartalmazta a megfelelő tumor peptidet Izolálás, szekvenálás tumor ag.

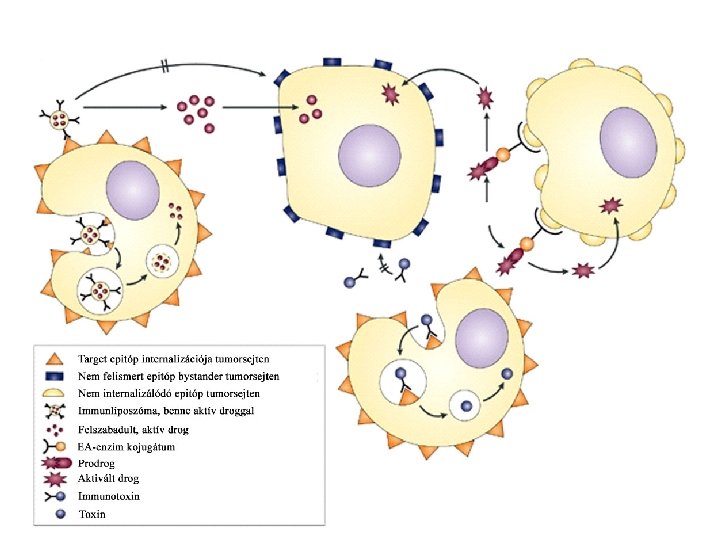
Természetes módon processzált tumor peptidek előállításának módjai Peptid bejuttatása a sejtbe: • Liposzóma (MHCII) • Kiméra baktérium (MHCII) • Vírus kiméra –minigen (MHCI)

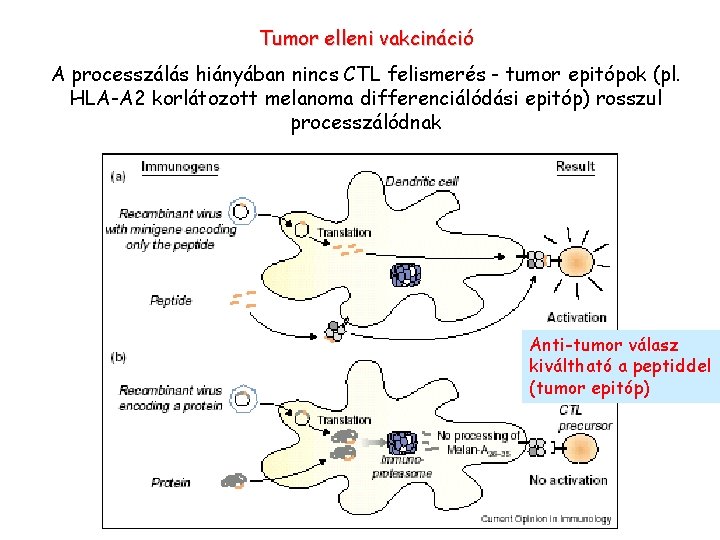
Tumor elleni vakcináció A processzálás hiányában nincs CTL felismerés - tumor epitópok (pl. HLA-A 2 korlátozott melanoma differenciálódási epitóp) rosszul processzálódnak Anti-tumor válasz kiváltható a peptiddel (tumor epitóp)

Peptidek terápiás alkalmazása Szintetikus peptidek Természetes peptidek Előny Immunválasz specifitása sokféle ag keveréke Korlátlan mennyiség több betegnél Nagy tisztaság CD 4 CD 8 T akt. Kevés tumor sejten ellenőrizhető CD 4, CD 8 T aktiválás Hátrány Tumorspecifitásra nincs bizonyíték, sok tumor sejt kell Néhány betegnél, alacsony koncentráció Mutáns sejtek megszökhetnek, autoimmunitás kialakulhat Autoimmunitás kialakulhat

Ellenanyag terápiák


 Immunoterpia
Immunoterpia Nature reviews cancer
Nature reviews cancer Borrmann classification of gastric cancer
Borrmann classification of gastric cancer Tumor lateral de cuello
Tumor lateral de cuello Borderline tumor jajnika
Borderline tumor jajnika Osteochondroma gross pathology
Osteochondroma gross pathology Cest la vie význam
Cest la vie význam Salivary gland tumor
Salivary gland tumor Nursing management of adrenal tumor
Nursing management of adrenal tumor Tumor detection
Tumor detection Tumor
Tumor Disembriyoplastik nöroepitelyal tümör
Disembriyoplastik nöroepitelyal tümör Tumor suppressor genes
Tumor suppressor genes Giant cell tumor
Giant cell tumor Malignizálódás
Malignizálódás Brain tumor
Brain tumor Warthin's tumor ultrasound images
Warthin's tumor ultrasound images Primitive neuroectodermal tumor
Primitive neuroectodermal tumor Haiv
Haiv Tümör lizis sendromu
Tümör lizis sendromu Jos fuchs
Jos fuchs Seks kord
Seks kord Courvoisier law
Courvoisier law Follicular carcinoma of thyroid
Follicular carcinoma of thyroid Proto onkogen nedir
Proto onkogen nedir Oncocytoma salivary gland
Oncocytoma salivary gland 09112007 color
09112007 color Benign tumor definition
Benign tumor definition Wartinov tumor
Wartinov tumor Difference between proto oncogene and oncogene
Difference between proto oncogene and oncogene Tumor suppressor gene
Tumor suppressor gene Grawitz tumor
Grawitz tumor