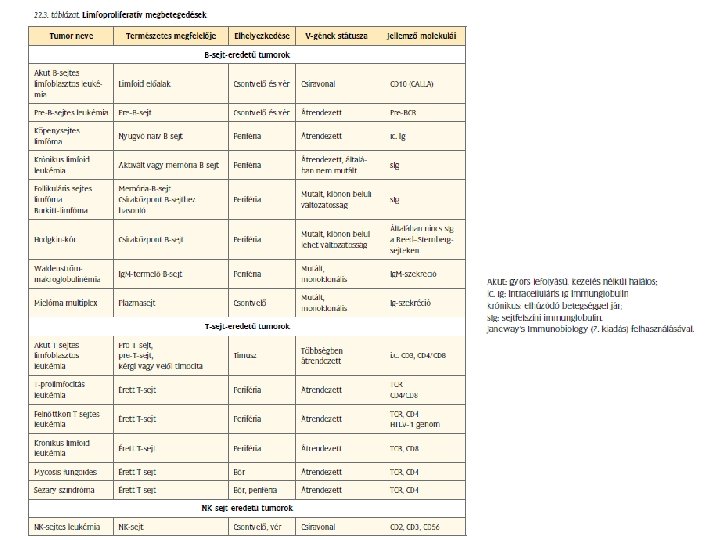
Tumor immunoterpia a tumorspecifikus immunits kivltsa TUMOR Tumor






























- Slides: 61

Tumor immunoterápia: a tumor-specifikus immunitás kiváltása

TUMOR Tumor (neoplázia): növekedési kontrol (immunosurveillance) alól elszabadult sejtek csoportja Benignus (jóindulatú) korlátozott növekedés Malignus (rosszindulatú) korlátlan növekedés (rák) Metastasis: áttét Carcinoma: embrionális ektoderma, vagy endoderma eredetű Sarcoma: mezodermális kötőszövet (szövet, csont) „ Leukémia: hematopoietikus sejt eredetű Limfóma: csontvelői hematopoetikus sejtekből A sejtek malignus transzformációja: • Kémiai karcinogén anyagok • Besugárzás • Vírusok mutáció , transzformáció

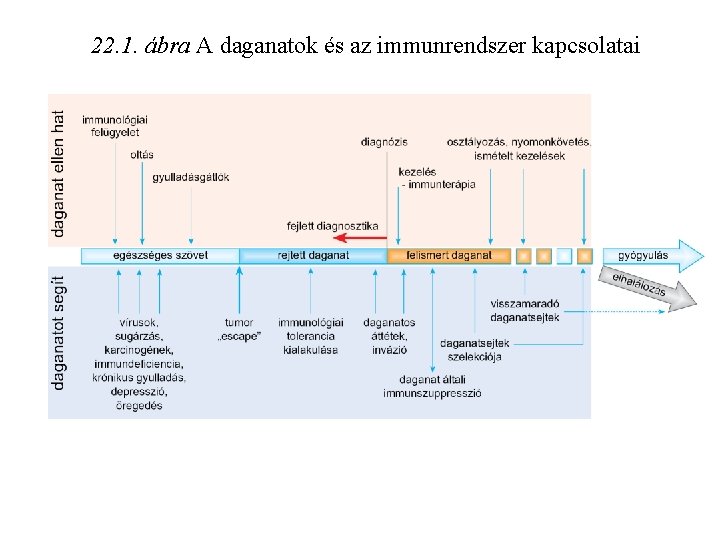
22. 1. ábra A daganatok és az immunrendszer kapcsolatai

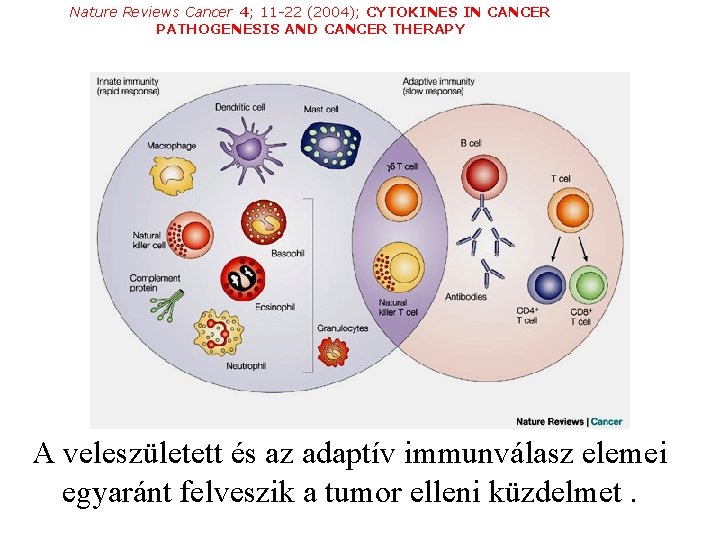
Nature Reviews Cancer 4; 11 -22 (2004); CYTOKINES IN CANCER PATHOGENESIS AND CANCER THERAPY A veleszületett és az adaptív immunválasz elemei egyaránt felveszik a tumor elleni küzdelmet.

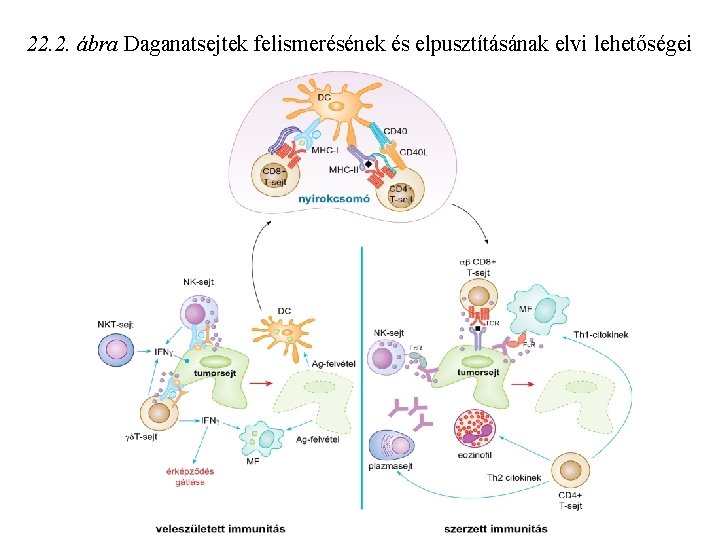
22. 2. ábra Daganatsejtek felismerésének és elpusztításának elvi lehetőségei

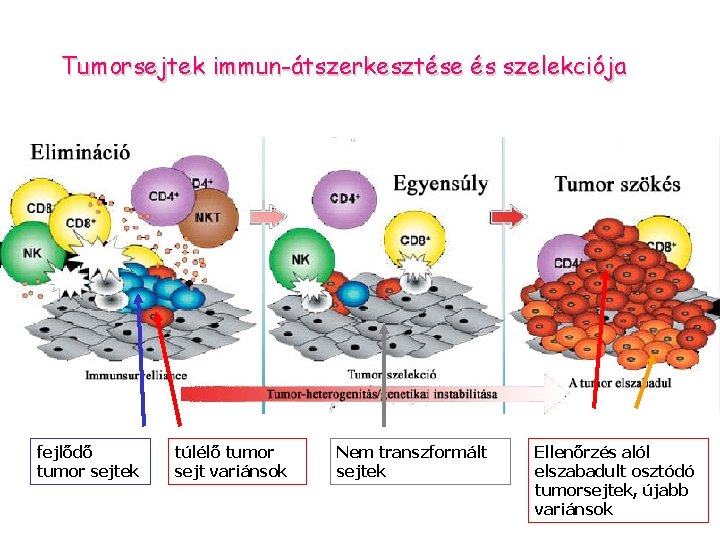
Tumorsejtek immun-átszerkesztése és szelekciója fejlődő tumor sejtek túlélő tumor sejt variánsok Nem transzformált sejtek Ellenőrzés alól elszabadult osztódó tumorsejtek, újabb variánsok

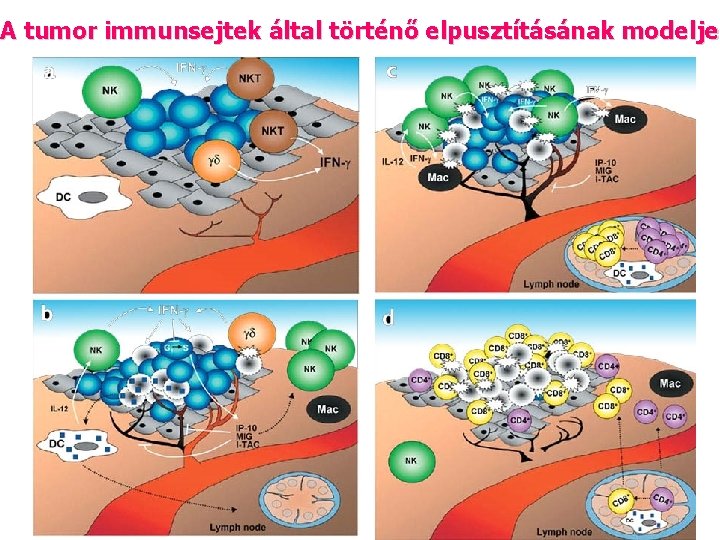
A tumor immunsejtek által történő elpusztításának modelje

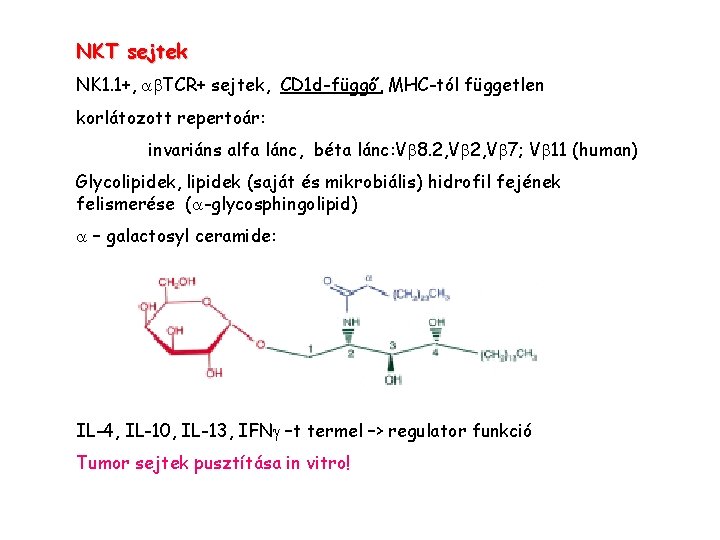
NKT sejtek NK 1. 1+, a TCR+ sejtek, CD 1 d-függő, MHC-tól független korlátozott repertoár: invariáns alfa lánc, béta lánc: V 8. 2, V 7; V 11 (human) Glycolipidek, lipidek (saját és mikrobiális) hidrofil fejének felismerése (a-glycosphingolipid) a – galactosyl ceramide: IL-4, IL-10, IL-13, IFNg –t termel –> regulator funkció Tumor sejtek pusztítása in vitro!

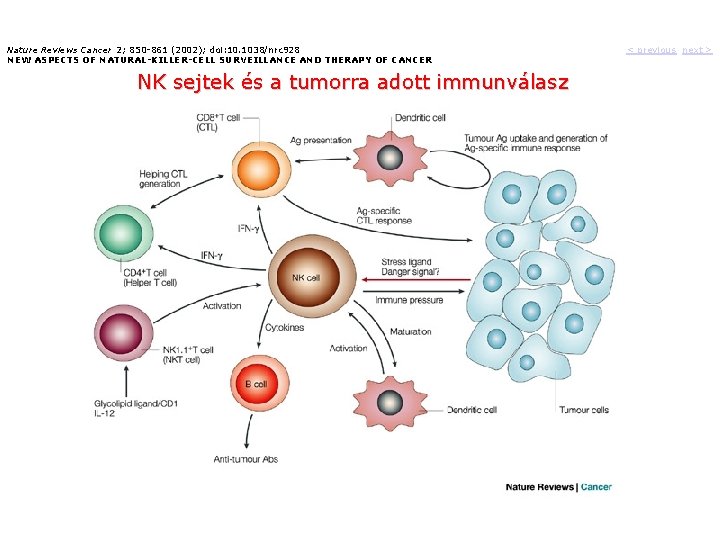
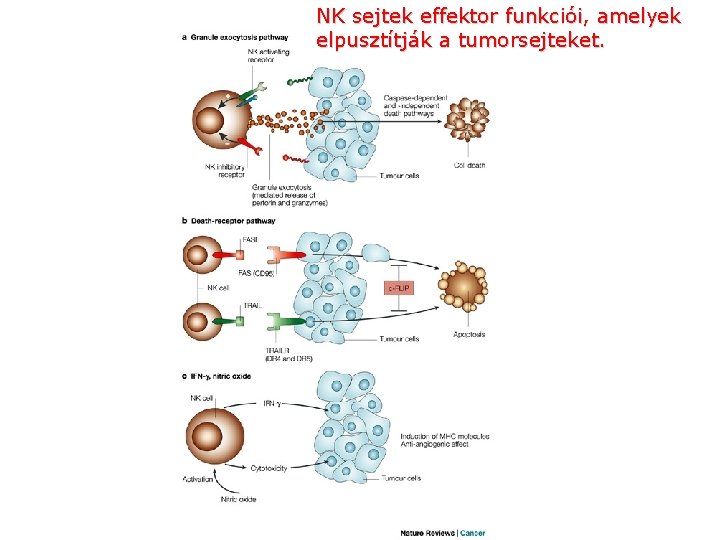
Nature Reviews Cancer 2; 850 -861 (2002); doi: 10. 1038/nrc 928 NEW ASPECTS OF NATURAL-KILLER-CELL SURVEILLANCE AND THERAPY OF CANCER NK sejtek és a tumorra adott immunválasz < previous next >

NK sejtek effektor funkciói, amelyek elpusztítják a tumorsejteket.

22. 3. ábra Tumorantigének kialakulása és megjelenése


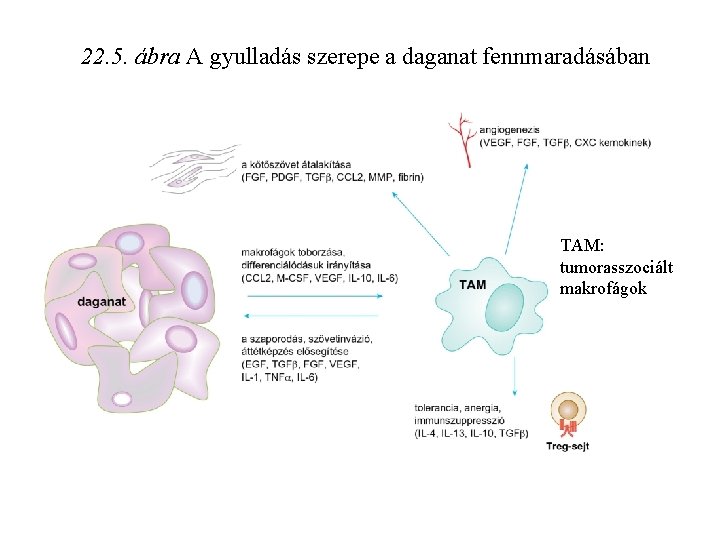
22. 5. ábra A gyulladás szerepe a daganat fennmaradásában TAM: tumorasszociált makrofágok

Immortalizáció: hallhatatlan sejtek Initiation (mutáció) Transzformáció Promotion: osztódási képesség fokozódik Kiváltó okok: - Xeroderma pigmentosum: UV specifikus endonuclease (DNA repair) hiánya bőrrák - Vírusok: (15 %), DNS vírusok - RNS vírusok (citoplazmában) -SV 40 (papilloma virus), polyoma - retrovírusok · Oncogen: rák-gén -> a transzformációt kiváltó fehérjét kódoló gén Rous sarcoma virus: v-src (c-src) · Proto-onkogens (cellular oncogens): sejtosztódást ellenörzö fehérjék csoportja

Onkogén: a sejttranszformációt kiváltó fehérjét kódoló gén 1910: Rous sarcoma virus: v-src (c-src) 1966 Nobel díj (csirke szarkóma sejtek szűrlete RNS vírust tartalmaz) Normális sejtekben: proto-onkogének, proto-onkogének a sejtproliferációt, sejtciklust, túlélést, illetve apoptózist szabályozó fehérjék Mutáció, transzlokáció következtében megváltozik: Øaktivitásuk, Ømennyiségük, Øfunkciójuk

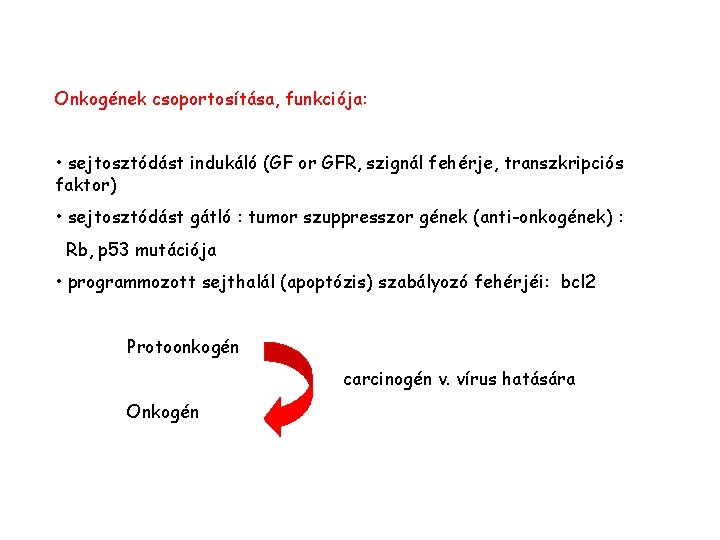
Onkogének csoportosítása, funkciója: • sejtosztódást indukáló (GF or GFR, szignál fehérje, transzkripciós faktor) • sejtosztódást gátló : tumor szuppresszor gének (anti-onkogének) : Rb, p 53 mutációja • programmozott sejthalál (apoptózis) szabályozó fehérjéi: bcl 2 Protoonkogén carcinogén v. vírus hatására Onkogén

Tumor kialakulásában szerepet játszó gének: tumor gének Ø 291 tumor gént azonosítottak, ez több mint 1 %-a a teljes genomnak ØEzek 90 %-a szomatikus mutáción esett át, 20 % embrionális mutációt, 10 % mindkettőt tartalmaz ØKromoszóma transzlokáció a leggyakoribb – kiméra gén ØA legtöbb tumor gént azonosították leukémia, limfóma és szarkóma esetében. Ezek csak 10 %-át adják az összes tumoros betegségeknek ØA legközönségesebb domén, amely a tumor gének által kódolt: protein kináz 2004 -es felmérés

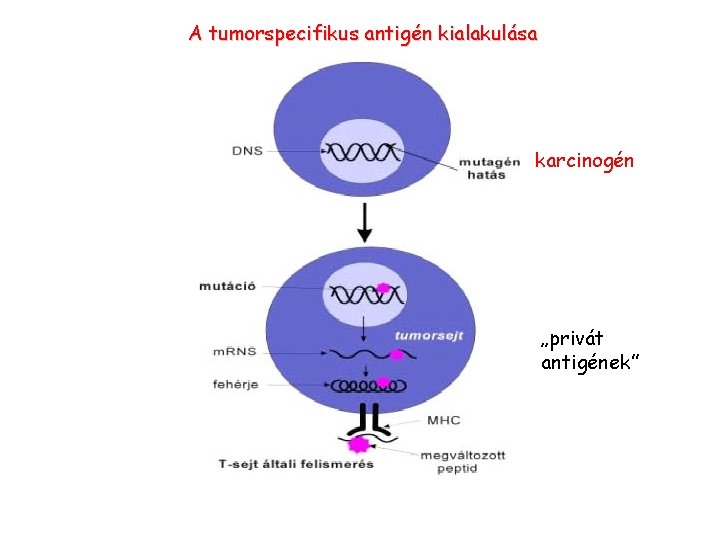
A tumorspecifikus antigén kialakulása karcinogén „privát antigének”

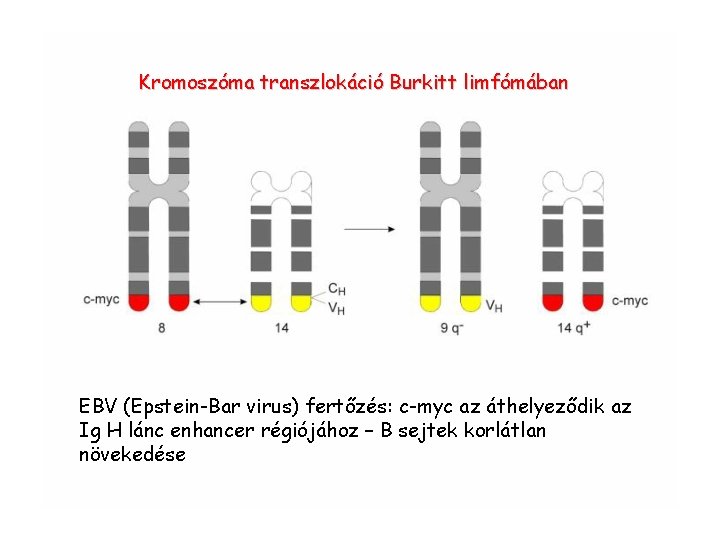
Kromoszóma transzlokáció Burkitt limfómában EBV (Epstein-Bar virus) fertőzés: c-myc az áthelyeződik az Ig H lánc enhancer régiójához – B sejtek korlátlan növekedése

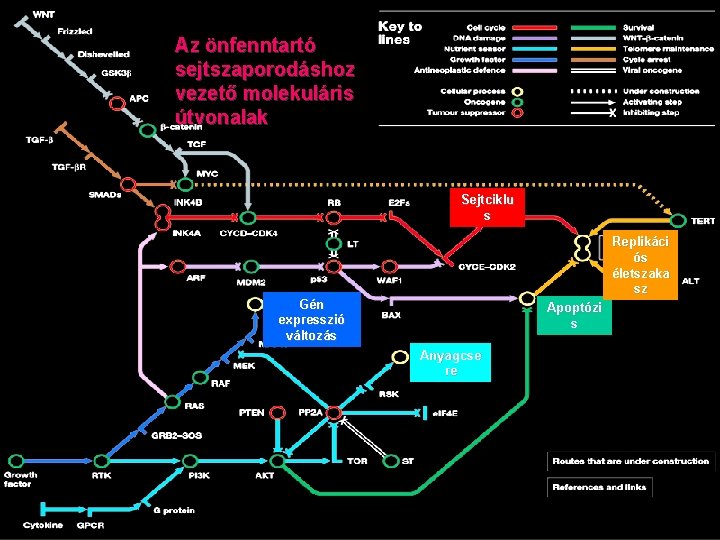
Az önfenntartó sejtszaporodáshoz vezető molekuláris útvonalak Sejtciklu s Replikáci ós életszaka sz Gén expresszió változás Apoptózi s Anyagcse re

Sejt ciklus: tumor szuppresszor fehérjék ellenőrzése alatt áll G 1 fázisban külső+belső jelek alapján döntenek a nyugvó állapot vagy a sejtciklusba lépés között További ellenőrzési pontok későbbi fázisban Tumor szuppressziós útvonalak gátoltak a tumorsejtekben • retonoblastoma (RB) út: E 2 F transzkripciós faktorok által ellenőrzött gének (sejtciklus) expresszióját gátolja, foszforilációtól függően inaktiválódik, a cyclin dependens kinázok szabályozzák • P 53 út: apoptózist aktivál, gátolja a sejtciklusba lépést (CDK inhibitort aktivál) Normális sejtben a RAS útvonal tartós aktiválása aktiválja az RB és p 53 utat-> befagyasztja a sejtciklust - védekező mechanizmus TGF út: ser/thr kinázok aktiválása -> SMAD transzkripciós faktorok aktiválása sejtciklust szabályozó gének (CDK gátlók, Myc onkogén).

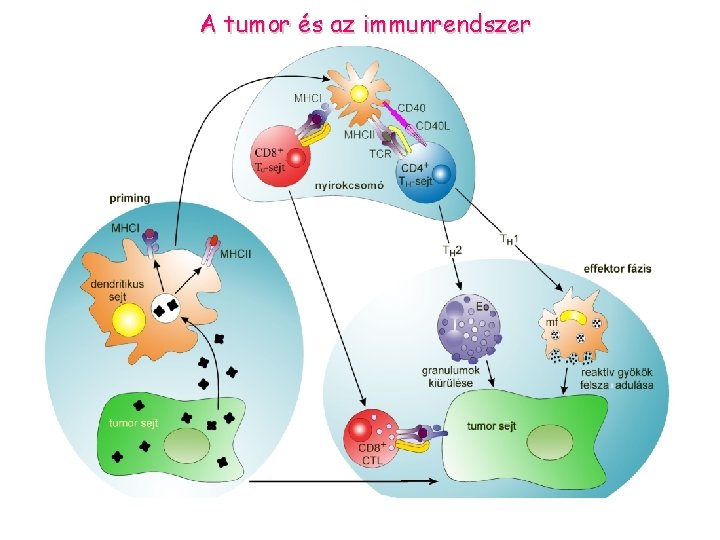
A tumor és az immunrendszer

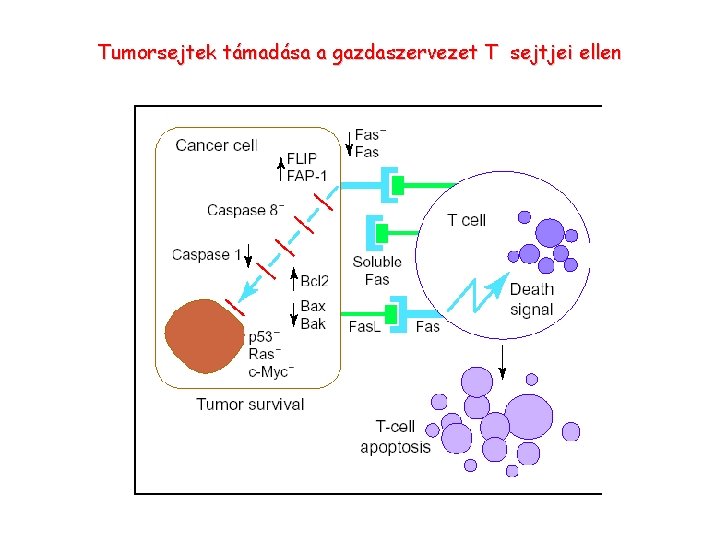
Tumorsejtek támadása a gazdaszervezet T sejtjei ellen

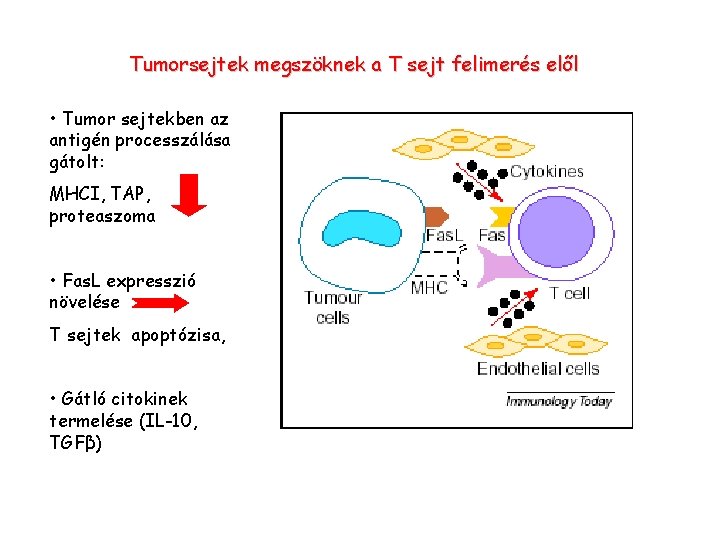
Tumorsejtek megszöknek a T sejt felimerés elől • Tumor sejtekben az antigén processzálása gátolt: MHCI, TAP, proteaszoma • Fas. L expresszió növelése T sejtek apoptózisa, • Gátló citokinek termelése (IL-10, TGFβ)

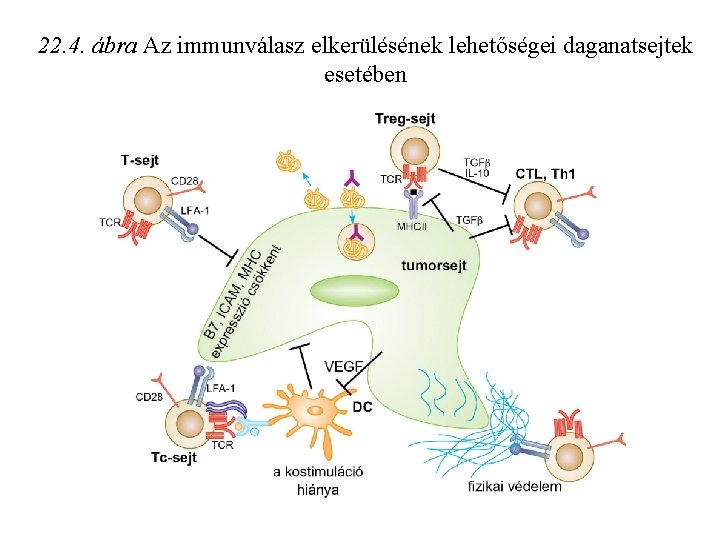
22. 4. ábra Az immunválasz elkerülésének lehetőségei daganatsejtek esetében

Tumor „megszökése” az immunrendszer elől: Ø· alacsony MHCI expresszió, csökkent prezentáció Ø· nincs MHCII expresszió - TH sejteket nem aktivál Ø· kostimulátor molekulák (B 7) hiánya Ø· tumorsejt terméke elnyomja immunválaszt (TGF , IL-10) Ø· a gazdaszervezet toleranciája Ø· mutáns tumor sejtek elszaporodása, amelyek nem expresszálnak peptid- MHCI komplexet Ø· antigén moduláció: tumor antigének elveszitése, vagy elrejtése ellenanyagok által Ø· rezisztens tumor kialakulása Ø· tumor antigének elfedése sziálsav tartalmu mukopoliszaharidok által „antigen masking”

• A tumor antigéneket felismerheti mind a természetes, mind a szerzett immunrendszer. • A gazdaszervezet citokin termelése elnyomhatja a tumor képződést az infekció, gyulladás és az immunválasz szabályozása révén • A tumor sejtek felhasználhatják a gazda citokinjeit a szaporodás elősegítésére, az apoptózistól való megmenekülésre és a szétterjedésre • Citokinek szisztémás alkalmazása anti-tumor hatású, de súlyos toxikus mellékhatásokkal jár, mint pl. infekció, ez behatárolja az alkalmazást. • Tumor sejteket genetikai manipulációval módosítani lehet immunstimuláló citokinek termelésére, ezek tumor vakcinák alapjait képezhetik • CTLA-4 blokkoló receptor gátlása ellenanyaggal ígéretes stratégia a tumor vakcina hatékonyságának növelésére, de rizikó faktor –saját antigénekkel szembeni toleranciát is elnyomhatja.


IMMUNTERÁPIA CÉL: a gazdaszervezet tumorspecifikus immunválaszának fokozása Tumor antigének: Tumor sejtekben a mutációk gyakorisága nagy => fehérje expresszió a normálistól eltér Oncogén virusok által indukált tumor: vírus fehérjék expressziója (CTL aktiválás) Abnormális szerkezetű lipidek, szénhidrátok szintézise (B sejtek aktiválása) Tumor specifikus antigének -normális sejten nincs Tumor asszociált antigének - normális sejten is van -tolerogén


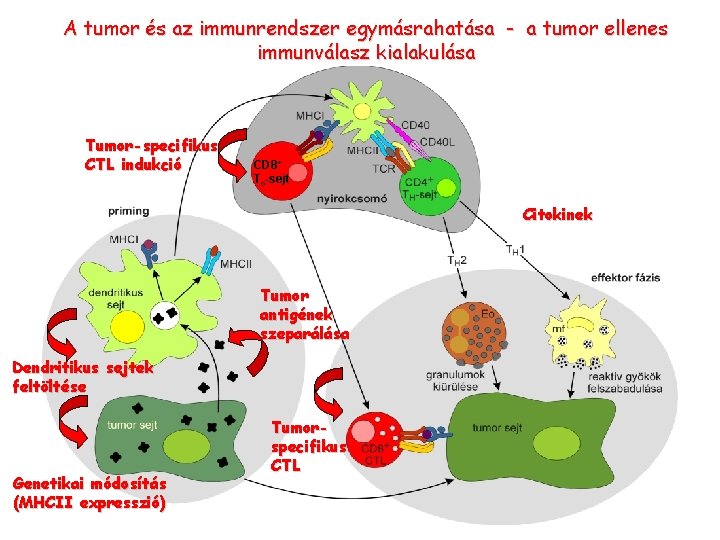
A tumor és az immunrendszer egymásrahatása - a tumor ellenes immunválasz kialakulása Tumor-specifikus CTL indukció CD 8+ Tc-sejt Citokinek Tumor antigének szeparálása Dendritikus sejtek feltöltése Genetikai módosítás (MHCII expresszió) Tumorspecifikus CTL

TUMOR ANTIGÉNEK – immunválaszt váltanak ki Tumor ellen gazdaszervezet immunválasszal reagál: Ølimfocita függő ØSpecifikus Øtumor ellenes ellenanyagok Ømemória van „Immunsurveilance” - tumor elpusztítására Øtumor specifikus antigének (TSA) - csak az adott tumorra jellemző MHC-hez kötődött peptidek Øtumorhoz asszociált antigének (TAA) - embrionális gének termékeimennyiségi növekedés 50 x- 100 x Tumor antigének izolálása: • c. DNS könyvtárból - CTL segítségével, • tumor sejtek felszínéről savas elucióval

Az immunrendszer felismeri a tumort:

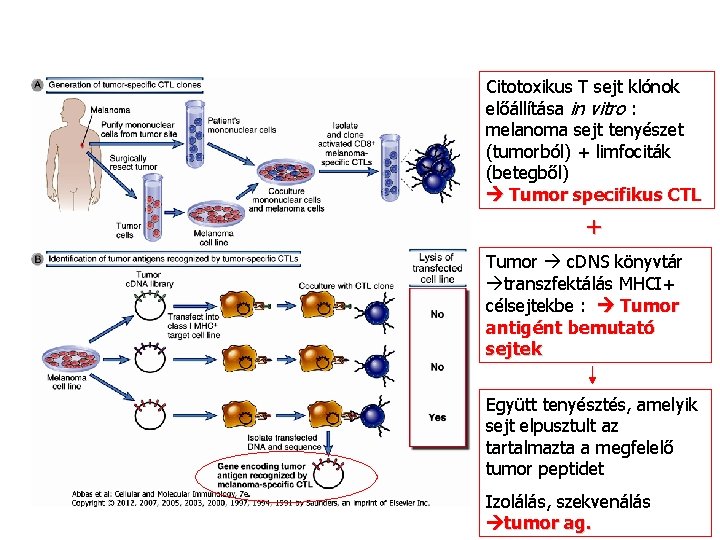
Citotoxikus T sejt klónok előállítása in vitro : melanoma sejt tenyészet (tumorból) + limfociták (betegből) Tumor specifikus CTL + Tumor c. DNS könyvtár transzfektálás MHCI+ célsejtekbe : Tumor antigént bemutató sejtek Együtt tenyésztés, amelyik sejt elpusztult az tartalmazta a megfelelő tumor peptidet Izolálás, szekvenálás tumor ag.

Tumor specifikus T sejtes válasz kiváltása


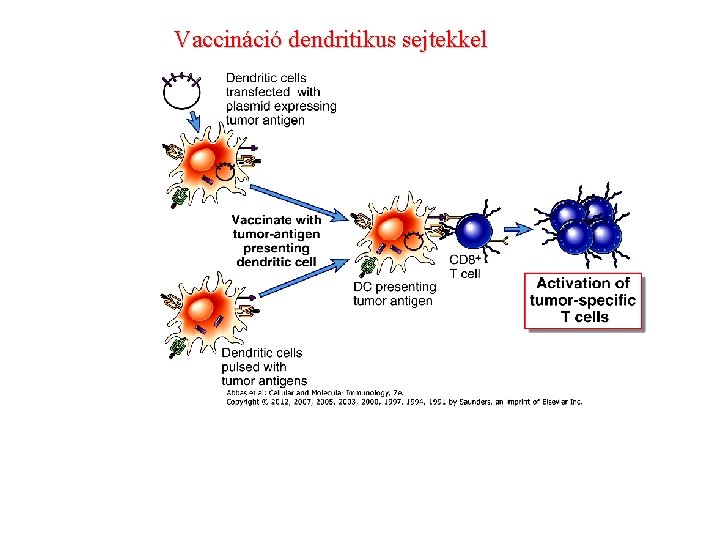
Vaccináció dendritikus sejtekkel

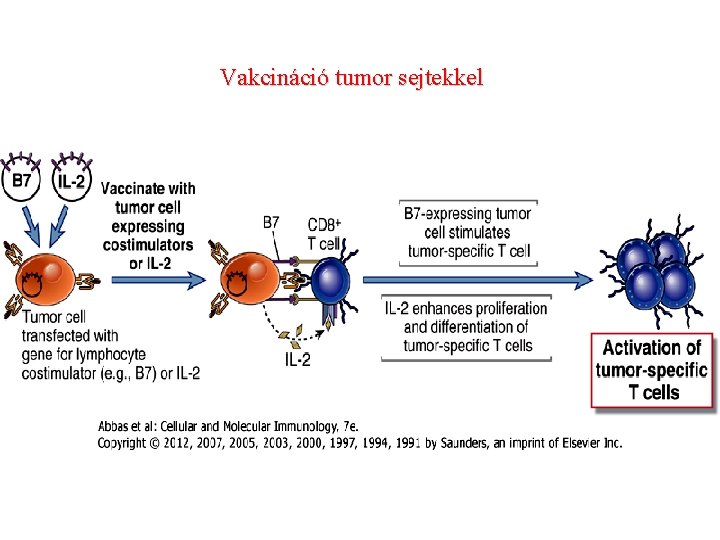
Vakcináció tumor sejtekkel


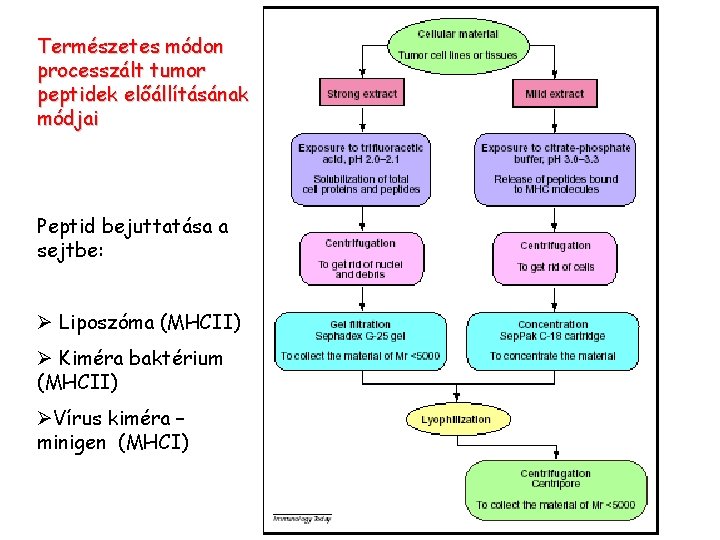
Természetes módon processzált tumor peptidek előállításának módjai Peptid bejuttatása a sejtbe: Ø Liposzóma (MHCII) Ø Kiméra baktérium (MHCII) ØVírus kiméra – minigen (MHCI)

Peptidek terápiás alkalmazása Szintetikus peptidek Természetes peptidek Előny Immunválasz specifitása sokféle ag keveréke Korlátlan mennyiség több betegnél Nagy tisztaság CD 4 CD 8 T akt. Kevés tumor sejten ellenőrizhető CD 4, CD 8 T aktiválás Hátrány Tumorspecifitásra nincs bizonyíték, sok tumor sejt kell Néhány betegnél, alacsony koncentráció Mutáns sejtek megszökhetnek, autoimmunitás kialakulhat Autoimmunitás kialakulhat

22. 6. ábra Immundiagnosztikai lehetőségek daganatos betegségekben

Therapeutic cancer vaccines Pramod K Srivastava The immunological bases of current approaches to therapeutic cancer vaccination (or ‘vacci-treatment’) have been established for a decade or longer. The new developments lie mostly in the lessons learnt from clinical testing of these approaches. Three lessons are particularly worthy of note. First, recently completed randomized Phase 3 trials suggest that vacci-treatment with autologous dendritic cells expressing prostatic acid phosphatase (for prostate cancer) or with autologous tumor-derived heat shock protein (gp 96)–peptide complexes show promise in enhancing survival of cancer patients. These two approaches are undergoing further randomized clinical testing. Second, immunological monitoring of many clinical trials has failed to identify a surrogate marker for clinical outcomes. Finally, an increasing volume of literature suggests that protective immunity to human cancers is elicited by the mutated antigenic repertoire unique to each cancer.

Stratégiák a kísérletes tumor immunterápiára (összefoglaló)

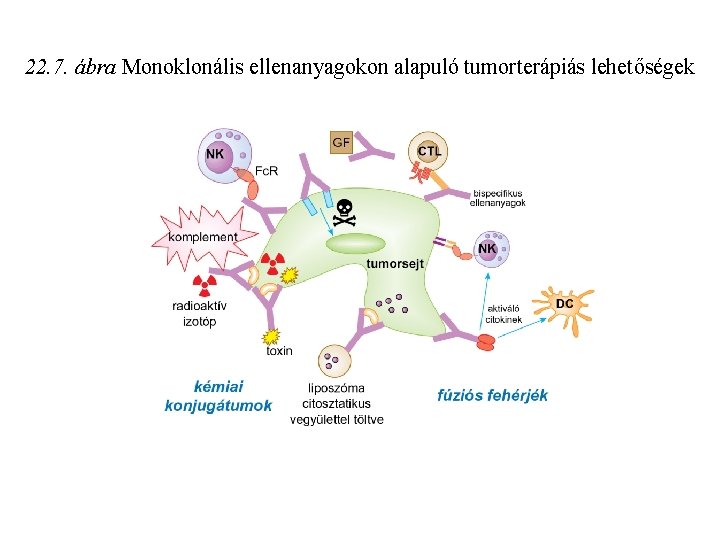
22. 7. ábra Monoklonális ellenanyagokon alapuló tumorterápiás lehetőségek


Ellenanyag terápiák


Passzív immunterápia: Sejtek vagy ellenanyagok közvetítésével v. Sejtes adaptív terápia: LAK sejtek, TIL - ex vivo kezelt sejtek visszaadása v. Ellenanyagok. : tumor specifikus immunotoxin: ricin- célzott-dózis alcsonyabb toxin bejut tumorsejtbe koktél ellenanyagok, (antigén vesztés miatt) B lymphoma: CD 19, CD 20, CD 30 specifikus ellenanyagok anti-idiotípus ellenanyagok - ADCC humanizált elenanyagok, egyláncú ellenanyagok heterokonjugátumok: tumor és CTL specifikus - összekapcsol

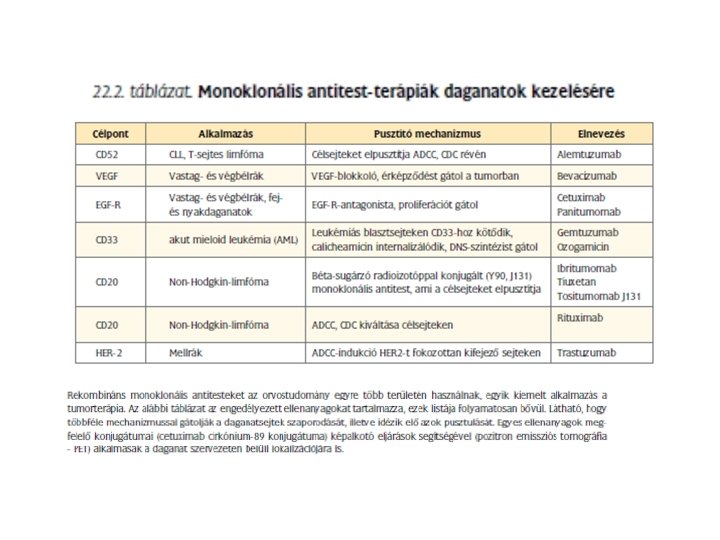
Tumor - ellenanyag terápia Monoklonális ellenanyagok Előnyök: specifitás, (tumor specifikus (? ) ill. tumor-asszociált antigének) homogenitás, affinitás, mellékhatások csökkenése Hátrányok: nagy molekula tömeg - kedvezőtlen biodistribúció, immunogenitás Alkalmazás: ellenanyag (mechanizmus? ) immunkonjugátumok: „mágikus golyó”- ellenanyag +radioaktív izotóp, toxin, drog „pro-drog” bi-specifikus ellenanyagok rekombináns ellenanyagok

Monoklonális ellenanyag -drog konjugátumok Drog: calicheamicin (kétszálú törés DNS-en), doxorubicin - antitumor antibiotikumok Ellenanyag szelektív - szisztémás toxicitást csökkenti CD 33+calicheamicin - AML (akut myeloid leukémia) 20% -nál BR 96 -DOX - colon carcinoma, tüdőrák, mellrák modell - ember? „minimal” betegség esetén használható Radioaktív jelöléssel ellátott ellenanyagok Radioimmunoterápia (RIT) hosszútávú teljes remisszió gyakori: Non-Hodgkin lymphoma, CLL ellenanyagok: anti-idiotípus CD 20, CD 22 HLA- DR 10

„Signaling” ellenanyagok membrán receptorok keresztkötése - szignál intracelluláris jelátadás válasz: apoptózis anti-CD 20 (Rituximab) CD 20: B sejteken, Ca 2+ csatorna, Non-Hodgkin lymphoma: 50% Her 2 (neu) (Herceptin) Her-2 protoonkogén terméke, EGFR család mellrák: 14% anti-CD 52: Campath-1 H CLL, T prolimfocitás leukémia Mab kezelés: nem szünteti meg a tumort - alvó állapot szignaling megváltozik keresztkötés- hipercross-linking Solid tumor: anti-Her-2: receptort gátolja és down-regulálja tirozin kináz jel növekedés gátlás: CDK inhibitor

”Antibody directed enzyme-prodrog” terápia (ADEPT) • ellenanyag (carciniembrionális antigénre specifikus) F(ab’) 2, humanizált, • + enzim (pl. alkalikus foszfatáz, aminopeptidáz) konjugátum • pro-drog: nem toxikus, enzimtől függő átalakulás, tumorban lokalizáltan, • anti-enzim ellenanyag (Ig. G) - enzimet inaktiválja, IC kiürül Előnyök: sok, kis méretű molekula - könnyü penetráció rövid életidő • Metoxipolietilén glikol (MPEG) - directed enzyme/prodrog terápia Biokompatibilis, szintetikus polimer - tumorban felgyülemlik Immunogenitás csökken- ismételten használható Immunszupresszió nem szükséges

Enzim - Pro-drog terápia

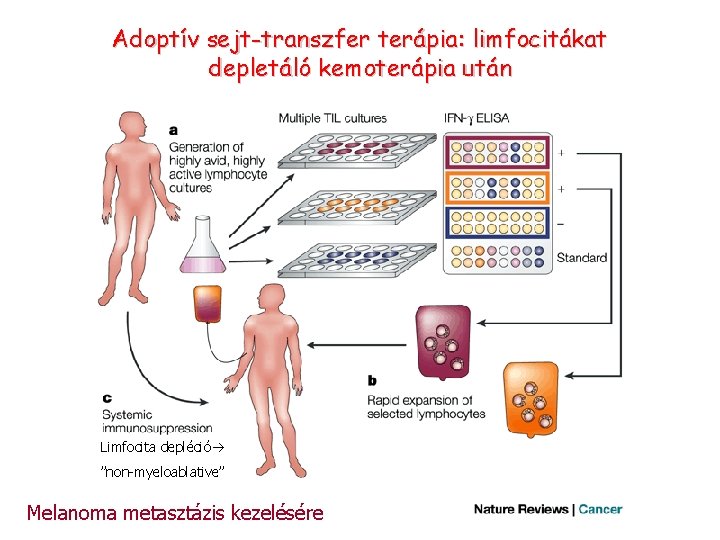
Adoptív sejt-transzfer terápia: limfocitákat depletáló kemoterápia után Limfocita depléció ”non-myeloablative” Melanoma metasztázis kezelésére

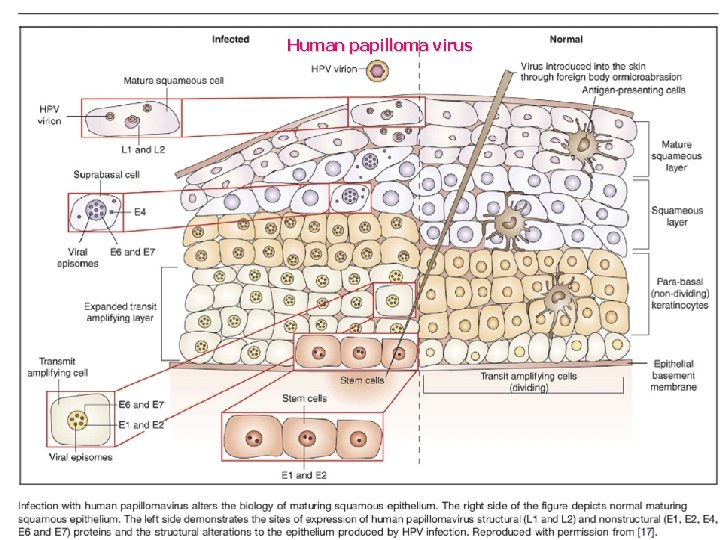
Vaccines to protect against HPV infection and the subsequent risk of cervical cancer have recently become available, based on virus-like particle (VLP) technology. VLPs are produced by expressing the capsid proteins of the virus using recombinant DNA technology. When expressed in eukaryotic cells, the L 1 major capsid protein self-assembles into 360 -mer particles that physically and immunologically resemble the native virion. These highly immunogenic particles can, when administered as a vaccine with alum based adjuvants, protect not only against infection with the HPV types incorporated in the vaccine and some cross-reactive HPV types but also against the consequent premalignant disease Protection is durable over at least five years, and the vaccine appears to protect nearly 100% of immunised subjects. Human Papilloma Virus Az összes tumoros megbetegedés 5 -10%-a HPV fertőzés következménye. A méhnyakrák 100%-ban HPV fertőzés következménye!

Human papilloma virus


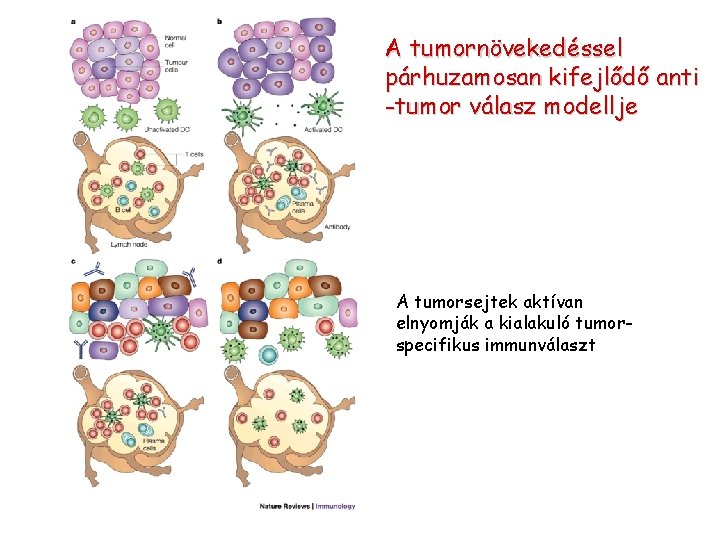
A tumornövekedéssel párhuzamosan kifejlődő anti -tumor válasz modellje A tumorsejtek aktívan elnyomják a kialakuló tumorspecifikus immunválaszt

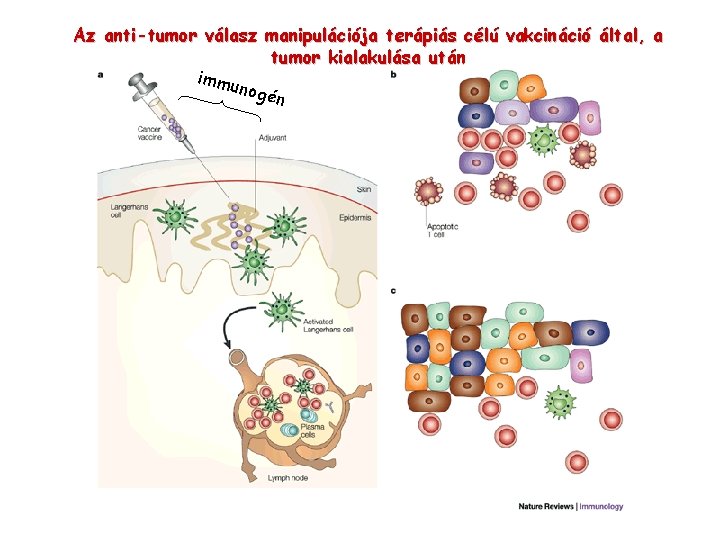
Az anti-tumor válasz manipulációja terápiás célú vakcináció által, a tumor kialakulása után immu nogé n

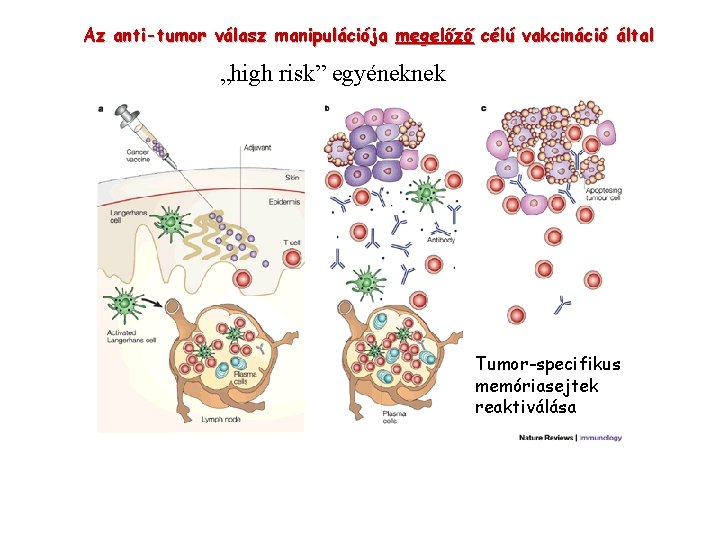
Az anti-tumor válasz manipulációja megelőző célú vakcináció által „high risk” egyéneknek Tumor-specifikus memóriasejtek reaktiválása
 Nature reviews cancer
Nature reviews cancer Immunoterpia
Immunoterpia Fontaine sign
Fontaine sign Tumor de wilms
Tumor de wilms Síndrome de pancoast
Síndrome de pancoast Cairo bishop sınıflaması
Cairo bishop sınıflaması Follicular carcinoma of thyroid
Follicular carcinoma of thyroid Wilms tumor symptoms
Wilms tumor symptoms Primitive neuroectodermal tumor
Primitive neuroectodermal tumor Vaginal tumor
Vaginal tumor Tumor oreja
Tumor oreja Carcinoid tumor stomach
Carcinoid tumor stomach Choroid plexus papilloma
Choroid plexus papilloma Benign tumor definition
Benign tumor definition Kidney pathology
Kidney pathology Meryem gencer
Meryem gencer Submadibular
Submadibular Tumor suppressor genes
Tumor suppressor genes Tumor in the urinary tract
Tumor in the urinary tract Fibrosarcoma gross
Fibrosarcoma gross Caso bruna viana
Caso bruna viana Neutrofiliniai leukocitai
Neutrofiliniai leukocitai Campanacci classification gct
Campanacci classification gct Tumor mixto mulleriano
Tumor mixto mulleriano The 7 habits of highly defective teens
The 7 habits of highly defective teens Carcinoma
Carcinoma Phyllodes tumor mammogram
Phyllodes tumor mammogram Koristoma
Koristoma Syndrome puberty
Syndrome puberty Tumores benignos de esofago
Tumores benignos de esofago Mast cell tumor german shorthaired pointer
Mast cell tumor german shorthaired pointer Marina naboka
Marina naboka Tumor immunology
Tumor immunology Ovarian benign tumor
Ovarian benign tumor Globulomaksiller kist
Globulomaksiller kist Giant cell tumor
Giant cell tumor Atypical cartilaginous tumor
Atypical cartilaginous tumor Kti tumor otak
Kti tumor otak Carcinoma
Carcinoma Cancer indiferenciado de tiroides
Cancer indiferenciado de tiroides Nerve supply of pituitary gland
Nerve supply of pituitary gland Tümör spesifik ağ yüklü dendritik hücre aşısı
Tümör spesifik ağ yüklü dendritik hücre aşısı Gist tumor lebenserwartung
Gist tumor lebenserwartung Hipertrofia adenoidea tratamiento
Hipertrofia adenoidea tratamiento Benign and malignant tumor
Benign and malignant tumor Trias tumor ginjal
Trias tumor ginjal Borrmann classification of gastric cancer
Borrmann classification of gastric cancer Kode icd 10 tumor supraclavicular
Kode icd 10 tumor supraclavicular Giant cell tumor
Giant cell tumor Tumor treating fields mechanism of action
Tumor treating fields mechanism of action Cest la vie význam
Cest la vie význam How big is 5 cm tumor
How big is 5 cm tumor Dr evren süer
Dr evren süer Addison's disease vs cushing's syndrome
Addison's disease vs cushing's syndrome Penanda tumor ca 19-9
Penanda tumor ca 19-9 Tumor angiogenesis
Tumor angiogenesis Tumor
Tumor Giant cell tumor
Giant cell tumor Benign ve malign tümör isimlendirme
Benign ve malign tümör isimlendirme Tumor teratóide rabdóide atípico
Tumor teratóide rabdóide atípico Brain tumor
Brain tumor Dormant tumor
Dormant tumor