tude de phase III UNIFI traitement dinduction par
- Slides: 6

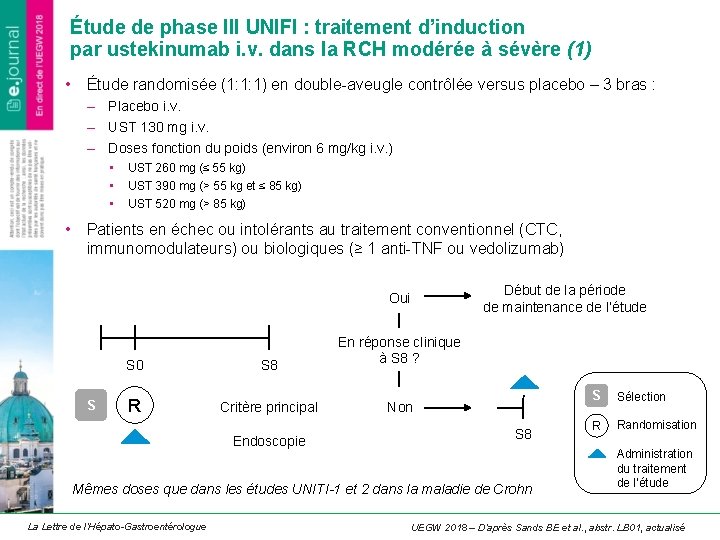
Étude de phase III UNIFI : traitement d’induction par ustekinumab i. v. dans la RCH modérée à sévère (1) • Étude randomisée (1: 1: 1) en double-aveugle contrôlée versus placebo – 3 bras : – Placebo i. v. – UST 130 mg i. v. – Doses fonction du poids (environ 6 mg/kg i. v. ) • • • UST 260 mg (≤ 55 kg) UST 390 mg (> 55 kg et ≤ 85 kg) UST 520 mg (> 85 kg) • Patients en échec ou intolérants au traitement conventionnel (CTC, immunomodulateurs) ou biologiques (≥ 1 anti-TNF ou vedolizumab) Début de la période de maintenance de l’étude Oui S S 0 S 8 En réponse clinique à S 8 ? R Critère principal Non Endoscopie S 8 Mêmes doses que dans les études UNITI-1 et 2 dans la maladie de Crohn La Lettre de l’Hépato-Gastroentérologue S Sélection R Randomisation S Administration du traitement de l’étude UEGW 2018 – D’après Sands BE et al. , abstr. LB 01, actualisé

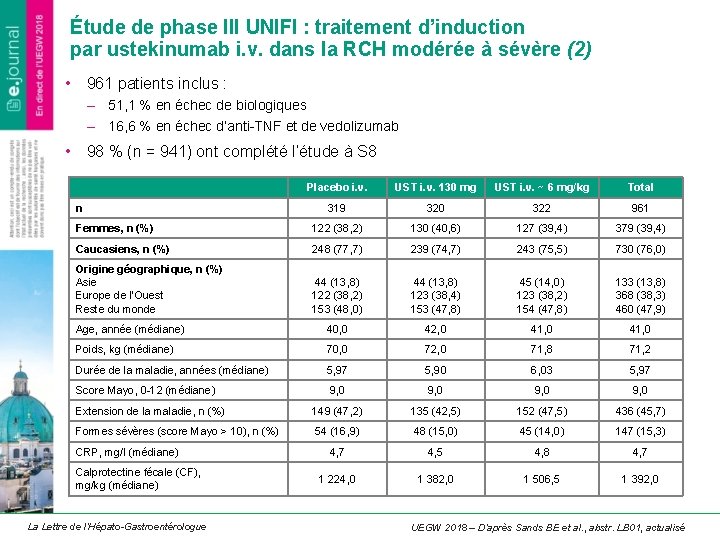
Étude de phase III UNIFI : traitement d’induction par ustekinumab i. v. dans la RCH modérée à sévère (2) • 961 patients inclus : – 51, 1 % en échec de biologiques – 16, 6 % en échec d’anti-TNF et de vedolizumab • 98 % (n = 941) ont complété l’étude à S 8 Placebo i. v. UST i. v. 130 mg UST i. v. ~ 6 mg/kg Total 319 320 322 961 Femmes, n (%) 122 (38, 2) 130 (40, 6) 127 (39, 4) 379 (39, 4) Caucasiens, n (%) 248 (77, 7) 239 (74, 7) 243 (75, 5) 730 (76, 0) Origine géographique, n (%) Asie Europe de l’Ouest Reste du monde 44 (13, 8) 122 (38, 2) 153 (48, 0) 44 (13, 8) 123 (38, 4) 153 (47, 8) 45 (14, 0) 123 (38, 2) 154 (47, 8) 133 (13, 8) 368 (38, 3) 460 (47, 9) Age, année (médiane) 40, 0 42, 0 41, 0 Poids, kg (médiane) 70, 0 72, 0 71, 8 71, 2 Durée de la maladie, années (médiane) 5, 97 5, 90 6, 03 5, 97 Score Mayo, 0 -12 (médiane) 9, 0 Extension de la maladie, n (%) 149 (47, 2) 135 (42, 5) 152 (47, 5) 436 (45, 7) Formes sévères (score Mayo > 10), n (%) 54 (16, 9) 48 (15, 0) 45 (14, 0) 147 (15, 3) 4, 7 4, 5 4, 8 4, 7 1 224, 0 1 382, 0 1 506, 5 1 392, 0 n CRP, mg/l (médiane) Calprotectine fécale (CF), mg/kg (médiane) La Lettre de l’Hépato-Gastroentérologue UEGW 2018 – D’après Sands BE et al. , abstr. LB 01, actualisé

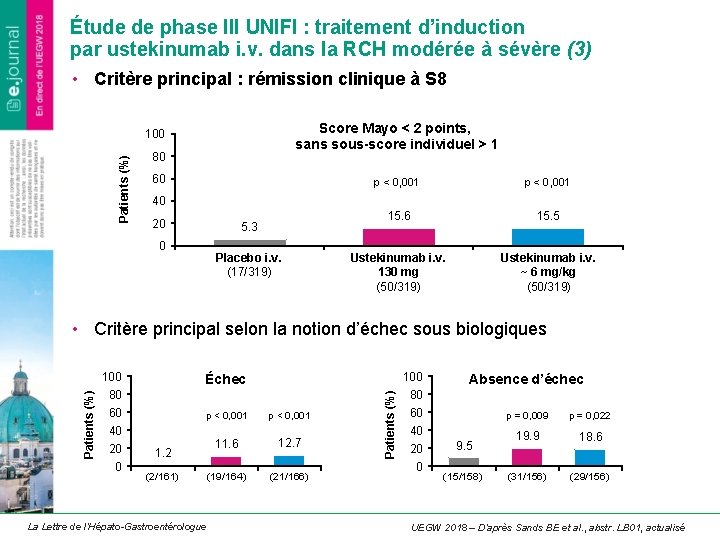
Étude de phase III UNIFI : traitement d’induction par ustekinumab i. v. dans la RCH modérée à sévère (3) • Critère principal : rémission clinique à S 8 Score Mayo < 2 points, sans sous-score individuel > 1 Patients (%) 100 80 60 p < 0, 001 15. 6 15. 5 Ustekinumab i. v. 130 mg (50/319) Ustekinumab i. v. ~ 6 mg/kg (50/319) 40 20 5. 3 0 Placebo i. v. (17/319) • Critère principal selon la notion d’échec sous biologiques 100 Échec 80 60 p < 0, 001 11. 6 12. 7 (19/164) (21/166) 40 20 0 1. 2 (2/161) La Lettre de l’Hépato-Gastroentérologue Patients (%) 100 Absence d’échec 80 60 40 20 0 9. 5 (15/158) p = 0, 009 p = 0, 022 19. 9 18. 6 (31/156) (29/156) UEGW 2018 – D’après Sands BE et al. , abstr. LB 01, actualisé

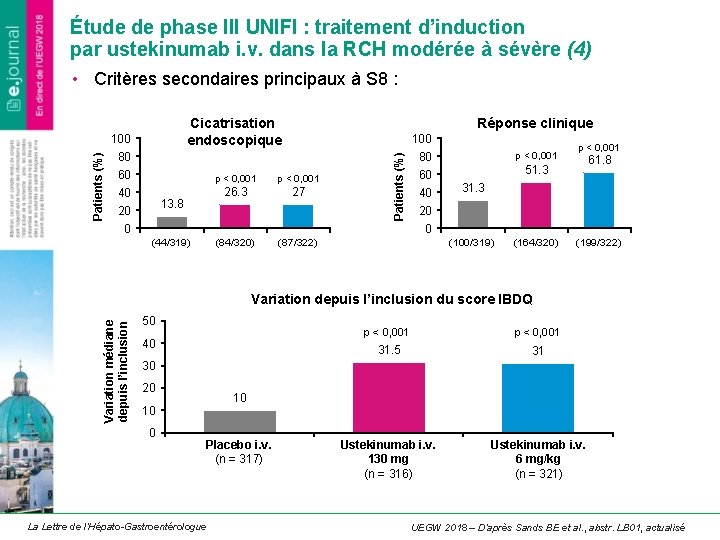
Étude de phase III UNIFI : traitement d’induction par ustekinumab i. v. dans la RCH modérée à sévère (4) • Critères secondaires principaux à S 8 : Cicatrisation endoscopique Réponse clinique 100 80 60 p < 0, 001 40 26. 3 27 13. 8 20 Patients (%) 100 0 p < 0, 001 80 60 40 p < 0, 001 61. 8 51. 3 31. 3 20 0 (44/319) (84/320) (87/322) (100/319) (164/320) (199/322) Variation médiane depuis l’inclusion Variation depuis l’inclusion du score IBDQ 50 40 p < 0, 001 31. 5 31 Ustekinumab i. v. 130 mg (n = 316) Ustekinumab i. v. 6 mg/kg (n = 321) 30 20 10 10 0 Placebo i. v. (n = 317) La Lettre de l’Hépato-Gastroentérologue UEGW 2018 – D’après Sands BE et al. , abstr. LB 01, actualisé

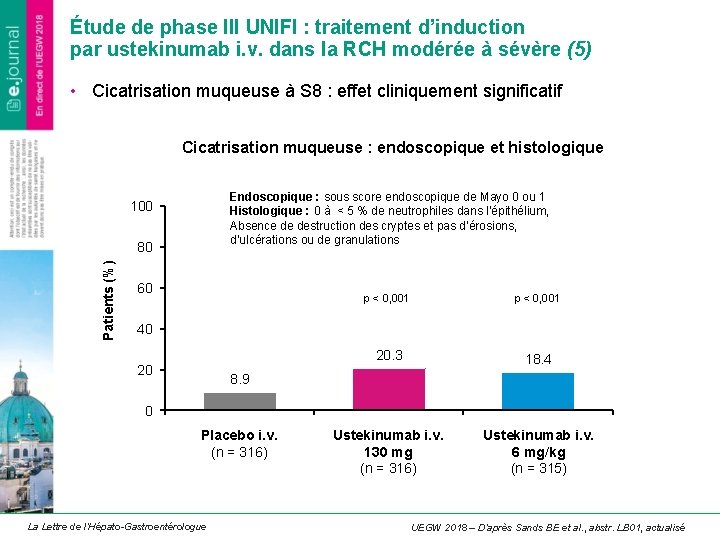
Étude de phase III UNIFI : traitement d’induction par ustekinumab i. v. dans la RCH modérée à sévère (5) • Cicatrisation muqueuse à S 8 : effet cliniquement significatif Cicatrisation muqueuse : endoscopique et histologique Endoscopique : sous score endoscopique de Mayo 0 ou 1 Histologique : 0 à < 5 % de neutrophiles dans l’épithélium, Absence de destruction des cryptes et pas d’érosions, d’ulcérations ou de granulations 100 Patients (%) 80 60 p < 0, 001 20. 3 18. 4 Ustekinumab i. v. 130 mg (n = 316) Ustekinumab i. v. 6 mg/kg (n = 315) 40 20 8. 9 0 Placebo i. v. (n = 316) La Lettre de l’Hépato-Gastroentérologue UEGW 2018 – D’après Sands BE et al. , abstr. LB 01, actualisé

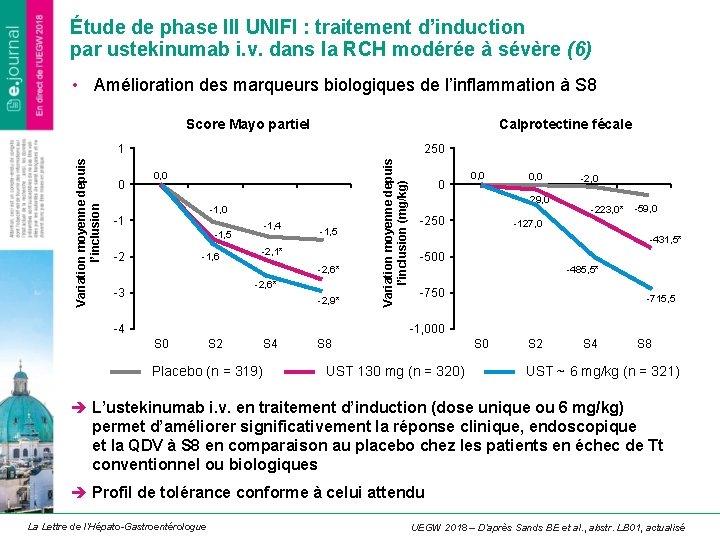
Étude de phase III UNIFI : traitement d’induction par ustekinumab i. v. dans la RCH modérée à sévère (6) • Amélioration des marqueurs biologiques de l’inflammation à S 8 Calprotectine fécale 1 0 0, 0 -1 -1, 4 -1, 5 -2 -1, 6 -1, 5 -2, 1* -2, 6* -3 -2, 9* -4 Variation moyenne depuis l’inclusion (mg/kg) Variation moyenne depuis l’inclusion Score Mayo partiel 250 0 0, 0 -29, 0 -250 -2, 0 -223, 0* -59, 0 -127, 0 -431, 5* -500 -485, 5* -750 -715, 5 -1, 000 S 2 S 4 Placebo (n = 319) S 8 S 0 UST 130 mg (n = 320) S 2 S 4 S 8 UST ~ 6 mg/kg (n = 321) è L’ustekinumab i. v. en traitement d’induction (dose unique ou 6 mg/kg) permet d’améliorer significativement la réponse clinique, endoscopique et la QDV à S 8 en comparaison au placebo chez les patients en échec de Tt conventionnel ou biologiques è Profil de tolérance conforme à celui attendu La Lettre de l’Hépato-Gastroentérologue UEGW 2018 – D’après Sands BE et al. , abstr. LB 01, actualisé