Trong cc hp cht s oxi ha ca

























![26 55, 85 Fe sắt [Ar]3 d 64 s 2 Trở về 26 55, 85 Fe sắt [Ar]3 d 64 s 2 Trở về](https://slidetodoc.com/presentation_image_h2/05a516f64f39c3bfcd783ca4c0b4fea0/image-31.jpg)
- Slides: 31


Trong các hợp chất, số oxi hóa của kim loại kiềm, kim loại kiềm thổ, nhôm lần lượt là: : +1, +2, +3 Số oxi hóa của kim loại M trong các hợp chất sau: MO; M 3 O 4; M 2 O 3 lần lượt là: +2; +8/3; +3

Nguyên tố M là gì nhỉ mà cơ thể chúng ta nếu thiếu nó thì sẽ: - Da dẻ xanh xao, môi khô. - Khả năng tập trung kém. - Mệt mỏi - Tim đập nhanh - Chóng mặt, hoa mắt mỗi khi thay đổi tư thế đột ngột…

Chương 7: SẮT & MỘT SỐ KIM LOẠI QUAN TRỌNG 2 Click Title Bài to 31. add SẮT 2 I. Click. VÀ to CẤU add Title VỊ TRÍ HÌNH E 2 II. Click to add Title TÍNH CHẤT VẬT LÍ I 2 II. Click to add Title TÍNH CHẤT HÓA HỌC I 2 V. Click THÁI to add. TỰ Title TRẠNG NHIÊN

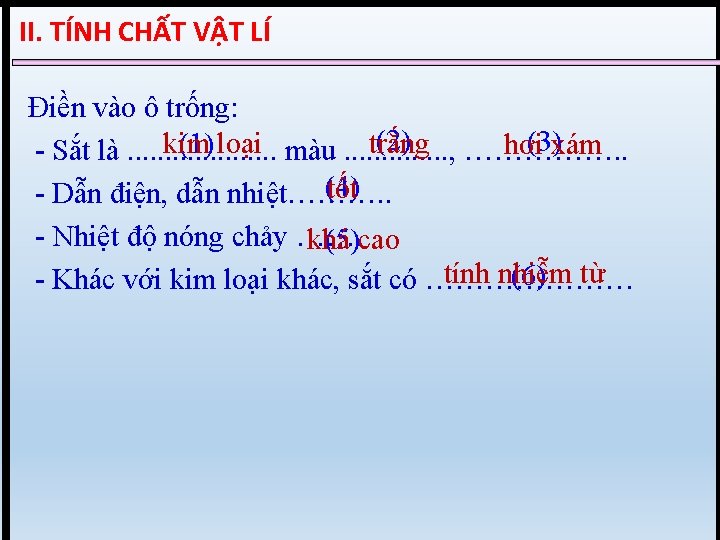
I. VỊ TRÍ TRONG BTH, , CẤU HÌNH ELCTRON NGUYÊN TỬ SẮT( XEM BTH) Fe có STT : 26 , chu kì 4, nhóm. VIIIB 22 s 22 p 63 s 23 p 63 d 64 s 2 Fe: 1 s 26 [Ar]3 d 64 s 2

Fe: 1 s 22 p 63 s 23 p 63 d 64 s 2 Hoặc Fe: [Ar]3 d 64 s 2 - 2 e Fe 2+: [Ar]3 d 6 - 3 e Fe 3+: [Ar]3 d 5 Nhận xét Trong hợp chất, Fe có số oxi hóa +2 hoặc +3


III. TÍNH CHẤT HÓA HỌC Tính chất hóa học của sắt: tính khử trung bình. Fe 2+ + 2 e Fe 3+ + 3 e K+ Na+ Mg 2+ A l 3+ Zn 2+ Fe 2+ Ni 2+ Sn 2+ Pb 2+ H+ Cu 2+ Ag+Au 3+ K Na Mg Al Zn Fe Ni Sn Pb H Cu Ag Au

1. Tác dụng với phi kim + Tác dụng với oxi : TN 0 0 3 Fe + 2 O 2 t 0 +8/3 -2 Fe 3 O 4 +2 +3 (Fe. O, Fe 2 O 3) 0 0 + Tác dụng với clo: TN 2 Fe +3 Cl 2 t 0 +3 -1 2 Fe. Cl 3

2. Tác dụng với axit: + Với axit HCl và H 2 SO 4 loãng: 0 +1 Fe + 2 HCl +2 0 Fe. Cl 2 + H 2 Fe khử H+ thành khí H 2 và Fe bị oxi hoá thành Fe 2+

+ Với axit HNO 3 và H 2 SO 4 đặc: TN 0 +5 Fe +6 HNO 3đặc t 0 +3 +4 Fe (NO 3)3 +3 NO 2 + 3 H 2 O Fe khử N+5 /HNO 3 hoặc S+6/ H 2 SO 4 xuống các số oxi hóa thấp hơn và Fe bị oxi hóa thành Fe 3+. * Đặc, nguội: Fe thụ động

3. Tác dụng với dung dịch muối Tiến hành thí nghiệm: Fe + dung dịch Cu. SO 4 Quan sát, nêu hiện tượng và viết phương trình phản ứng Hiện tượng: Màu xanh dung dịch nhạt dần, Cu màu đỏ bám lên. Pt pứ: Fe + Cu. SO 4 Fe. SO 4 + Cu

3. Tác dụng với dd muối Fe có thể khử được ion của các kim loại đứng sau nó trong dãy điện hóa của kim loại. Fe thường bị oxh +2 Fe + dd Al 2(SO 4)3 ? K+ Na+ Mg 2+ A l 3+ Zn 2+ Fe 2+ Ni 2+ Sn 2+ Pb 2+ H+ Cu 2+ Ag+ Au 3+ K Na Mg Al Zn Fe Ni Sn Pb H Cu Ag Au

Em có kết luận gì về tính chất hóa học của sắt ?

IV. TRẠNG THÁI TỰ NHIÊN Trong tự nhiên sắt chủ yếu tồn tại ở dạng hợp chất. Một số quặng quan trọng: Quặng manhetit Fe 3 O 4

Quặng hematit đỏ Fe 2 O 3

Quặng hematit nâu Fe 2 O 3. n. H 2 O

IV. TRẠNG THÁI TỰ NHIÊN Quặng xiđerit Fe. CO 3

Quặng pirit Fe. S 2

IV. TRẠNG THÁI TỰNHIÊN Giàu sắt nhất Ít sắt nhất Một số quặng sắt Công %Fe quan trọng thức Quặng hematit đỏ Fe 2 O 3 70, 0 % Quặng manhetit Fe 3 O 4 72, 4 % Quặng xiđerit Fe. CO 3 48, 3 % Quặng pirit Fe. S 2 46, 7%



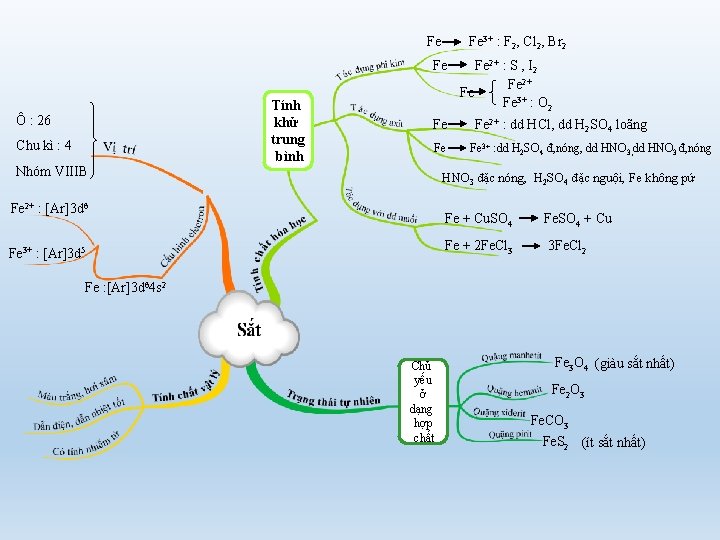
Fe Fe 3+ : F 2, Cl 2, Br 2 Fe Ô : 26 Chu kì : 4 Nhóm VIIIB Tính khử trung bình Fe Fe Fe 2+ : S , I 2 Fe 2+ Fe Fe 3+ : O 2 Fe 2+ : dd HCl, dd H 2 SO 4 loãng Fe 3+ : dd H 2 SO 4 đ, nóng, dd HNO 3 đ, nóng HNO 3 đặc nóng, H 2 SO 4 đặc nguội, Fe không pứ Fe 2+ : [Ar]3 d 6 Fe 3+ : [Ar]3 d 5 Fe + Cu. SO 4 Fe. SO 4 + Cu Fe + 2 Fe. Cl 3 3 Fe. Cl 2 Fe : [Ar]3 d 64 s 2 Chủ yếu ở dạng hợp chất Fe 3 O 4 (giàu sắt nhất) Fe 2 O 3 Fe. CO 3 Fe. S 2 (ít sắt nhất)

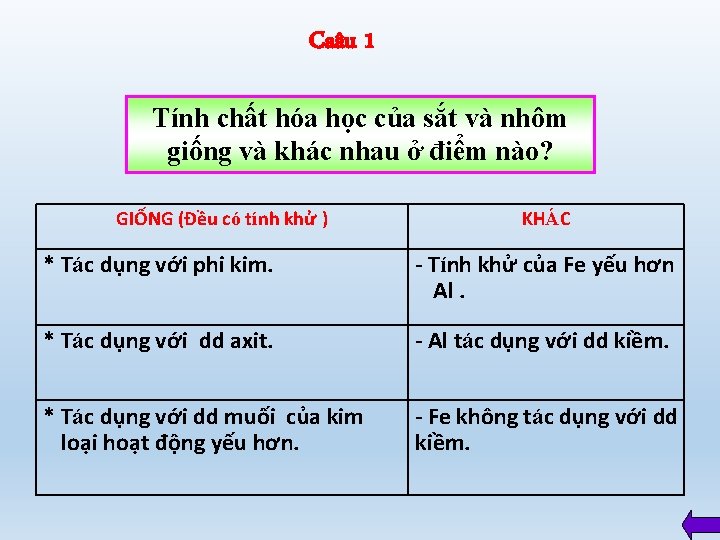
Caâu 1 Tính chất hóa học của sắt và nhôm giống và khác nhau ở điểm nào? GIỐNG (Đều có tính khử ) KHÁC * Tác dụng với phi kim. - Tính khử của Fe yếu hơn Al. * Tác dụng với dd axit. - Al tác dụng với dd kiềm. * Tác dụng với dd muối của kim loại hoạt động yếu hơn. - Fe không tác dụng với dd kiềm.

Caâu 2 Có bột kim loại Fe lẫn bột Al. Hãy nêu phương pháp làm sạch Fe. 1. Dựa vào tính chất vật lí : Fe bị nhiễm từ còn nhôm thì không. Dùng nam châm hút hết bột Fe. 2. Dựa vào tính chất hóa học: Nhôm tan trong dd kiềm (Na. OH) còn Fe thì không, do đó dùng dd Na. OH để loại bỏ bột Al.

Câu 3: Ion Fe 3+ có cấu hình electron lớp ngoài cùng là Câu 4: Khi ngâm một vật bằng Fe vào dung dịch Cu. SO 4 khi quan sát thì thấy có hiện tượng là A. Màu xanh của dung dịch nhạt dần B. Xuất hiện kết tủa màu đỏ bám vào thanh Fe C. Màu xanh dung dịch nhạt dần và chuyển qua màu đỏ D. Màu xanh của dung dịch nhạt dần và xuất hiện lớp màu đỏ bám vào thanh Fe

Câu 5: Kim loại sắt không tác dụng được với chất nào sau A. HNO 3 loãng, HCl B. HNO 3 và H 2 SO 4 đặc nóng C. Cl 2 và O 2 đun nóng D. HNO 3 và H 2 SO 4 đặc nguội Câu 6: Khi cho Fe tác dụng với Clo đun nóng và với dung dịch HCl loãng thì lần lượt thu được sắt có số oxi hóa là A. +3 B. +2 và + 3 C. +3 và + 2 D. +8/3 Câu 7: Quặng nào chứa hàm lương sắt lớn nhất? A. Manhetit B. Xiderit C. Hematit D. Pirit

Câu 8 Ngâm một lá kim loại có khối lượng 50 g trong dung dịch HCl. Sau khi thu được 336 ml H 2 (đkc) thi khối lượng lá kim loại giảm 1, 68%. Kim loại đó là A. Zn B. Fe C. Al D. Ni

Bài 3, 4 trang 141 SGK. Học bài và chuẩn bị trước bài hợp chất của sắt.

![26 55 85 Fe sắt Ar3 d 64 s 2 Trở về 26 55, 85 Fe sắt [Ar]3 d 64 s 2 Trở về](https://slidetodoc.com/presentation_image_h2/05a516f64f39c3bfcd783ca4c0b4fea0/image-31.jpg)
26 55, 85 Fe sắt [Ar]3 d 64 s 2 Trở về