TRNG THPT QUANG TRUNG NNG T HA Tun








- Slides: 12

TRƯỜNG THPT QUANG TRUNG ĐÀ NẴNG TỔ HÓA Tuần 28 – Tiết 55 Bài 39 GVTH: NGUYỄN THỊ MINH TRANG LỚP : 11

NỘI DUNG BÀI HỌC I. III. IV. Khái niệm, phân loại Tính chất vật lí Tính chất hóa học Ứng dụng

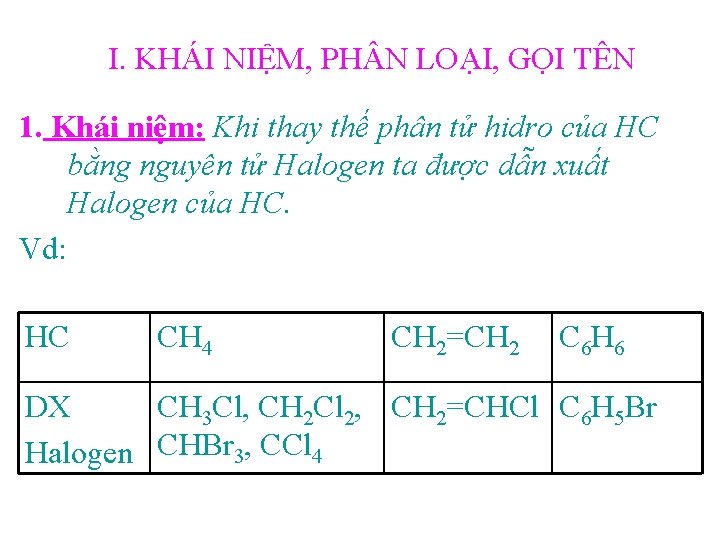
I. KHÁI NIỆM, PH N LOẠI, GỌI TÊN 1. Khái niệm: Khi thay thế phân tử hidro của HC bằng nguyên tử Halogen ta được dẫn xuất Halogen của HC. Vd: HC CH 4 CH 2=CH 2 C 6 H 6 DX CH 3 Cl, CH 2 Cl 2, CH 2=CHCl C 6 H 5 Br Halogen CHBr 3, CCl 4

* Một số phương pháp điều chế dẫn xuất halogen của HC • Thay thế nhóm –OH trong phân tử ancol bằng ngtử halogen Vd: C 2 H 5 OH + HBr → C 2 H 5 Br + H 2 O • Cộng hợp hidro halogenua hoặc halogen vào HC không no Vd: CH 2=CH 2 + HBr → CH 2=CH 2 + Br 2 → CH 3 – CH 2 Br

2. Phân loại: DX Halogen của HC no, mạch hở: CH 3 Br, CH 3 – CH 2 Br, CH 2 Cl – CH 2 Cl, … DX Halogen của HC không no, mạch hở: CH 2=CHCl, … DX Halogen của HC thơm: C 6 H 5 Br, CH 3 – C 6 H 4 Br, … * Lưu ý: Bậc của DX halogen bằng bậc của ngtử C liên kết với ngtử Halogen.

II. TÍNH CHẤT VẬT LÍ * Trạng thái của dẫn xuất halogen phụ thuộc giá trị phân tử khối : - Các dẫn xuất có phân tử khối nhỏ như CH 3 F, CH 3 Cl, CH 3 Br là những chất khí. - Các dẫn xuất halogen có phân tử khối lớn hơn thường ở thế lỏng, nặng hơn nước như CH 3 I, CH 2 Cl 2, CCl 4, C 2 H 4 Cl 2, C 6 H 5 Br. . . - Các dẫn xuất halogen có phân tử khối lớn hơn nữa ở thế rắn như : CHI 3, C 6 H 6 Cl 6. . .

* Tính tan : Các dẫn xuất halogen hầu như không tan H 2 O, tan tốt trong các dung môi không phân cực như hidrocacbon, ete. . . * Tác dụng sinh học : CHCl 3 có tác dụng gây mê, C 6 H 6 Cl 6 có tác dụng diệt sâu bọ. . .

III. TÍNH CHẤT HÓA HỌC 1. Phản ứng thế nguyên tử halogen bằng nhóm – OH Vd: o t CH 3 – CH 2 – Br + Na. OH(loãng) → CH 3 – CH 2 – OH + Na. Br Tổng quát: o t R – X + Na. OH → R – OH + Na. X

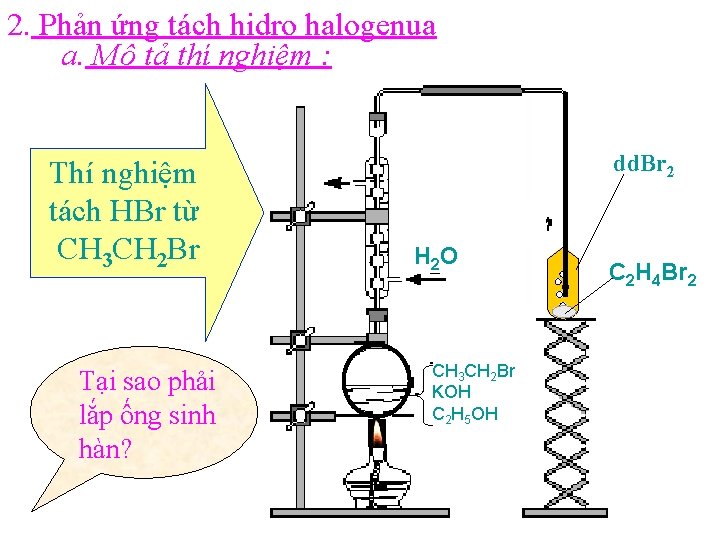
2. Phản ứng tách hidro halogenua a. Mô tả thí nghiệm : Thí nghiệm tách HBr từ CH 3 CH 2 Br Tại sao phải lắp ống sinh hàn? dd. Br 2 H 2 O CH 3 CH 2 Br KOH C 2 H 5 OH C 2 H 4 Br 2

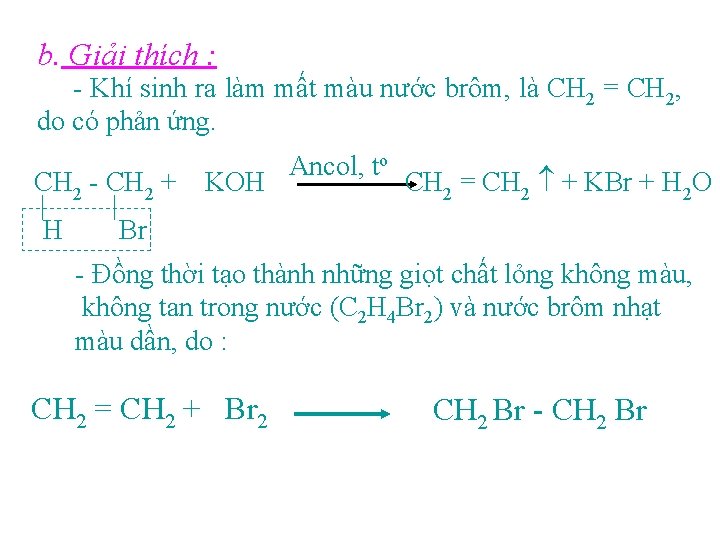
b. Giải thích : - Khí sinh ra làm mất màu nước brôm, là CH 2 = CH 2, do có phản ứng. CH 2 - CH 2 + H KOH Ancol, to CH 2 = CH 2 + KBr + H 2 O Br - Đồng thời tạo thành những giọt chất lỏng không màu, không tan trong nước (C 2 H 4 Br 2) và nước brôm nhạt màu dần, do : CH 2 = CH 2 + Br 2 CH 2 Br - CH 2 Br

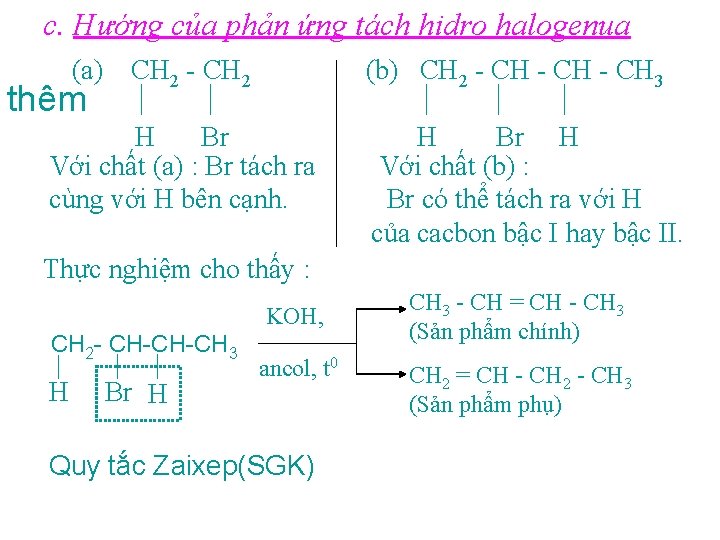
c. Hướng của phản ứng tách hidro halogenua (a) thêm CH 2 - CH 2 (b) CH 2 - CH 3 H Br Với chất (a) : Br tách ra cùng với H bên cạnh. H Br H Với chất (b) : Br có thể tách ra với H của cacbon bậc I hay bậc II. Thực nghiệm cho thấy : KOH, CH 2 - CH-CH-CH 3 H Br H ancol, t 0 Quy tắc Zaixep(SGK) CH 3 - CH = CH - CH 3 (Sản phẩm chính) CH 2 = CH - CH 2 - CH 3 (Sản phẩm phụ)

IV. ỨNG DỤNG: (sgk/176) V. CỦNG CỐ: 1. Chất nào là dẫn xuất halogen của hidrocacbon? a. Cl-CH 2 -COOH b. C 6 H 5 -CH 2 -Cl c. CH 3 -CH 2 -Mg-Br d. CH 3 -CO-Cl 2. Nhận xét nào sau đây không đúng? a. Ankylbromua dễ tham gia phản ứng thế hơn phenylbromua b. Vinylclorua có thể được điều chế từ 1, 2 -đicloetan c. Etylclorua thuộc loại dxuất halogen bậc II d. Ứng với công thức phân tử: C 3 H 5 Br có 4 đồng phân cấu tạo.