TRNG THPT PHAN NG LU T HO HC











- Slides: 22

TRƯỜNG THPT PHAN ĐĂNG LƯU TỔ: HOÁ HỌC LỚP 12 E TR N TRỌNG MỜI QUÝ THẦY CÔ VỀ DỰ GIỜ GV THỰC HIỆN: PHAN THỊ DUNG Tháng 3/2018

KẾT NỐI KIẾN THỨC CŨ 1. Trả lời câu hỏi 2. Quan sát hình ảnh 1

1 2 A 2 B Phản ứng nào sau đây không xảy ra khi cho Fe vào dd Cu. SO 4 17 23 09 18 28 26 22 20 15 04 05 06 07 02 29 27 25 21 19 14 10 11 12 03 16 08 01 24 13 HẾT GIỜ Sai Fe vào dd HCl, H 2 SO 4 (loãng) Sai 2 C Cho hơi nước đi qua Fe (nung nóng) Sai 2 D Fe vào dd HNO 3, H 2 SO 4 đặc nguội Đúng

2 2 A Khi cho sắt tác dụng với Clo đun nóng và dd H 2 SO 4 loãng thì lần lượt thu được sắt có số oxi hóa? Giải thích? +3 2 B +2 và +3 2 C +3 và +2 2 D +8/3 17 23 09 18 28 26 22 20 15 04 05 06 07 02 29 27 25 21 19 14 10 11 12 03 16 08 01 24 13 HẾT GIỜ Sai Giải thích Sai 0 +3 2 Fe + 3 Cl 2 → 2 Fe. Cl 3 0 +2 Fe + H 2 SO 4 (l) → Fe. SO 4 + H 2 Đúng Sai

Sắt chiếm 5% khối lượng vỏ Trái Đất, đứng hàng thứ 2 trong các kim loại (sau nhôm). Trong tự nhiên, sắt tồn tại chủ yếu ở dạng hợp chất có trong các quặng. - Quặng manhetit (Fe 3 O 4) - Quặng hematit đỏ (Fe 2 O 3) - Quặng hematit nâu (Fe 2 O 3. n. H 2 O) - Quặng xiđerit (Fe. CO 3) - Quặng pirit (Fe. S 2) Sắt có trong hemoglobin (huyết cầu tố) của máu

Quặng Manhetit: Fe 3 O 4

Quặng Hematit đỏ: Fe 2 O 3

Quặng Hematit nâu: Fe 2 O 3. n. H 2 O

Quặng Xidetit: Fe. CO 3

Quặng Pirit: Fe. S 2

7 Chương SẮT VÀ MỘT SỐ KIM LOẠI QUAN TRỌNG (Tiết 53) Bài 32 HỢP CHẤT CỦA SẮT

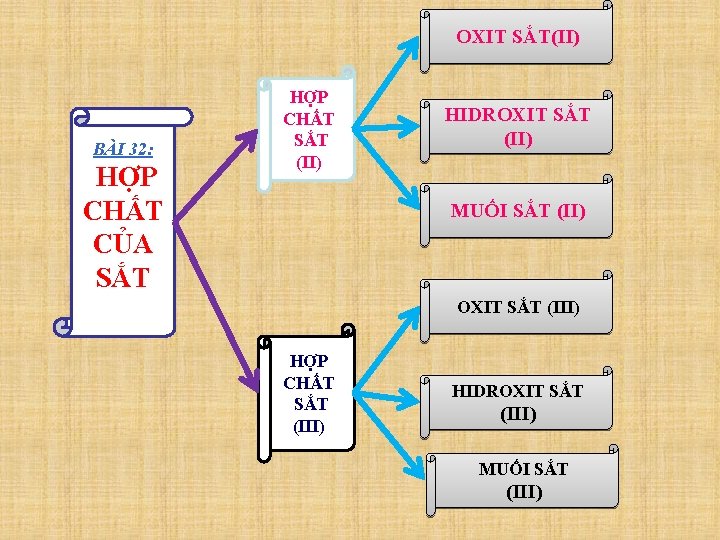
OXIT SẮT(II) BÀI 32: HỢP CHẤT CỦA SẮT HỢP CHẤT SẮT (II) HIDROXIT SẮT (II) MUỐI SẮT (II) OXIT SẮT (III) HỢP CHẤT SẮT (III) HIDROXIT SẮT (III) MUỐI SẮT (III)

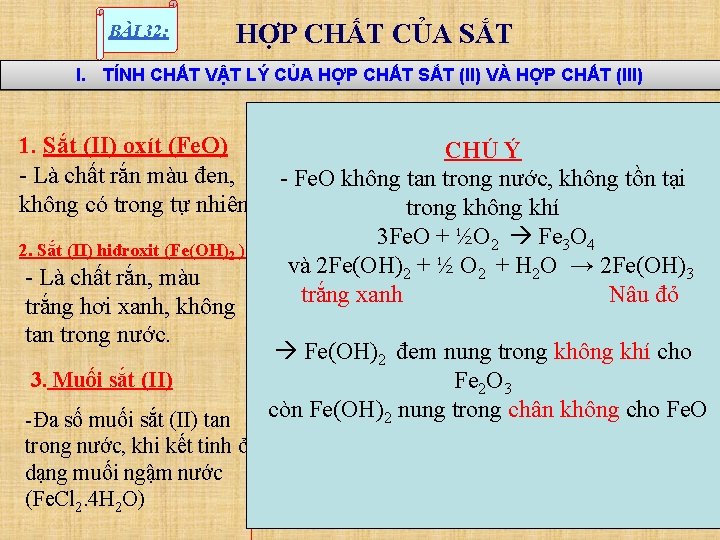
BÀI 32: HỢP CHẤT CỦA SẮT I. TÍNH CHẤT VẬT LÝ CỦA HỢP CHẤT SẮT (II) VÀ HỢP CHẤT (III) 1. Sắt (II) oxít (Fe. O) - Là chất rắn màu đen, không có trong tự nhiên 2. Sắt (II) hiđroxit (Fe(OH)2 ) - Là chất rắn, màu trắng hơi xanh, không tan trong nước. 3. Muối sắt (II) -Đa số muối sắt (II) tan trong nước, khi kết tinh ở dạng muối ngậm nước (Fe. Cl 2. 4 H 2 O) CHÚ Ý - Fe. O không tan trong nước, không tồn tại trong không khí 3 Fe. O + ½O 2 Fe 3 O 4 và 2 Fe(OH)2 + ½ O 2 + H 2 O → 2 Fe(OH)3 Fe. SO trắng xanh Nâu đỏ 2 O 4. 7 H Fe. O Fe(OH) 2 Hi 2 đem nung Fe(OH) trong khôngi khí cho Oxit đr ố ox u Fe O 2 3 it M còn Fe(OH)2 nung trong chân không cho Fe. O Fe (II)

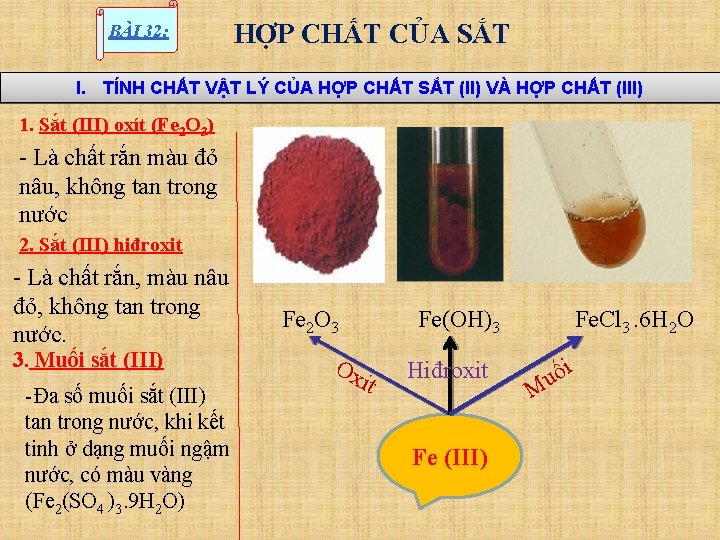
BÀI 32: HỢP CHẤT CỦA SẮT I. TÍNH CHẤT VẬT LÝ CỦA HỢP CHẤT SẮT (II) VÀ HỢP CHẤT (III) 1. Sắt (III) oxít (Fe 2 O 3) - Là chất rắn màu đỏ nâu, không tan trong nước 2. Sắt (III) hiđroxit - Là chất rắn, màu nâu đỏ, không tan trong nước. 3. Muối sắt (III) -Đa số muối sắt (III) tan trong nước, khi kết tinh ở dạng muối ngậm nước, có màu vàng (Fe 2(SO 4 )3. 9 H 2 O) Fe 2 O 3 Ox Fe(OH)3 it Hiđroxit Fe (III) Fe. Cl 3. 6 H 2 O i ố u M

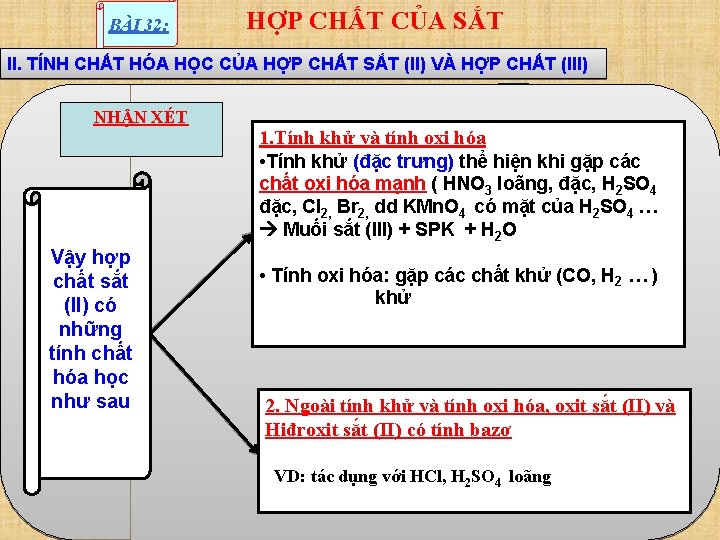
BÀI 32: HỢP CHẤT CỦA SẮT II. TÍNH CHẤT HÓA HỌC CỦA HỢP CHẤT SẮT (II) VÀ HỢP CHẤT (III) NHẬN XÉT 1. Tính khử và tính oxi hóa • Tính khử (đặc trưng) thể hiện khi gặp các chất oxi hóa mạnh ( HNO 3 loãng, đặc, H 2 SO 4 đặc, Cl 2, Br 2, dd KMn. O 4 có mặt của H 2 SO 4 … Muối sắt (III) + SPK + H 2 O Vậy hợp chất sắt (II) có những tính chất hóa học như sau • Tính oxi hóa: gặp các chất khử (CO, H 2 … ) khửhọc đặc trưng của hợp chất Tính chất hóa Fe (II) là tính khử →hóa, oxit sắt (II) và 2. Ngoài tính khử+ và 2 e tính oxi Hiđroxit sắt (II) có tính bazơ Ngoài ra hợp chất Fe (II) còn thể hiện tính VD: tác dụng với HCl, H 2 SO 4 loãng oxi hóa

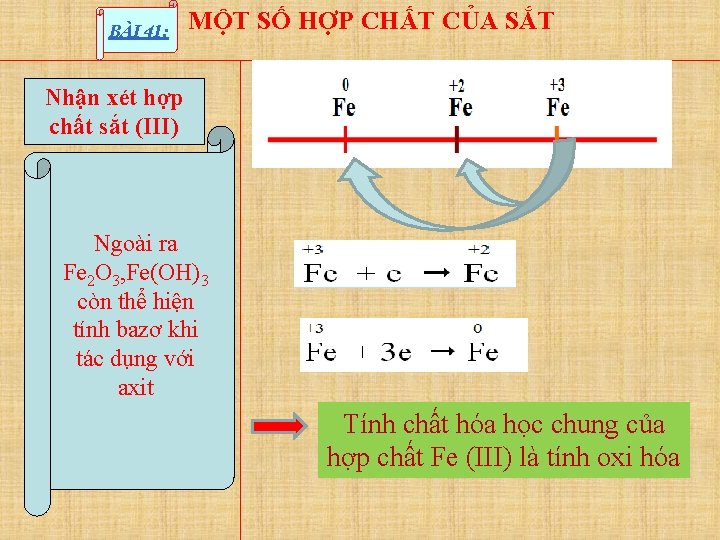
BÀI 41: MỘT SỐ HỢP CHẤT CỦA SẮT Nhận xét hợp chất sắt (III) Ngoài ra Fe 2 O 3, Fe(OH)3 còn thể hiện tính bazơ khi tác dụng với axit Tính chất hóa học chung của hợp chất Fe (III) là tính oxi hóa

II. TÍNH CHẤT HÓA HỌC CỦA HỢP CHẤT SẮT (II) VÀ HỢP CHẤT (III) THẢO LUẬN NHÓM Nhóm 1 và nhóm 3 : Viết phương trình phản ứng(Xác định số oxi hóa của các nguyên tố Fe trước và sao phản ứng Nhận xét? a) Fe. O vào dd HNO 3 loãng, H 2 SO 4 đặc b) Fe(OH)2 vào dd HNO 3 đặc , H 2 SO 4 đặc c) Fe(OH)2 + O 2 + H 2 O d) Fe. Cl 2 + Cl 2 e) Fe. SO 4 + KMn. O 4 + H 2 SO 4. Nhóm 2: Viết phương trình phản ứng (Xác định số oxi hóa của các nguyên tố Fe trước và sao phản ứng Nhận xét? a) Fe. O, Fe(OH)2 vào dd HCl, H 2 SO 4 loãng b) Fe 2 O 3 vào dd HCl loãng , H 2 SO 4 loãng c) Fe(OH)3 vào dd HNO 3 đặc , H 2 SO 4 đặc Nhóm 4: Viết phương trình phản ứng (Xác định số oxi hóa của các nguyên tố Fe trước và sao phản ứng Nhận xét? a) Fe. O + CO (t 0 C) b) Fe 2 O 3 tác dụng với CO, Al (t 0 C) c) Fe, Cu vào dd Fe. Cl 3.

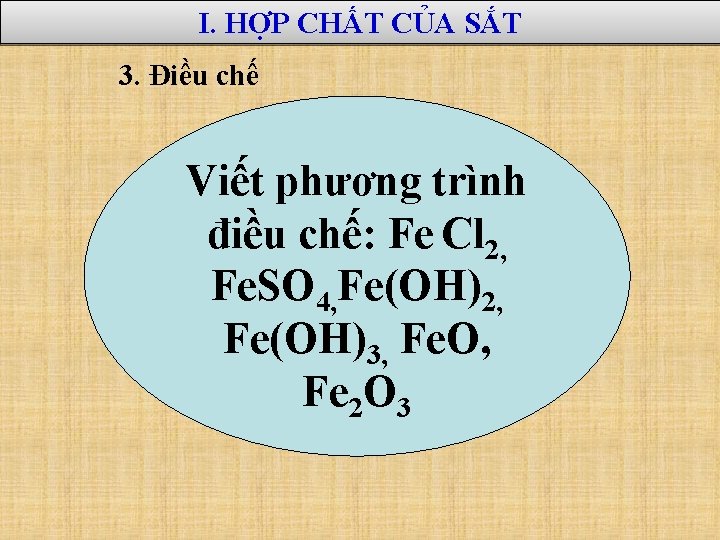
I. HỢP CHẤT CỦA SẮT 3. Điều chế Viết phương trình điều chế: Fe Cl 2, Fe. SO 4, Fe(OH)2, Fe(OH)3, Fe. O, Fe 2 O 3

I. HỢP CHẤT SẮT (II) 3. Điều chế Hợp chất sắt (II) Phản ứng điều chế 5000 C 2 Fe. O + CO 2 Sắt (II) oxit Fe 2 O 3 + CO Sắt (II) hiđroxit Fe 2+ + 2 OH- Muối sắt (II) Fe + 2 HCl Fe. Cl 2 + H 2 Fe. O + H 2 SO 4 loãng Fe. SO 4 + H 2 O Fe(OH)2

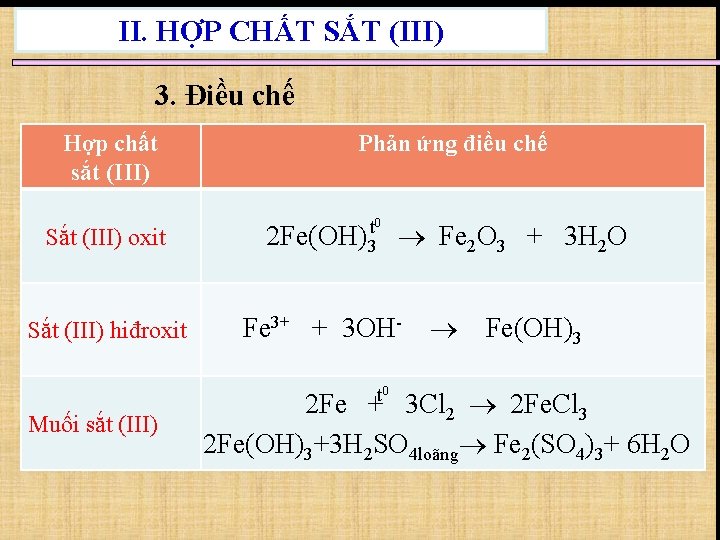
II. HỢP CHẤT SẮT (III) 3. Điều chế Hợp chất sắt (III) Sắt (III) oxit Sắt (III) hiđroxit Phản ứng điều chế t 0 2 Fe(OH)3 Fe 2 O 3 + 3 H 2 O Fe 3+ + 3 OHt 0 Muối sắt (III) Fe(OH)3 2 Fe + 3 Cl 2 2 Fe. Cl 3 2 Fe(OH)3+3 H 2 SO 4 loãng Fe 2(SO 4)3+ 6 H 2 O

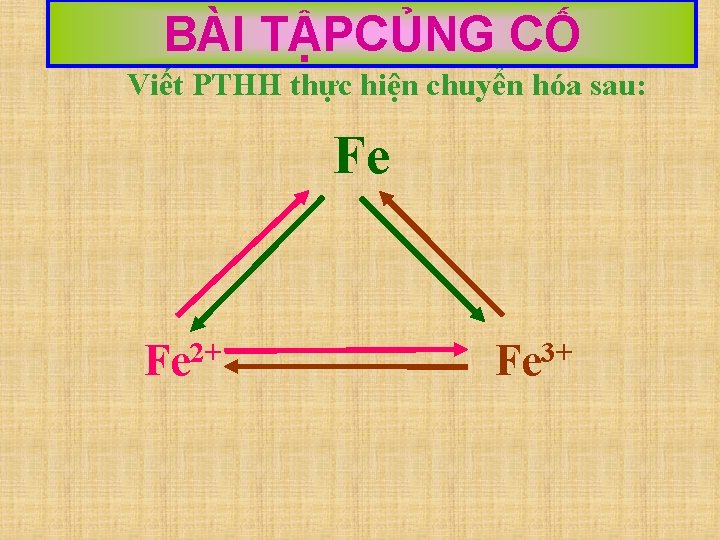
BÀI TẬPCỦNG CỐ Viết PTHH thực hiện chuyển hóa sau: Fe Fe 2+ Fe 3+

Hết Bài