TRNG THPT L THNH TN T HA HC












- Slides: 33

TRƯỜNG THPT LÊ THÁNH TÔN TỔ HÓA HỌC GV. Lê Thị Tuyền


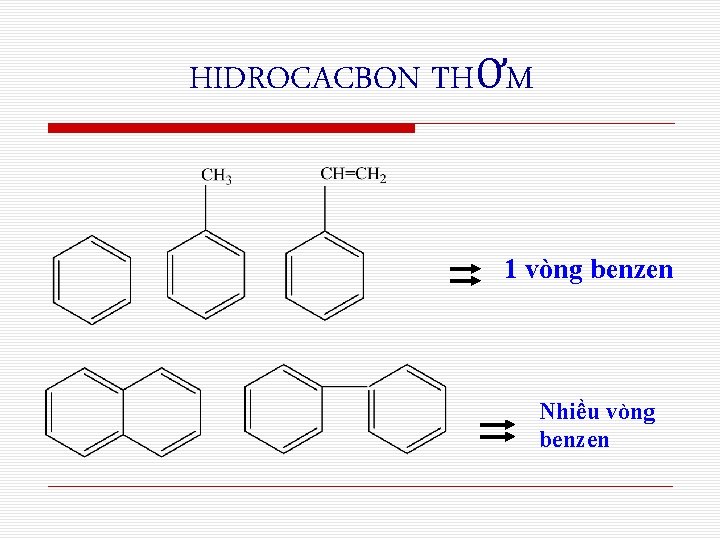
HIDROCACBON THƠM 1 vòng benzen Nhiều vòng benzen

Phân loại Hiđrocacbon thơm có 1 vòng benzen trong phân tử như: Benzen, toluen, stiren. . . . Hiđrocacbon thơm có nhiều vòng benzen trong phân tử như: Naphtalen. . .

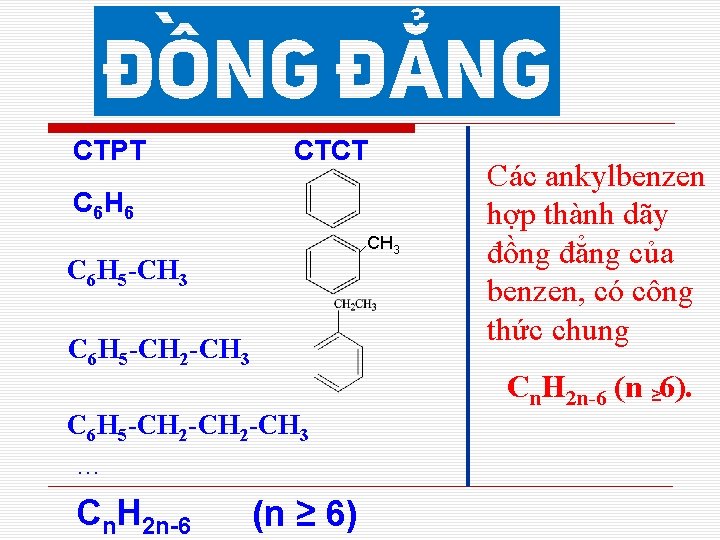
CTPT CTCT C 6 H 6 CH 3 C 6 H 5 -CH 2 -CH 3 … Cn. H 2 n-6 (n ≥ 6) Các ankylbenzen hợp thành dãy đồng đẳng của benzen, có công thức chung Cn. H 2 n-6 (n ≥ 6).

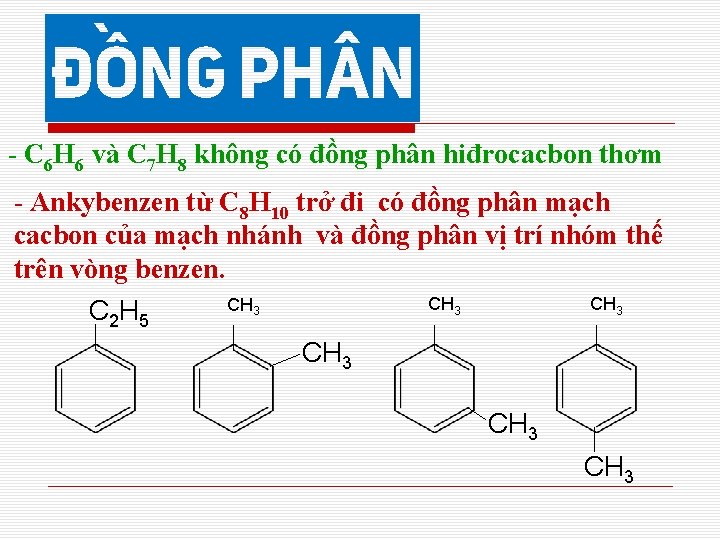
- C 6 H 6 và C 7 H 8 không có đồng phân hiđrocacbon thơm - Ankybenzen từ C 8 H 10 trở đi có đồng phân mạch cacbon của mạch nhánh và đồng phân vị trí nhóm thế trên vòng benzen. C 2 H 5 CH 3 CH 3

- Lấy mạch chính là vòng benzen. Viết các đồng phân có thể có của ankylbenzen C 8 H 10? CH 3 CH 2 -CH 3 Ghi nhớ: Từ C 8 trở đi có đồng phân + Vị trí tương đối của các nhóm ankyl xung quanh vòng thơm + Cấu tạo mạch cacbon của mạch nhánh

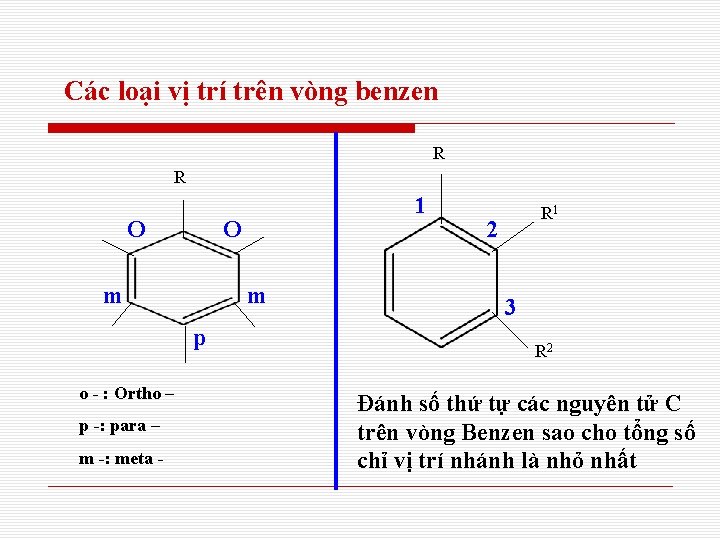
Các loại vị trí trên vòng benzen R R O O m m p o - : Ortho – p -: para – m -: meta - 1 R 1 2 3 R 2 Đánh số thứ tự các nguyên tử C trên vòng Benzen sao cho tổng số chỉ vị trí nhánh là nhỏ nhất

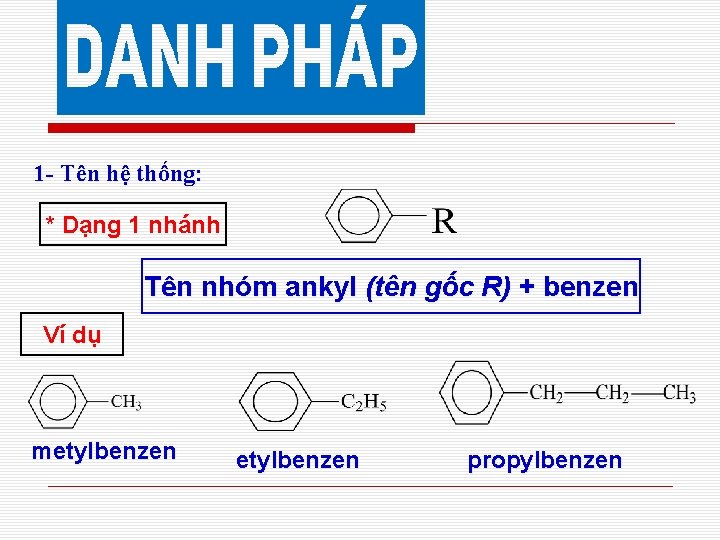
1 - Tên hệ thống: * Dạng 1 nhánh Tên nhóm ankyl (tên gốc R) + benzen Ví dụ metylbenzen propylbenzen

* Dạng nhiều nhánh Số chỉ vị trí nhánh + tên nhóm ankyl + benzen Chú ý: - Đánh số các nguyên tử cacbon của vòng benzen sao cho tổng chỉ số trong tên gọi là nhỏ nhất. Gọi tên nhánh theo thứ tự chữ cái Ví dụ : Đúng 1, 2, 4 -trimetylbenzen Sai

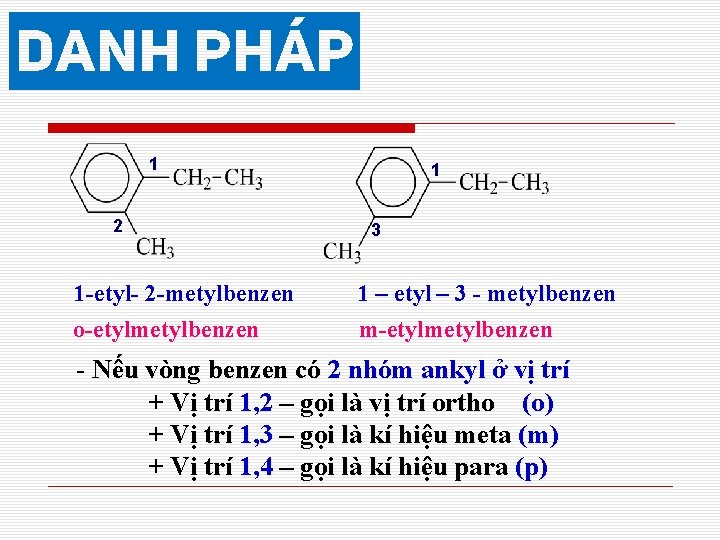
1 2 1 -etyl- 2 -metylbenzen o-etylmetylbenzen 1 3 1 – etyl – 3 - metylbenzen m-etylmetylbenzen - Nếu vòng benzen có 2 nhóm ankyl ở vị trí + Vị trí 1, 2 – gọi là vị trí ortho (o) + Vị trí 1, 3 – gọi là kí hiệu meta (m) + Vị trí 1, 4 – gọi là kí hiệu para (p)

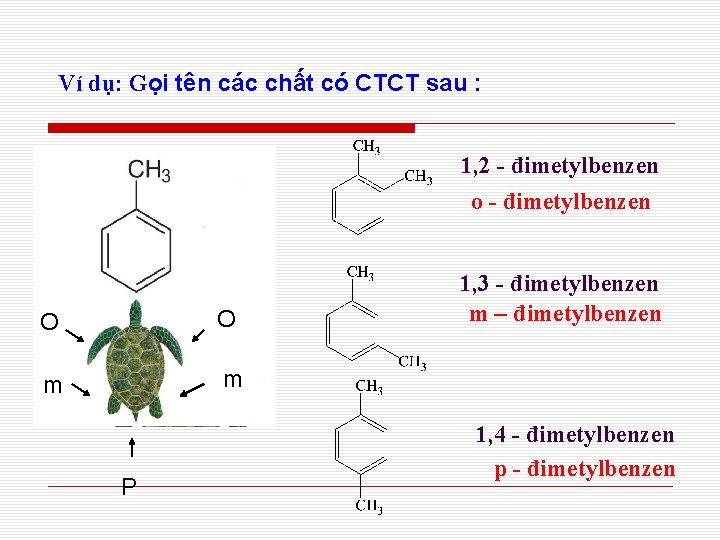
Ví dụ: Gọi tên các chất có CTCT sau : 1, 2 - đimetylbenzen o - đimetylbenzen O O m m P 1, 3 - đimetylbenzen m – đimetylbenzen 1, 4 - đimetylbenzen p - đimetylbenzen

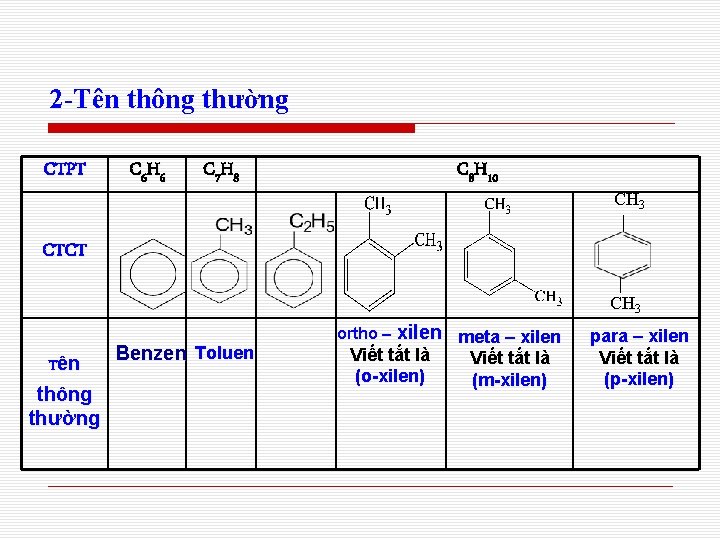
2 -Tên thông thường CTPT C 6 H 6 C 7 H 8 C 8 H 10 CH 3 CTCT CH 3 Tên thông thường Benzen Toluen ortho – xilen meta – xilen Viết tắt là (o-xilen) Viết tắt là (m-xilen) para – xilen Viết tắt là (p-xilen)

- Caùc hiñrocacbon thôm ñeàu laø chaát loûng hoaëc raén. Benzen là chất lỏng, không màu, có mùi đặc trưng. Không tan trong nước, nhẹ hơn nước, có khả năng hòa tan nhiều hợp chất hữu cơ. - Nhiệt độ sôi của các hidrocacbon thơm tăng theo chiều tăng của phân tử khối. -

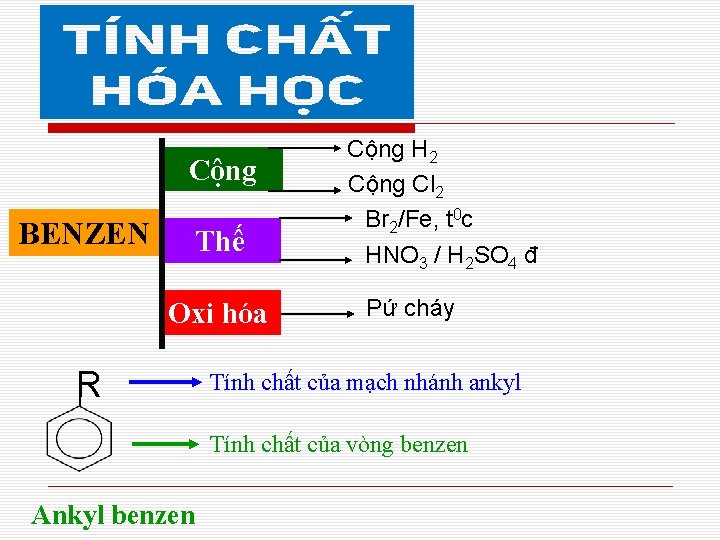
Cộng BENZEN Thế Oxi hóa R Cộng H 2 Cộng Cl 2 Br 2/Fe, t 0 c HNO 3 / H 2 SO 4 đ Pứ cháy Tính chất của mạch nhánh ankyl Tính chất của vòng benzen Ankyl benzen

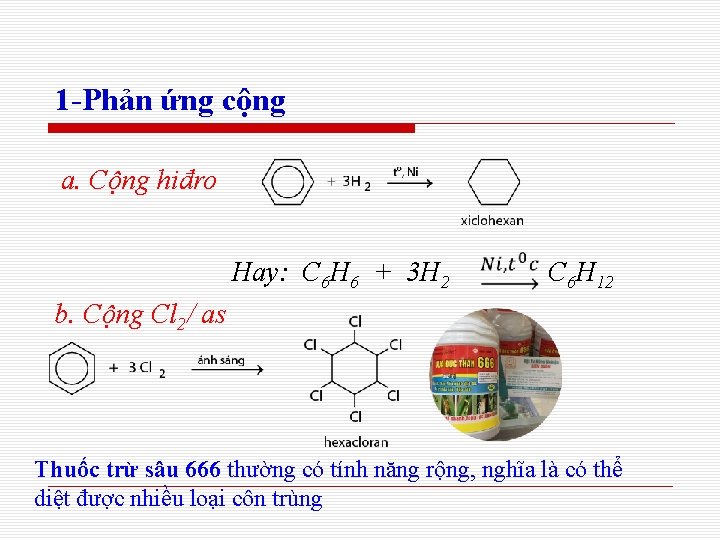
1 -Phản ứng cộng a. Cộng hiđro Hay: C 6 H 6 + 3 H 2 C 6 H 12 b. Cộng Cl 2/ as Thuốc trừ sâu 666 thường có tính năng rộng, nghĩa là có thể diệt được nhiều loại côn trùng

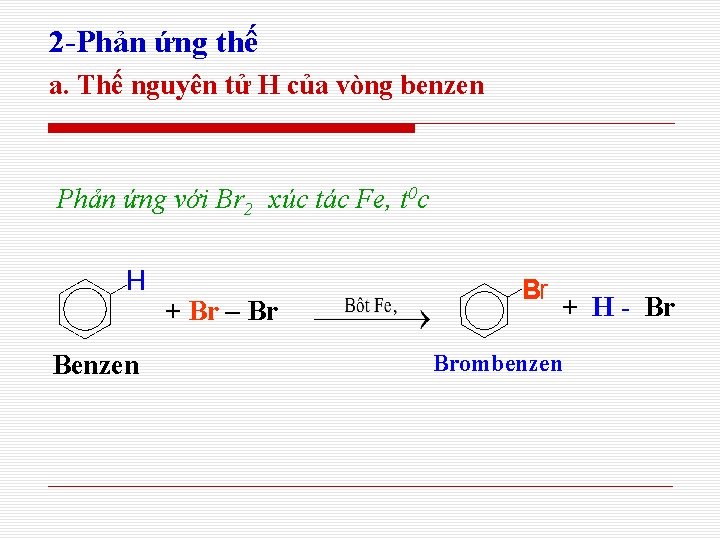
2 -Phản ứng thế a. Thế nguyên tử H của vòng benzen Phản ứng với Br 2 xúc tác Fe, t 0 c + Br – Br Benzen Br + H - Br Brombenzen

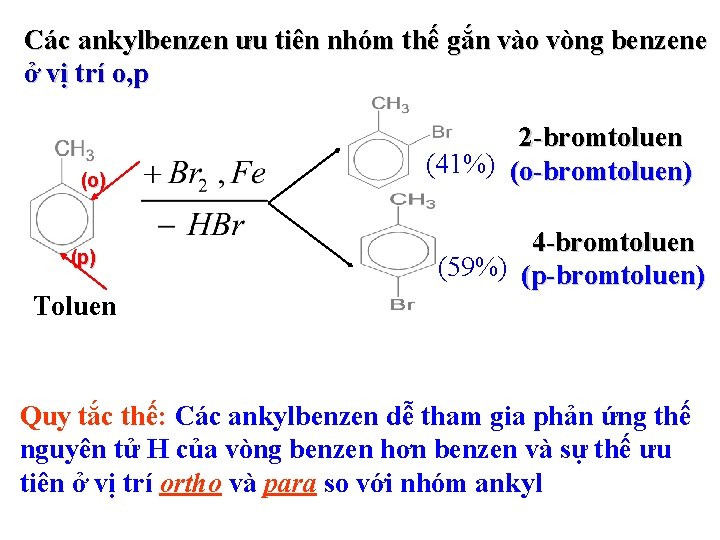
Các ankylbenzen ưu tiên nhóm thế gắn vào vòng benzene ở vị trí o, p (o) (p) Toluen 2 -bromtoluen (41%) (o-bromtoluen) 4 -bromtoluen (59%) (p-bromtoluen) Quy tắc thế: Các ankylbenzen dễ tham gia phản ứng thế nguyên tử H của vòng benzen hơn benzen và sự thế ưu tiên ở vị trí ortho và para so với nhóm ankyl

2 -Phản ứng thế Phản ứng với Br 2 xúc tác Fe, t 0 c Phản ứng với axit nitric ( Phản ứng nitro hóa). +HO-NO 2đ H 2 SO 4 đ NO 2 + H 2 O Nitrobenzen CH 3 Benzen CH 3 +HO-NO 2đ H 2 SO 4 đ - H 2 O CH 3 Tolulen NO 2 (42 %) 2 -nitrotoluen (o-nitrotoluen) (58%) 4 -nitrotoluen (p-nitrotoluen)

2 -Phản ứng thế a. Thế nguyên tử H của vòng benzen b. Thế nguyên tử H ở mạch nhánh. CH 3 CH 2 Br + Br 2 t 0 + HBr Benzyl bromua R 0 + Br 2 Fe, t t 0 Thế vào nhân thơm Ưu tiên thế ở vị trí o- và p( hay vị trí 2, 4, 6) Thế vào nhánh

Lưu ý: Các ankylbezen dễ tham gia phản ứng thế nguyên tử H của vòng bezen hơn benzen *Quy luật thế trong nhân benzen: - Khi ở vòng benzen đã có sẵn nhóm ankyl (hay các nhóm −OH, −NH 2, −OCH 3, . . . ), phản ứng thế vào vòng sẽ dễ dàng hơn và ưu tiên xảy ra ở vị trí ortho và para. - Ngược lại, nếu ở vòng benzen đã có sẵn nhóm −NO 2 (hoặc các nhóm −COOH, −SO 3 H, . . . ) phản ứng thế vào vòng sẽ khó hơn và ưu tiên xảy ra ở vị trí meta.

3 -Phản ứng oxi hóa a. Phản ứng oxi hóa hoàn toàn: Cn. H 2 n-6 + (3 n-3)/2 O 2 to n. CO 2 + (n-3)H 2 O b. Phản ứng oxi hóa không hoàn toàn - Benzen không phản ứng với dung dịch thuốc tím ngay cả khi đun nóng. C 6 H 6 + KMn. O 4 - Toluen làm mất màu dd thuốc tím tạo kết tủa Mn. O 2: +2 KMn. O 4 to Kakibenzoat +2 Mn. O 2 +KOH+ H 2 O Nâu đen

Lưu ý: * Benzen không tác dụng với dung dịch KMn. O 4 ngay cả khi đun nóng. * Ankylbenzen làm mất màu dung dịch KMn. O 4 khi đun nóng. * Đây là phản ứng phân biệt benzen và ankylbenzen.

* TÓM TẮT KIẾN THỨC TCHH Pư thế Phản ứng đặc trưng Thế ng. tử H của vòng Pư cộng Thế ng. tử H mạch nhánh (ankylbenzen) Pư oxh Oxh hoàn toàn Oxh ko hoàn toàn (ankylbenzen)

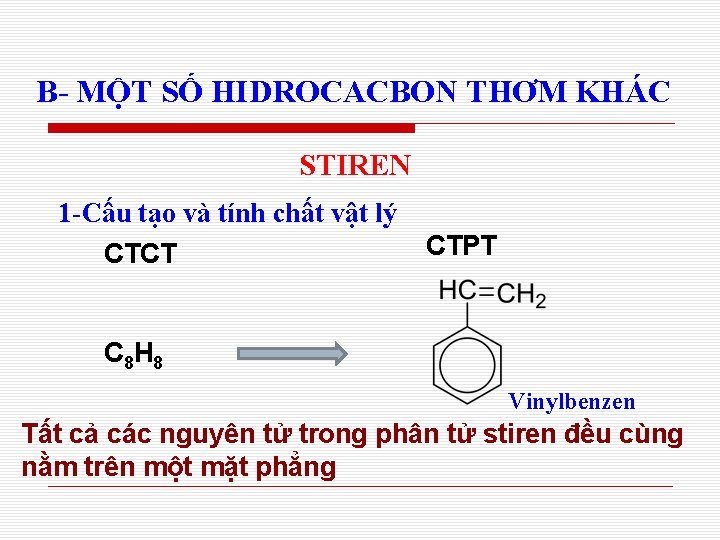
B- MỘT SỐ HIDROCACBON THƠM KHÁC STIREN 1 -Cấu tạo và tính chất vật lý CTCT CTPT C 8 H 8 Vinylbenzen Tất cả các nguyên tử trong phân tử stiren đều cùng nằm trên một mặt phẳng

1. CẤU TẠO VÀ TÍNH CHẤT VẬT LÝ v. Tính chất vật lý • Chất lỏng, không màu • Sôi ở 1460 C • Nhẹ hơn nước, không tan trong nước • Tan nhiều trong dung môi hữu cơ

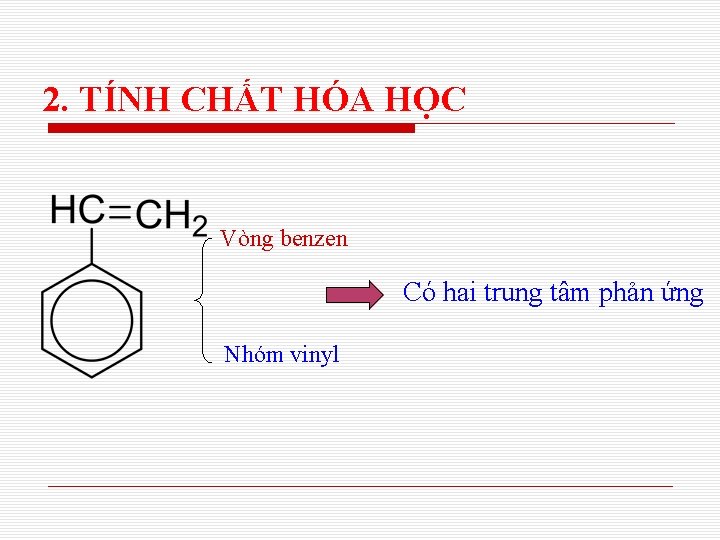
2. TÍNH CHẤT HÓA HỌC Vòng benzen Có hai trung tâm phản ứng Nhóm vinyl

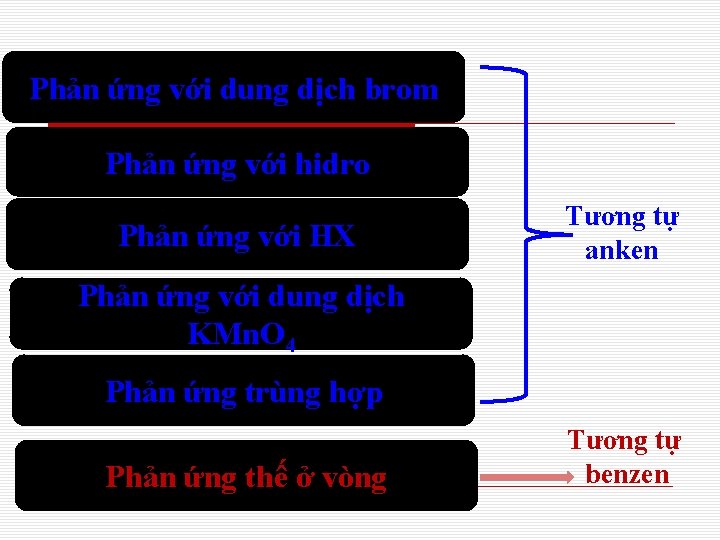
Phản ứng với dung dịch brom Phản ứng với hidro Phản ứng với HX Tương tự anken Phản ứng với dung dịch KMn. O 4 Phản ứng trùng hợp Phản ứng thế ở vòng Tương tự benzen

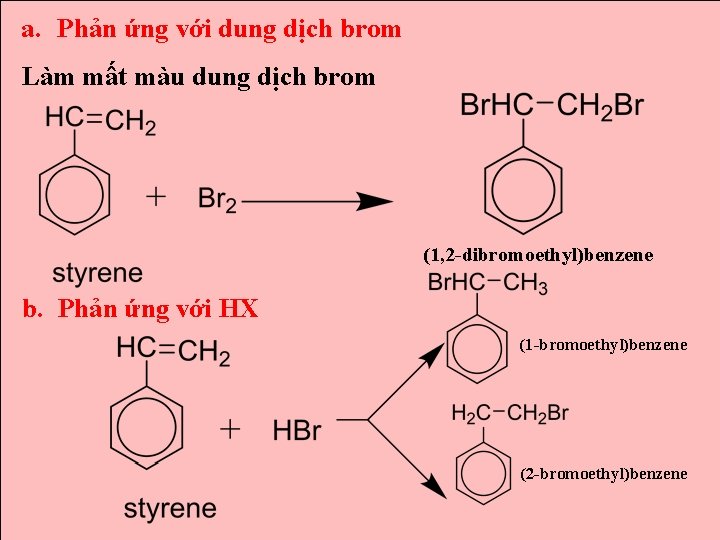
a. Phản ứng với dung dịch brom Làm mất màu dung dịch brom (1, 2 -dibromoethyl)benzene b. Phản ứng với HX (1 -bromoethyl)benzene (2 -bromoethyl)benzene

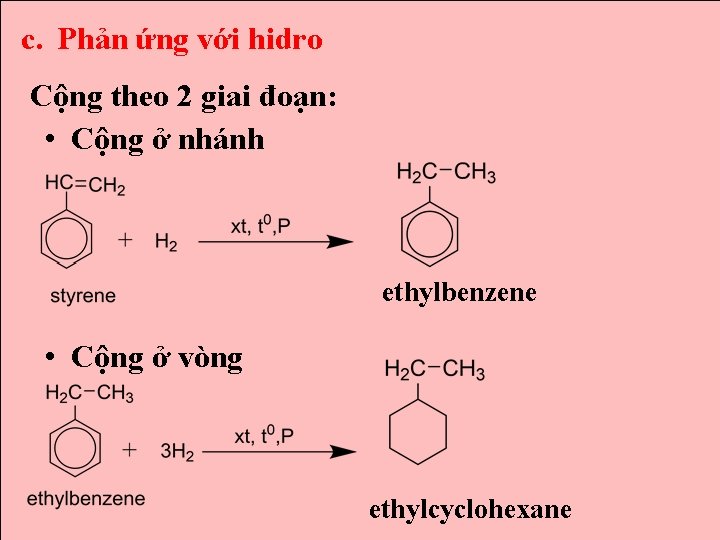
c. Phản ứng với hidro Cộng theo 2 giai đoạn: • Cộng ở nhánh ethylbenzene • Cộng ở vòng ethylcyclohexane

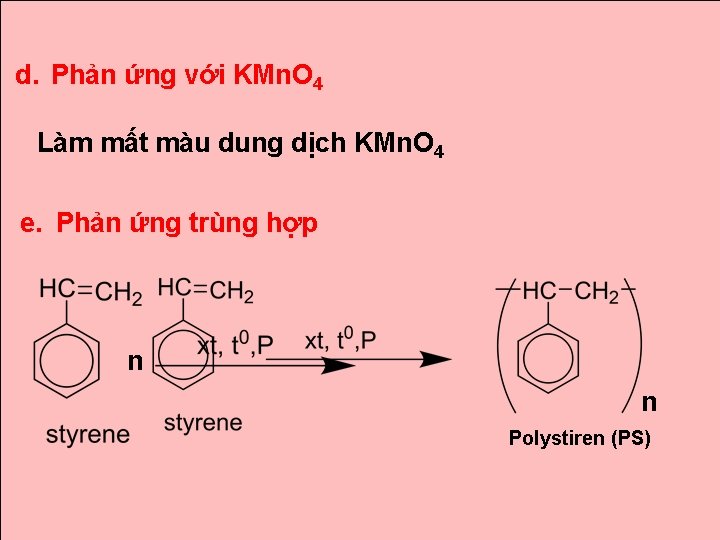
d. Phản ứng với KMn. O 4 Làm mất màu dung dịch KMn. O 4 e. Phản ứng trùng hợp n n Polystiren (PS)

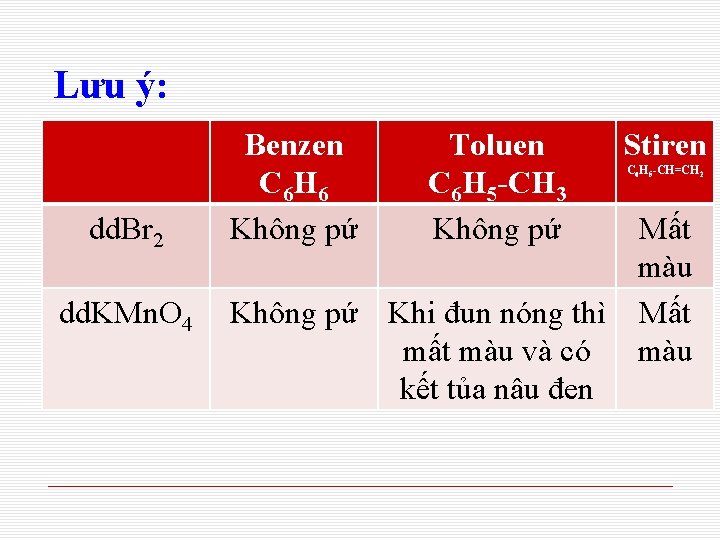
Lưu ý: dd. Br 2 dd. KMn. O 4 Benzen C 6 H 6 Không pứ Toluen C 6 H 5 -CH 3 Không pứ Stiren C 6 H 5 -CH=CH 2 Mất màu Không pứ Khi đun nóng thì Mất màu và có màu kết tủa nâu đen

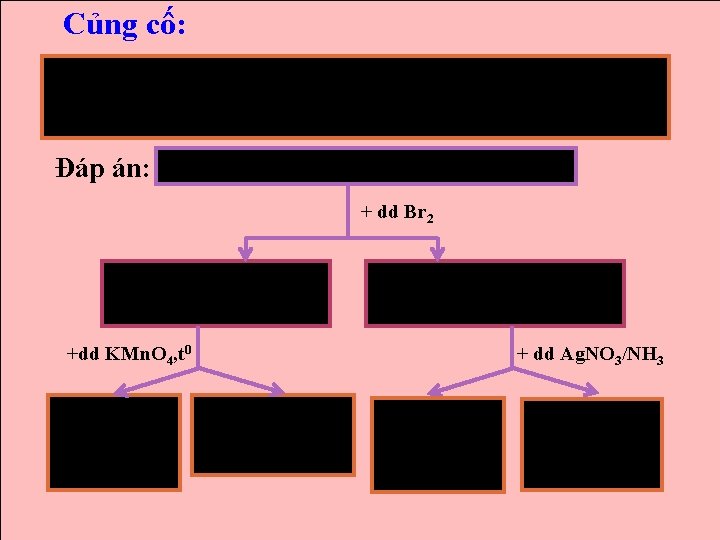
Củng cố: Dùng phương pháp hóa học nhận biết các chất sau: benzen, toluen, pent-1 -in, but-2 -en. Đáp án: Benzen, toluen, pent-1 -in, but-2 -en + dd Br 2 Ko hiện tượng: benzen, toluen. Dd Br 2 mất màu: pent-1 -in, but-2 -en +dd KMn. O 4, t 0 Ko hiện tượng: benzen + dd Ag. NO 3/NH 3 dd KMn. O 4 mất màu, có nâu đen: toluen Ko hiện tượng: but-2 -en Có vàng : pent-1 -in