Travaux dirigs d Atomistique Srie N 1 Exercice


























- Slides: 29

Travaux dirigés d’ Atomistique Série N°. 1 Exercice 1 Les masses du proton, du neutron et de l'électron sont respectivement de 1, 6723842. 10 -24 g, 1, 6746887. 10 -24 g et 9, 1095340. 10 -28 g. 1. Définir l'unité de masse atomique (u. m. a). Donner sa valeur en g avec les mêmes chiffres significatifs que les masses des particules du même ordre de grandeur. 2. Calculer en u. m. a. et à 10 -4 près, les masses du proton, du neutron et de l'électron.

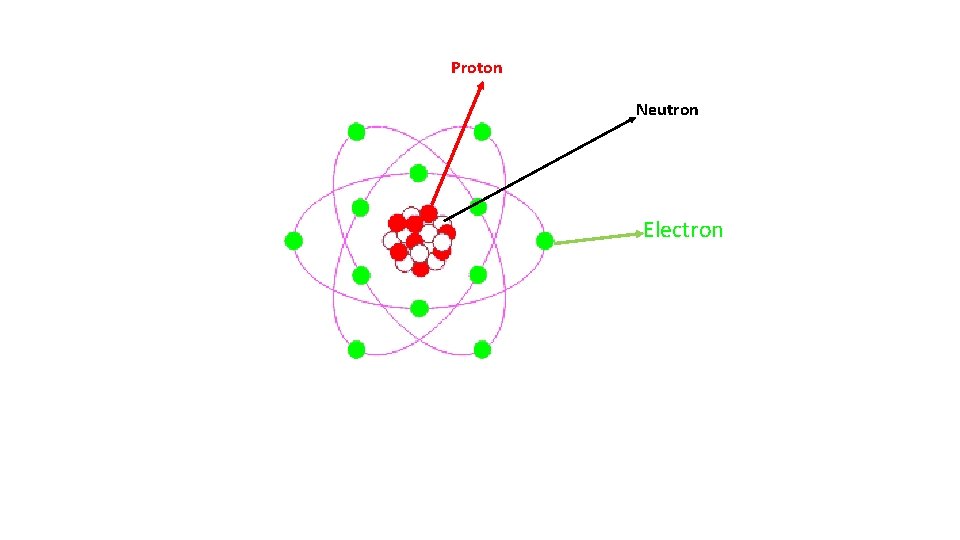
Proton Neutron Electron

Un élément chimique de symbole X est caractérisé par son numéro atomique Z et son nombre de masse A : x z A A : nombre de masse de l’atome. Il désigne le nombre de nucléons, soit la somme du nombre de protons et du nombre de neutrons. A = Σ protons + Σ neutrons Comme Σ protons = Z, on pose Σ neutrons = N ⇒ A = Z + N avec A ∈ N∗ Z : désigne le nombre de protons. 3

Lorsque, le nombre de proton est égale au nombre d’électron l’atome est dit neutre. Les atomes sont susceptibles de se charger électriquement en gagnant ou en perdant un ou plusieurs électrons : on parle alors d'ions. X+ L’atome a perdu un électron (Cation) X- L’atome a gagné un électron (Anion) 4

Définition de l’unité de masse atomique : u. m. a L’Unité de Masse Atomique Elle est définie comme 1/12 de la masse d'un atome de Carbone 12 C (carbone), Une mole de carbone C pesant par convention 12 g et correspondant à N atomes de carbone. (N=6, 02. 10 23 ) Pèse 1 mole d’atome (N atomes) 12 g Pèse 1 atome ? Un atome de carbone pèse donc 12/N(g) et l'unité de masse atomique vaut donc (1/12) x(12/N ) = 1/N (g). Un atome à une masse de M (uma) signifie que sa masse molaire atomique est de M (g). 1 u. m. a = 1/ N( )g = 1/6, 022 1023 1, 6605779. 10 -24 g 5

La masse atomique d’un élément est la masse en g de N atomes : N(Z+N)x 1/ N = Z+N = A La masse de l'atome exprimée en u. m. a ou sa masse molaire exprimée en g sont pratiquement égales à son nombre de masse A = Z + N. 6



Rappel : La masse de l'atome exprimée en u. m. a ou sa masse molaire exprimée en g sont pratiquement égales à son nombre de masse A = Z + N. mexp = 85, 911 uma Sachant que (1 u. m. a = 1/ N( )g = 1, 6605779. 10 -24 g Nous aurons en g: 85, 911 x 1, 6605779. 10 -24 = 1, 4266. 10 -22 g donc mexp = 1, 4266 10 -22 g/atome


m = mexp - mth = 85 , 911 - 86. 681 = -0, 77 uma Donc il ya une perte de masse de 0, 77 uma/atome de Kr. m (perte de masse par atome de Kr) = 0, 77 1, 660577 10 -24 = 1, 2786 10 -24 g/atome de Kr Une partie de la masse des particules constituant un atome ne peut pas purement et simplement disparaitre lorsque ces particules se trouvent réunies dans cet atome. Qu’a pu devenir la masse perdue ?

Défaut de masse On appelle défaut de masse d'un noyau la différence entre la masse totale des A nucléons séparés ( Z protons et N neutrons ) , au repos et la masse du noyau formé au repos. La masse m d’un noyau est toujours inférieure à la somme des masses de ses nucléons isolés. Défaut de masse m : mnoyau < Z× mp + N ×mn Δm = mnoyau – (Z × mp + N × mn) Δm <0 (toujours ) car il y a perte de la matière lors de la formation du noyau.

Energie de cohésion ØLe défaut de masse Δm correspond à une libération d’énergie (E) appelée énergie de liaison E <0 ØE est absorbée par les nucléons lors de la réaction de formation d’un noyau stable Z + N X + E E = Δm × c 2 (Mev/mol) (relation d’Einstein) C : célérité ou vitesse de la lumière dans le vide = 3. 108 m/s ØL’énergie de cohésion (Ech) : est l’ énergie nécessaire pour dissocier le noyau en ses nucléons Ech = - E >0

Exercice 3 Le Béryllium Be (Z=4) ne possède qu’un seul isotope stable, 9 Be dont la masse expérimentale est de 9, 012 g. mol-1 1) Donner la composition de cet isotope. 2) Calculez la masse «théorique» du noyau de cet isotope en u. m. a, et en déduire sa masse molaire «théorique» en g. mol-1. 3) Comparer la masse théorique et expérimentale, et en déduire la perte de masse. Comment explique-t-on cette perte de masse. 4) Calculez l’énergie de cohésion. Deux atomes sont dits isotopes si leur noyau a un nombre de protons identique mais un nombre de neutrons différent.

Solution Composition : e = 4, p = 4, n = 5 mth = 4. 1, 0071 + 5. 1, 0085 = 9, 071 uma, Remarque : La masse de l'atome exprimée en u. m. a ou sa masse molaire exprimée en g sont pratiquement égales à son nombre de masse A = Z + N. Donc : masse molaire théorique est : 9, 071 g/mole

m = mexp - mth = 9, 012 – 9, 071 = - 0, 059 uma Cette perte de masse se traduit par une libération d’énergie E appelée énergie de liaison du noyau. L’énergie de cohésion : E = m. C 2 = 0, 059 10 -3. (3. 108)2 = 3, 13 108 j/mole Ou bien : 3, 13 108 / 6, 02, 1023 =5, 2 10 -16 j/atome.


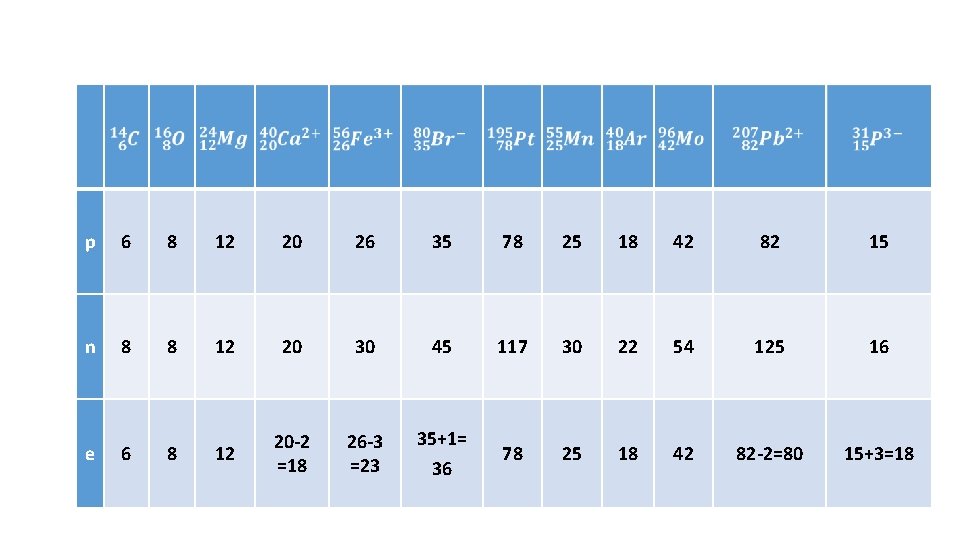
p 6 8 12 20 26 35 78 25 18 42 82 15 n 8 8 12 20 30 45 117 30 22 54 125 16 12 20 -2 =18 26 -3 =23 35+1= 36 78 25 18 42 82 -2=80 15+3=18 e 6 8

Exercice 5 Le lithium naturel est un mélange de deux isotopes 6 Li et 7 Li dont les masses atomiques sont respectivement 6, 017 et 7, 018. Sa masse atomique apparente est 6, 943. Quelle est sa composition isotopique (% de chaque isotope = Xi)? Deux atomes sont dits isotopes si leur noyau a un nombre de protons identique mais un nombre de neutrons différent. M = xi Mi/100 et xi = 100 xi désignant l'abondance naturelle de l'isotope i de masse molaire Mi.


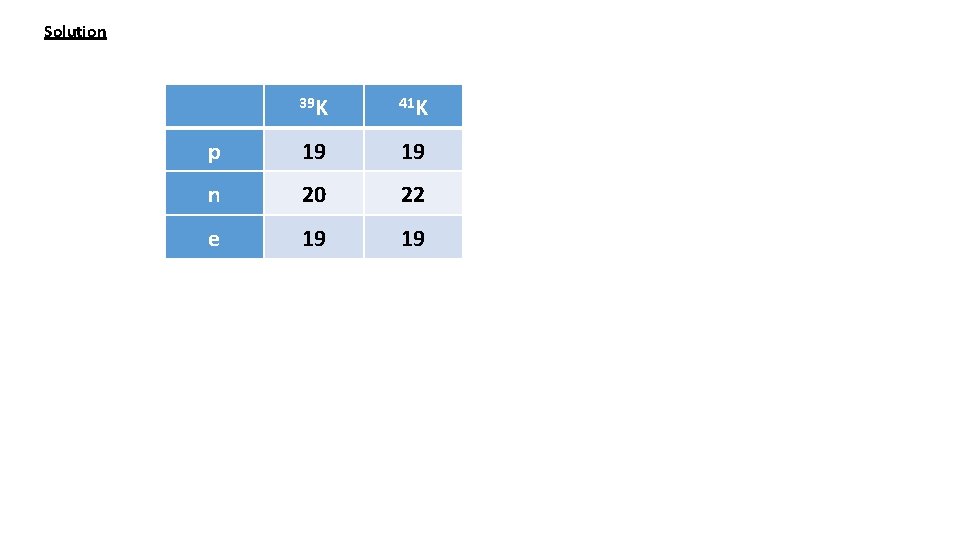
Exercice 6 (Examen Janvier 2013) Le potassium K (Z=19) existe sous forme de deux isotopes stables 39 K et 41 K Donner pour chaque isotope la composition (nombre de protons; nombre de neutrons et nombre d’électrons) La masse molaire du potassium naturel est de 39, 10 gmol-1. Evaluer approximativement l’abondance naturelle de chacun des isotopes.

Solution 39 K 41 K p 19 19 n 20 22 e 19 19


Exercice 7 Le Silicium naturel est un mélange de trois isotopes stables 28 Si, 29 Si et 30 Si. L'abondance isotopique naturelle de l'isotope le plus abondant est de 92, 23%. La masse molaire atomique du Silicium naturel est de 28, 085 g. mol-1. 1) Quel est l'isotope du Silicium le plus abondant ? 2) Calculer l'abondance naturelle des deux autres isotopes.

Comme la masse molaire atomique du Silicium naturel est de 28, 085 g. mol -1, donc elle pratiquement égale à celle de l’isotope 28. L'isotope du Silicium le plus abondant (92. 23%) est : 28 Si Remarque : La masse de l'atome exprimée en u. m. a ou sa masse molaire exprimée en g sont pratiquement égales à son nombre de masse A = Z + N. X 1 = abondance de 28 Si = 92. 23% X 2 = abondance de 29 Si = ? X 3 = abondance de 30 Si = ?

X 2 + X 3 = 7, 77 X 3 = 7, 77 - X 2 29. X 2 + 30. X 3 = 226, 06 29. X 2 + 30(7, 77 -X 2) =226, 06 Donc X 1= 92, 23%, X 2 = 7, 04%, X 3 = 0, 73%

Exercice 8 (Examen session rattrapage 2015) Le lithium naturel est un mélange de 2 isotopes 36 Li et 37 Li dont les masses atomiques sont respectivement 6, 017 et 7, 018 g/mol. Sa masse atomique est 6, 943 g/mol. Quelle est l’abondance de chaque isotope ? Calculer la perte de masse et l’énergie de cohésion relatives à la formation du noyau de l’atome du lithium 36 Li. Données : La masses du proton mp=1, 673 10 -27 kg ; la masse du neutron mn=1, 675 10 -27 kg ; le nombre d’Avogadro N =6, 023 1023 mol-1 ; 1 e. V = 1. 6 10 -19 J.


1. L’énergie de cohésion Ecoh=-El El= M×c 2 M = Mexp - Mth Mexp= 6, 017 g/mol Mth(6 Li) = [ Z×Mp + (A-Z) ×Mn + ZMe] N Me<<Mp et Me<<Mn Donc Mth(6 Li) = [3×Mp+ (6 -3) ×Mn] N Mth(6 Li) =[3× 1, 673 10 -27 10 -3+ (6 -3) × 1, 675 10 -27 10 -3] 6, 023 1023 Mth(6 Li) = 6. 049 g/mol M=Mexp-Mth= - 0. 032 g/mol E l= M×c 2 = - 0. 032× 10 -3× 9× 1016= - 2, 28× 1012 J/mol 12