Transcrio do RNA em Organismos Procariotos 1 Aspectos










- Slides: 31

Transcrição do RNA em Organismos Procariotos 1 -Aspectos Gerais 2 -RNA Polimerase DNA Dependente 3 -Região Promotora 4 -Transcrição em E. coli 5 -m. RNA policistrônico Edmar Vaz de Andrade www. ufam. edu. br/~edandrade

1 -Aspectos Gerais Comparação entre os processos de transcrição e replicação • Replicação do DNA • Direção da síntese: 5’-3’ • Cromossomo inteiro é copiado • Requer iniciador • As duas fitas da dupla hélice são copiadas • Transcrição do RNA • Direção da síntese: 5’-3’ • Segmentos gênicos são copiados • Não requer iniciador • Somente uma fita serve como molde em um dado momento

1 -Aspectos Gerais • Tipos de RNAs transcritos – m. RNA: codifica a seqüência de aminoácidos de cadeias polipeptídicas. – t. RNA: transporta um aminoácido específico durante a síntese protéica. – r. RNA: interage com proteínas constituindo os ribossomos (maquinário da síntese protéica). – RNAs reguladores: regulação de diferentes processos celulares

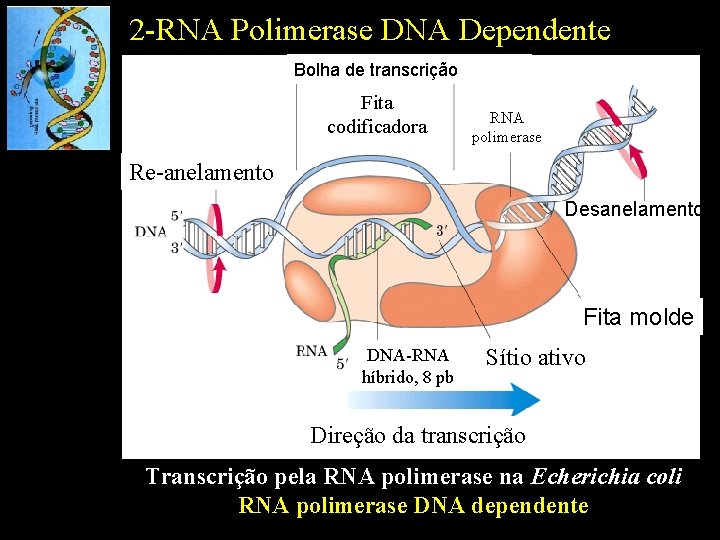
2 -RNA Polimerase DNA Dependente Bolha de transcrição Fita codificadora RNA polimerase Re-anelamento Desanelamento Fita molde DNA-RNA híbrido, 8 pb Sítio ativo Direção da transcrição Transcrição pela RNA polimerase na Echerichia coli RNA polimerase DNA dependente

2 -RNA Polimerase DNA Dependente Fita 5’-3’: fita codificadora Fita 3’-5’: fita molde RNA transcrito O RNA é transcrito a partir da fita molde e sua sequência é idêntica a da fita codidificadora (U/T)

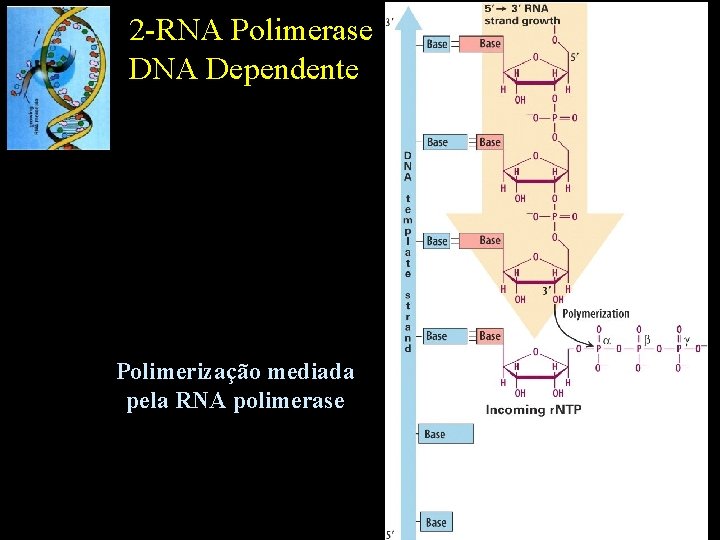
2 -RNA Polimerase DNA Dependente Polimerização mediada pela RNA polimerase

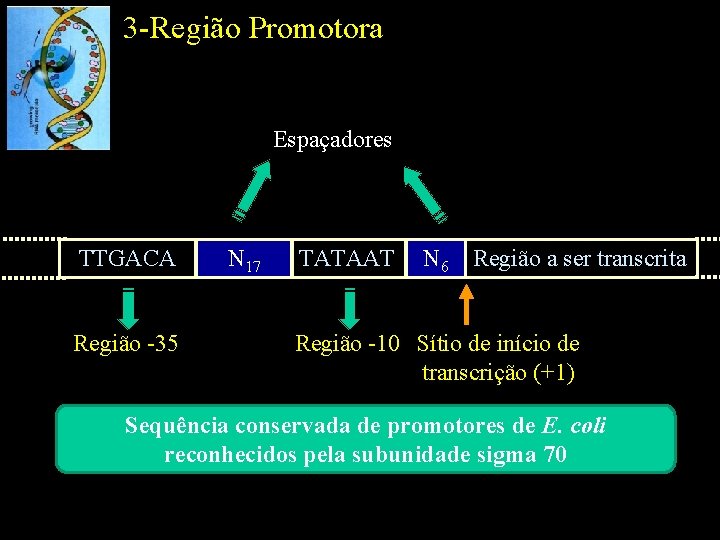
3 -Região Promotora Espaçadores TTGACA Região -35 N 17 TATAAT N 6 Região a ser transcrita Região -10 Sítio de início de transcrição (+1) Sequência conservada de promotores de E. coli reconhecidos pela subunidade sigma 70

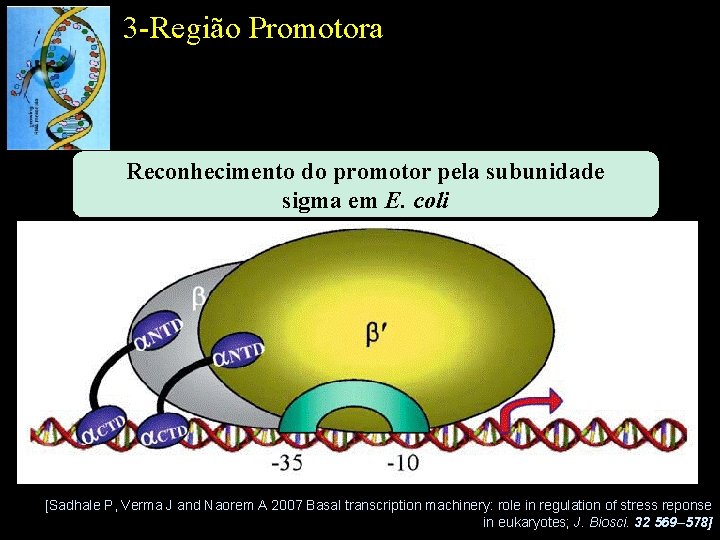
2 -RNA Polimerase DNA Dependente Genes essencias para a manutenção celular – house keeping genes Genes regulados por nitrogênio Genes relacionados com a adaptação ao estresse térmico Genes relacionados com quimiotaxia e síntese de flagelos Genes relacionados com a adaptação ao estresse térmico extremo Subunidades sigma descritas em E. coli [Sadhale P, Verma J and Naorem A 2007 Basal transcription machinery: role in regulation of stress reponse in eukaryotes; J. Biosci. 32 569– 578]

3 -Região Promotora • Eficiência da ligação da RNA polimerase ao promotor – Sequência nucleotídica do promotor – Espaçamento entre as regiões -10 e -35 – Distância entre as regiões -10 e -35 e o sítio de início de transcrição

3 -Região Promotora Reconhecimento do promotor pela subunidade sigma em E. coli [Sadhale P, Verma J and Naorem A 2007 Basal transcription machinery: role in regulation of stress reponse in eukaryotes; J. Biosci. 32 569– 578]

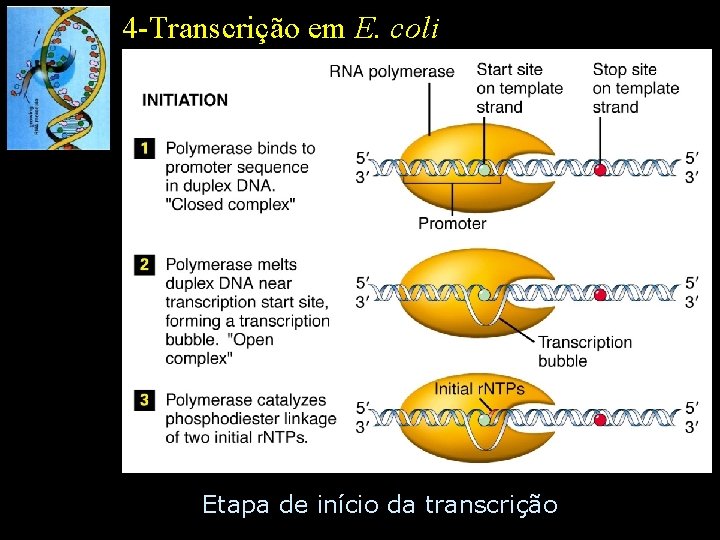
4 -Transcrição em E. coli Etapa de início da transcrição

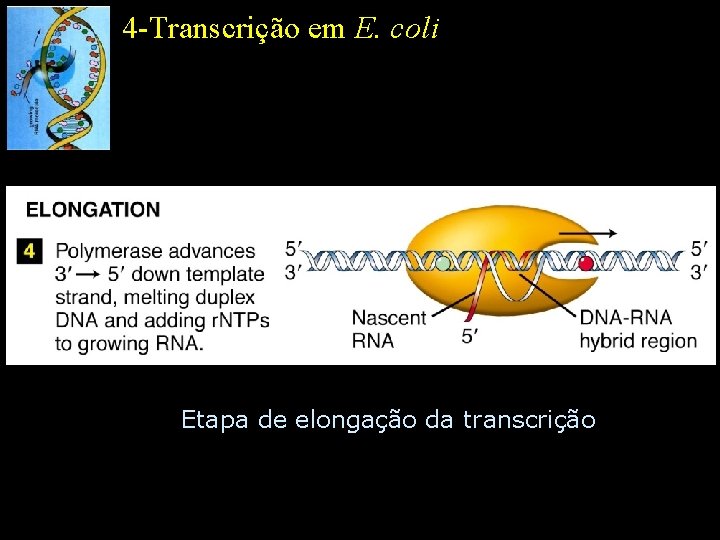
4 -Transcrição em E. coli Etapa de elongação da transcrição

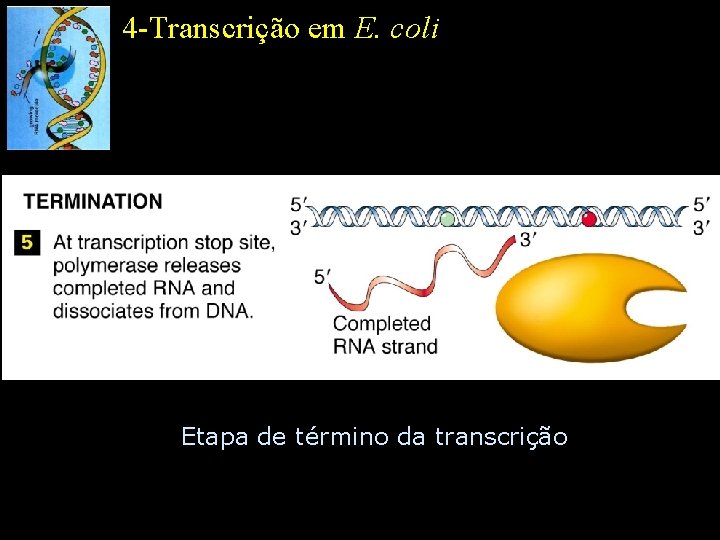
4 -Transcrição em E. coli Etapa de término da transcrição

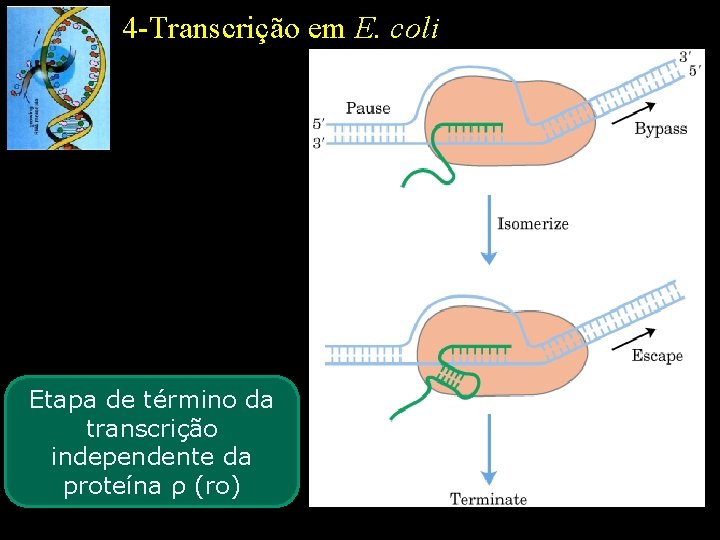
4 -Transcrição em E. coli Etapa de término da transcrição independente da proteína ρ (ro)

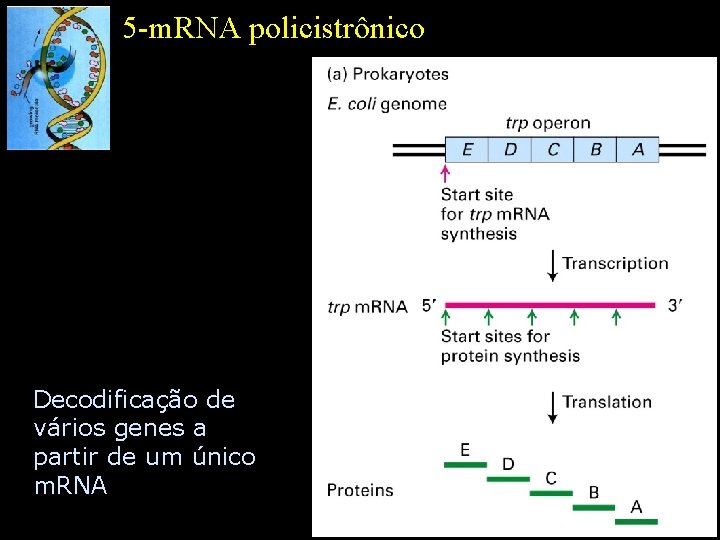
5 -m. RNA policistrônico Decodificação de vários genes a partir de um único m. RNA

Transcrição do RNA em Organismos Eucariotos 1 -Aspectos gerais 2 -Complexo de iniciação 3 -Processamento Pós-Transcricioanal 4 -DNA polimerase RNA dependente

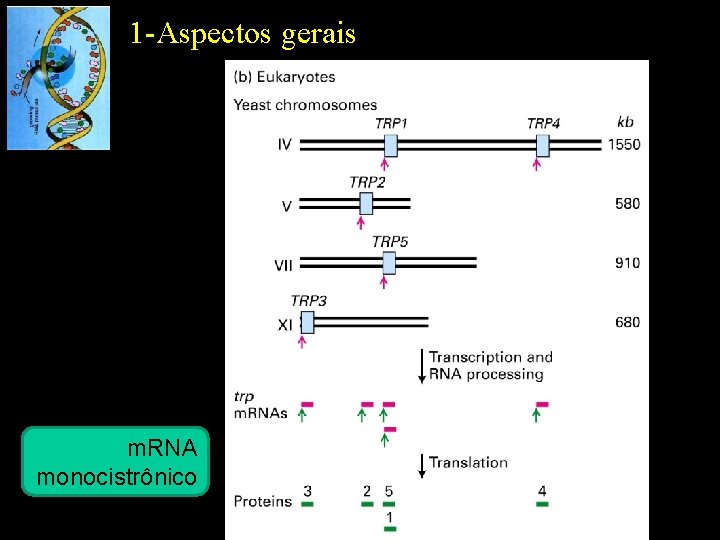
1 -Aspectos gerais m. RNA monocistrônico

1 -Aspectos gerais Tipos de RNA polimerase em eucariotos • RNA polimerase I – Transcrição de r. RNA • RNA polimerase II – Transcrição de m. RNA • RNA polimerase III – Transcrição de t. RNA, r. RNA e RNAs reguladores

1 -Aspectos gerais Seqüências reguladoras Seqüência TATA Seqüência Inr Promotores reconhecidos pela RNA polimerase II de eucariotos.

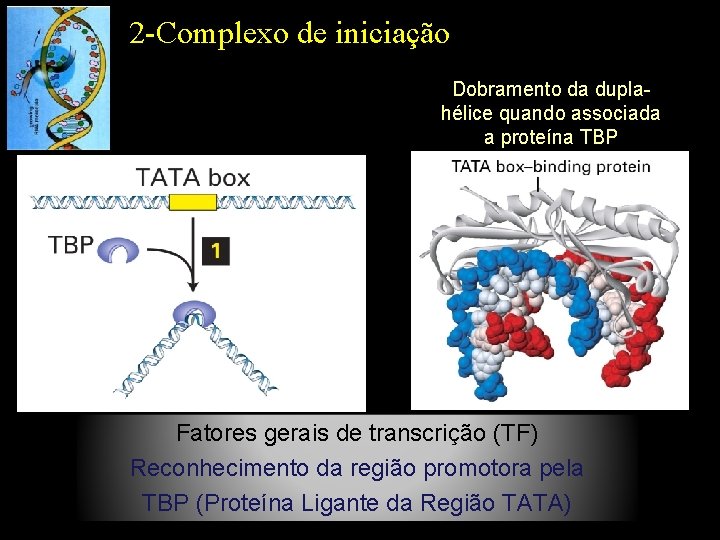
2 -Complexo de iniciação Dobramento da duplahélice quando associada a proteína TBP Fatores gerais de transcrição (TF) Reconhecimento da região promotora pela TBP (Proteína Ligante da Região TATA)

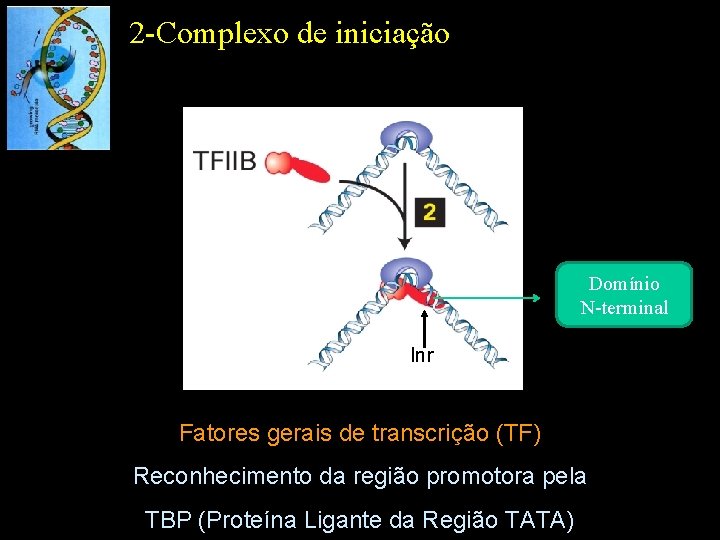
2 -Complexo de iniciação Domínio N-terminal Inr Fatores gerais de transcrição (TF) Reconhecimento da região promotora pela TBP (Proteína Ligante da Região TATA)

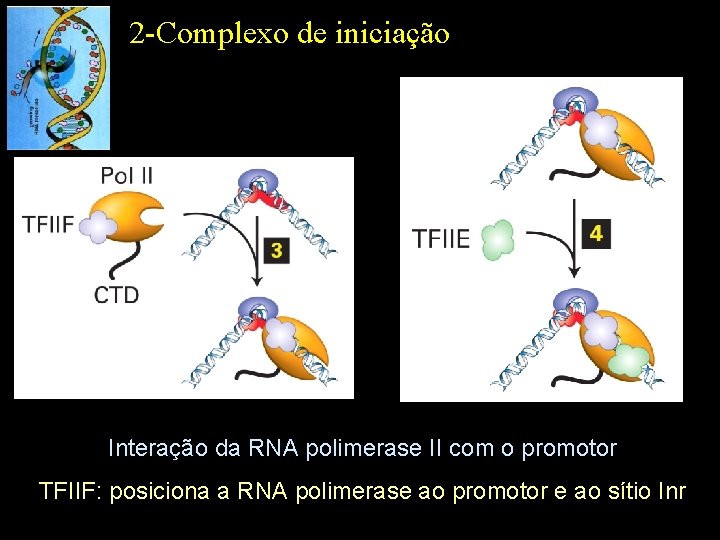
2 -Complexo de iniciação Interação da RNA polimerase II com o promotor TFIIF: posiciona a RNA polimerase ao promotor e ao sítio Inr

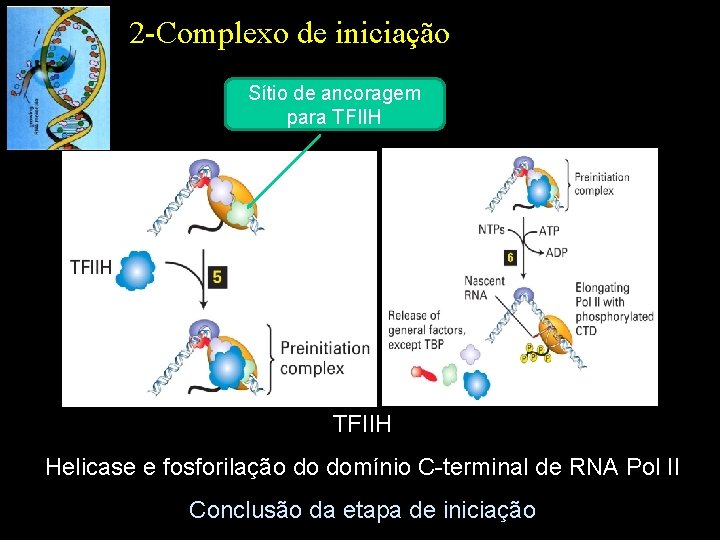
2 -Complexo de iniciação Sítio de ancoragem para TFIIH Helicase e fosforilação do domínio C-terminal de RNA Pol II Conclusão da etapa de iniciação

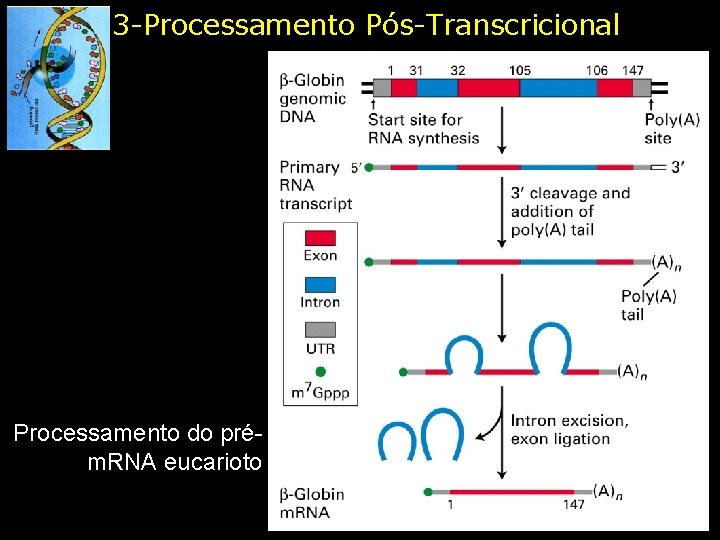
3 -Processamento Pós-Transcricional Processamento do prém. RNA eucarioto

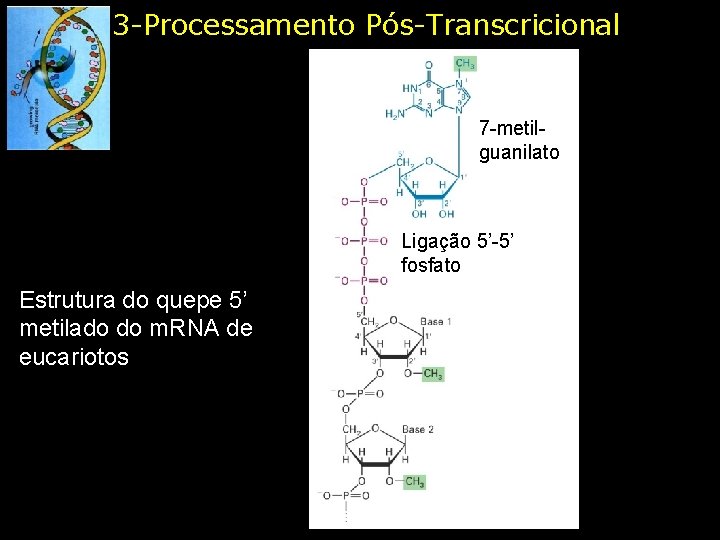
3 -Processamento Pós-Transcricional 7 -metilguanilato Ligação 5’-5’ fosfato Estrutura do quepe 5’ metilado do m. RNA de eucariotos

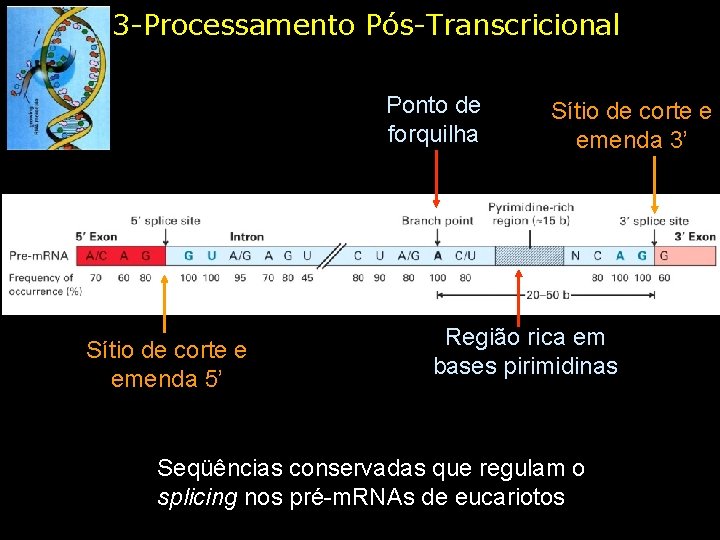
3 -Processamento Pós-Transcricional Ponto de forquilha Sítio de corte e emenda 5’ Sítio de corte e emenda 3’ Região rica em bases pirimidinas Seqüências conservadas que regulam o splicing nos pré-m. RNAs de eucariotos

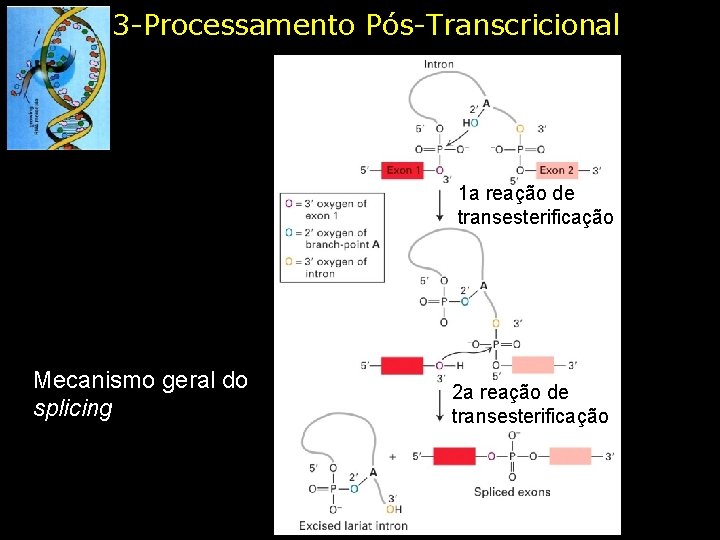
3 -Processamento Pós-Transcricional 1 a reação de transesterificação Mecanismo geral do splicing 2 a reação de transesterificação

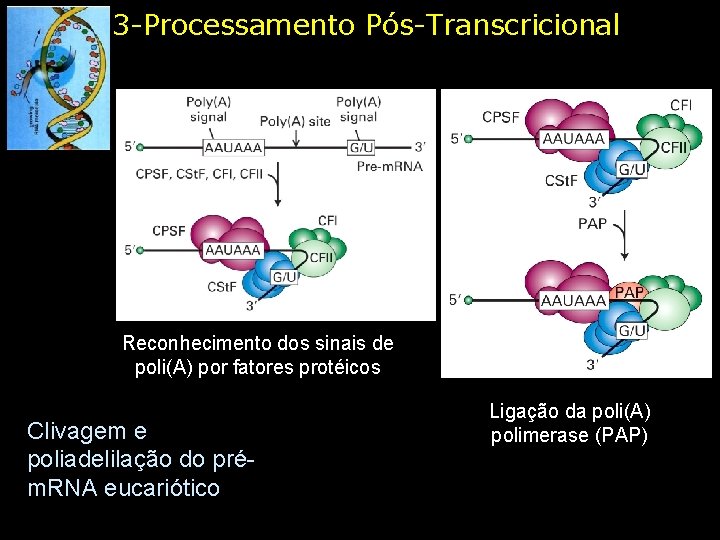
3 -Processamento Pós-Transcricional Reconhecimento dos sinais de poli(A) por fatores protéicos Clivagem e poliadelilação do prém. RNA eucariótico Ligação da poli(A) polimerase (PAP)

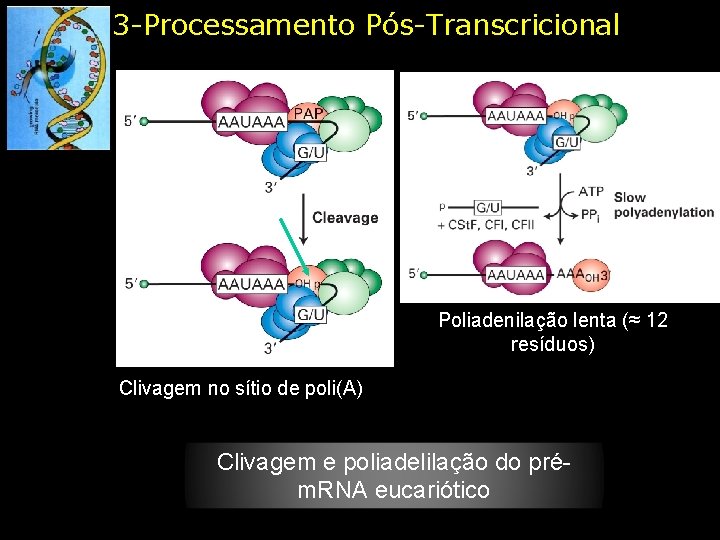
3 -Processamento Pós-Transcricional Poliadenilação lenta (≈ 12 resíduos) Clivagem no sítio de poli(A) Clivagem e poliadelilação do prém. RNA eucariótico

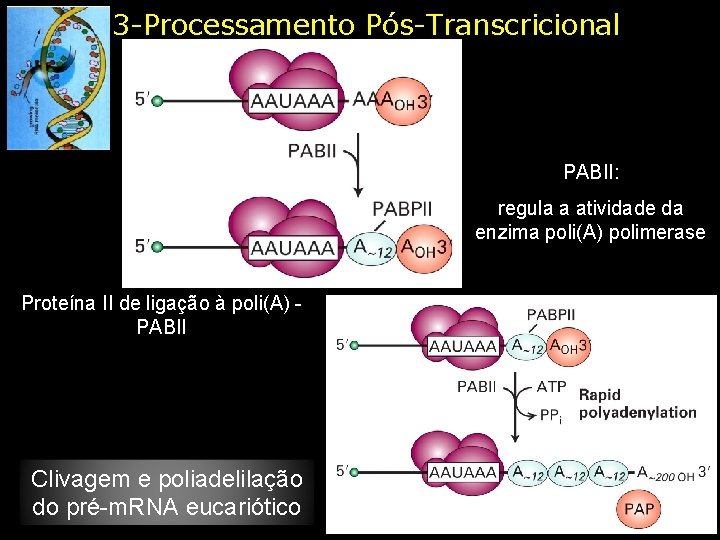
3 -Processamento Pós-Transcricional PABII: regula a atividade da enzima poli(A) polimerase Proteína II de ligação à poli(A) PABII Clivagem e poliadelilação do pré-m. RNA eucariótico

Quando não mencionado, as figuras apresentadas foram retiradas, com ou sem modificações, das seguintes referências: 1. LODISH, H; DARNELL, J. E. e BALTIMORE, D. 2005. “Biologia Celular e Molecular”, 5ª edição. Artmed Editora SA. Porto Alegre-Brasil. (www. whfreeman. com/lodish) 2. LEHNINGER, A. L. NELSON, D. L e COX, M. M. 2000. “Principles of Biochemistry”. 3ª Edition, Worth Publitions.